Россия
Россия
Россия
Россия
Россия
Биотрансформация рыбного сырья бактериальными заквасочными культурами, которая входит в приоритет развивающих направлений согласно Стратегии повышения качества пищевой продукции в Российской Федерации до 2030 г., положительно повлияет на сроки годности рыбной продукции, ее органолептические свойства и питательную ценность за счет образования метаболитов жизнедеятельности бактериальных заквасочных культур, являющихся основным фактором биоконсервирования, синтеза витаминов и других биологически активных веществ. Пробиотические свойства бактериальных заквасочных культур будут оказывать существенное влияние на оптимизацию индигенной микрофлоры желудочно-кишечного тракта, укрепляя организм человека и его иммунную систему в целом, что поддерживает принципы здорового образа жизни. Проведены исследования по изучению возможности использования бактериальных заквасочных культур для биотрансформации рыбного сырья с целью дальнейшего получения пробиотического пищевого продукта на его основе. Представлены данные по влиянию бактериальных заквасочных культур на органолептические, микроструктурные, физико-химические и функционально-технологические характеристики рыбного сырья. Выявлено количество остаточных клеток бактериальных заквасочных культур в мышечной ткани филе рыб, которое соответствует требованиям, предъявляемым к пробиотическим продуктам. Определена выживаемость под действием температур и динамика изменения численности бактериальных заквасочных культур при хранении в образцах мышечной ткани филе рыб, данные о которой будут использоваться для разработки и корректировки термических режимов обработки конечного продукта. Проанализировано влияние бактериальных заквасочных культур на изменения КМАФАнМ после биотрансформации и в процессе хранения, на основании чего обоснован эффект биоконсервирования. Результаты проведенных исследований стали основой для отбора наиболее подходящих бактериальных заквасочных культур, а также верификации оптимальных условий и параметров, спрогнозированных алгоритмами математического моделирования, для проведения биотрансформации мышечной ткани филе рыб. На следующем этапе планируется проведение исследований по изучению возможности применения обработанного бактериальными заквасочными культурами рыбного сырья в рецептурных составах продуктов «быстрого питания», содержащих функциональные компоненты.
филе рыб, мышечная ткань, бактериальные заквасочные культуры, пробиотики, биотрансформация, модельный раствор
Введение
Согласно Стратегии повышения качества пищевой продукции в Российской Федерации до 2030 г. приоритетным направлением является разработка современных технологий производства пищевых ингредиентов и технологии переработки пищевой продукции, включая биотехнологии для создания условий производства пищевой продукции нового поколения с заданными характеристиками качества, и продвижения принципов здорового питания.
В соответствии с этим исследования в области создания технологий и проектирования рецептурных составов функциональных, обогащенных, специализированных пищевых продуктов, в частности на рыбной основе, с использованием методов биотехнологической обработки, например биотрансформация сырья бактериальными заквасочными культурами (БЗК), являются актуальными и развивающимися [1].
В пищевой биотехнологии на данном периоде развития особое внимание уделяется использованию перспективных штаммов БЗК для получения пищевой продукции с улучшенными качественными характеристиками и функциональной направленностью. Бактериальные заквасочные культуры как защитные микроорганизмы проявляют антиоксидантные, бактерицидные и антагонистические свойства, и за счет образования метаболитов (кислоты, бактериоцины) возможно возникновение эффекта биоконсервирования, что будет способствовать продлению сроков годности пищевой продукции, в частности рыбной. Применение БЗК в технологии производства пищевой рыбной продукции также позволит улучшить ее органолептические свойства (коррекция консистенции и минимизация рыбного вкуса и запаха за счет мягкой деструкции белковых компонентов и снижения уровня образования азотистых летучих оснований в мышечной ткани рыб) и повысить питательную ценность (за счет накопления белковых и эссенциальных веществ) [2, 3]. При этом биохимические процессы, протекающие в рыбном сырье под действием БЗК и приводящие к накоплению белковых и эссенциальных веществ, а также наличие пробиотиков
и постбиотиков способствуют получению обогащенного пищевого продукта, соответствующего принципам здорового образа жизни, с пробиотической направленностью для поддержания функциональной активности органов и тканей человека, корректирования состава внутренней индигенной микрофлоры кишечной микробиоты и, как следствие, повышения иммунной защиты организма [4].
В связи с этим основной целью научных исследований являлась верификация оптимальных условий и технологических параметров биотрансформации рыбного сырья с применением БЗК.
Объекты и методы исследований
В качестве основных объектов для изучения возможности биотрансформации рыбного сырья БЗК были выбраны:
– филе промысловых видов рыб – минтай (Theragra chalcogramma), треска (Gadus macrocephalus), макрурус малоглазый (Albatrossia pectoralis);
– филе потенциально промысловых видов рыб – получешуйника Гилберта (Hemilepidotus gilberti);
– ранее подобранные штаммы БЗК [5]: Lactobacillus casei LC 4P1, Lactobacillus acidophilus А630, Lactobacillus delbrueckii subsp. bulgaricus (Пб), Streptococcus thermophilus ST 440, Propionibacterium freudenreichii KM-186, Bifidobacterium bifidum 83;
– модельные растворы среды для биотрансформации: 3,5 %-й раствор глюкозы, восстановленная молочная сыворотка.
Органолептическую оценку рыбного сырья после биотрансформации БЗК (цвет, запах, консистенция) проводили по разработанной 5-балльной шкале [6]. Массовую долю воды, белка, жира углеводов и золы определяли по ГОСТ 7636-85, ГОСТ 34134-2017 [7, 8]. Активную кислотность (рН) определяли с помощью рН-метра Testo 106. Активность воды (Aw) определяли на приборе Aqualab 4TEV. Титруемую кислотность определяли по ГОСТ 3624-92 [9]. Влагосвязывающую способность (ВСС) определяли весовым методом [8]. Исследование микроструктуры образцов мышечной ткани филе рыб проводили с использованием бинокулярного микроскопа марки «Микмед-5» с оптическим увеличением × 40. Общую микробную обсемененность (КМАФАнМ) и общее количество молочнокислых бактерий в образцах мышечной ткани филе рыб до и после биотрансформации БЗК определяли с использованием петрифильмов 3M Petrifilm (AC) в соответствии с методическими указаниями производителя [10].
Результаты и их обсуждение
На основании ранее проведенного математического моделирования [11] рассчитаны и подобраны оптимальные условия и параметры биотрансформации рыбного сырья с применением БЗК: средами для биотрансформации были выбраны 3,5 %-й раствор глюкозы и восстановленная молочная сыворотка; количество вносимых БЗК – не менее 4,5 · 10 lg КОЕ/г для раствора глюкозы и 5 · 10 lg КОЕ/г для восстановленной молочной сыворотки; рН среды для биотрансформации – не более 5,3–5,9 в начале процесса и не менее 4,3–4,6 в конце процесса; соотношение «сырье : раствор» было принято 1 : 2; продолжительность процесса биотрансформации – не менее 5 ч при температуре 37 °С.
На данном этапе исследований экспериментально подтверждались подобранные с помощью математического моделирования условия, режимы, эффект биоконсервирования, а также производился выбор определенных БЗК и сред для биотрансформации рыбного сырья посредством изучения влияния штаммов микроорганизмов и их метаболитов на свойства и показатели качества мышечной ткани филе изучаемых видов рыб. Контрольным образцом являлась мышечная ткань филе рыб, не подвергнутая воздействию БЗК.
В результате проведенного процесса биотрансформации показатели химического состава обработанных образцов мышечной ткани филе рыб под действием метаболитов БЗК претерпевали некоторые изменения по сравнению с контролем (табл. 1).
Таблица 1
Table 1
Средние значения химического состава до и после биотрансформации образцов мышечной ткани филе рыб
в модельных растворах (раствор глюкозы и восстановленная молочная сыворотка)*
Average values of chemical composition before and after biotransformation of fish fillet muscle tissue samples
in model solutions (glucose solution and reduced whey)
|
Образцы мышечной ткани |
Показатель, % |
||||||||||||||
|
белки |
жиры |
углеводы |
зола |
влага |
|||||||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Минтай |
17,40 |
18,70 |
18,01 |
0,11 |
0,04 |
0,04 |
0,39 |
0,06 |
0,09 |
1,00 |
0,79 |
0,29 |
81,10 |
80,99 |
80,87 |
|
Треска |
17,90 |
18,78 |
19,23 |
0,14 |
0,051 |
0,050 |
0,59 |
0,049 |
0,05 |
0,87 |
0,10 |
0,50 |
81,21 |
80,90 |
79,99 |
|
Макрурус |
7,80 |
8,86 |
9,06 |
0,11 |
0,08 |
0,08 |
0,12 |
0,09 |
0,08 |
1,10 |
0,70 |
0,08 |
90,89 |
89,20 |
89,15 |
|
Бычок |
18,39 |
19,25 |
18,99 |
0,52 |
0,45 |
0,45 |
0,52 |
0,49 |
0,36 |
1,02 |
0,78 |
0,36 |
79,54 |
78,82 |
78,99 |
* 1 – контроль; 2 – глюкоза; 3 – восстановленная молочная сыворотка.
Влияния вида БЗК на резкое изменение химического состава не обнаружено, в связи с этим указана средняя динамика в зависимости от вида мышечной ткани филе рыб и модельного раствора для биотрансформации.
Повышение содержания белка в среднем на 1 % (см. табл. 1) в образцах мышечной ткани рыб связано с накоплением бактериальной массы микроорганизмов в процессе своего развития. Особенно активное накопление биомассы наблюдалось с использованием штаммов БЗК L. acidophilus А630, L. casei LC 4P1, B. bifidum 83. При этом динамика роста содержания белка положительная как в 3,5 %-м растворе глюкозы, так и в восстановленной молочной сыворотке. Снижение количества жиров, углеводов и минеральных веществ связано с ростом БЗК в растворах, которые используют данные вещества (помимо внесенных углеводов) для своего питания и дальнейшего развития, а также с переходом растворяемых форм веществ в модельные растворы при биотрансформации [12].
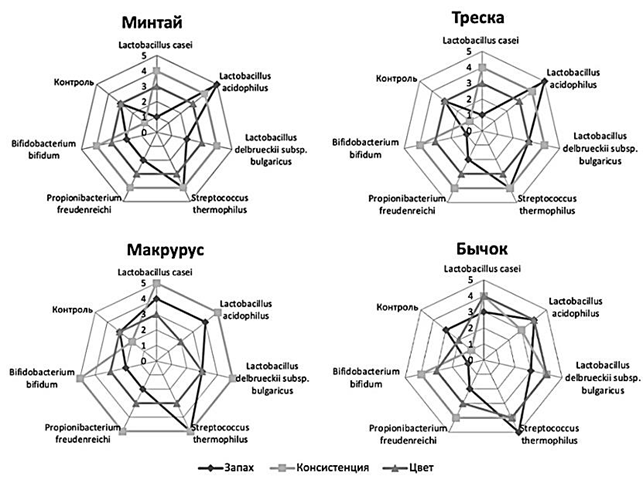
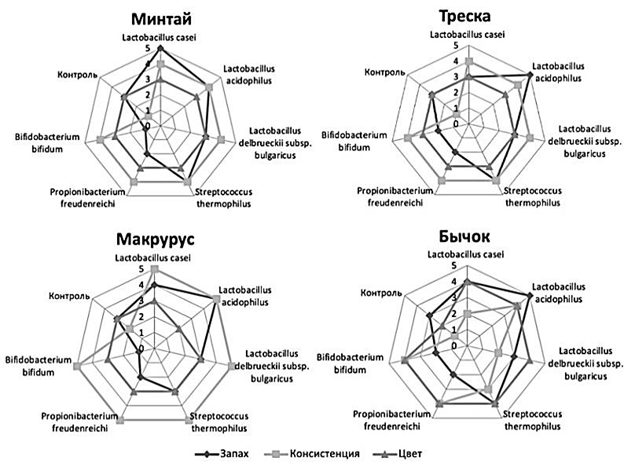
Данные по органолептической оценке в виде профилограмм запаха, консистенции и цвета образцов мышечной ткани филе рыб после процесса биотрансформации БЗК представлены на рис. 1.
а
б
Рис. 1. Профилограммы запаха, консистенции и цвета образцов мышечной ткани филе рыб до и после процесса
биотрансформации БЗК в модельных растворах: а – раствор глюкозы 3,5 %; б – восстановленная молочная сыворотка
Fig. 1. Profilograms of smell, consistency and color of fish fillet muscle tissue samples before and after the process
biotransformation of BPC in model solutions: a – glucose solution of 3.5%; б – reduced whey
Отмечалось, что обработка растворами с БЗК, кроме растворов с L. bulgaricus (Пб), P. freudenreichii KM-186, B. bifidum 83, положительно влияет на органолептические показатели филе выбранных видов рыб. В модельном растворе глюкозы (3,5 %) для мышечной ткани филе минтая и трески наиболее оптимальными БЗК оказались L. acidophilus А630, для макруруса и бычка – St. thermophilus ST 440, в восстановленной молочной сыворотке БЗК для мышечной ткани филе минтая – L. casei LC 4P1, трески, макруруса и бычка – L. acidophilus А630. Запах образцов исследования после биотрансформации был оценен как приятный с легкой кислинкой. Рыбный запах после воздействия L. acidophilus А630 и St. thermophilus ST 440, по сравнению с контролем, практически отсутствовал, и был оценен в 4–5 баллов. Исследованные образцы имели кремовый или серый цвет и консистенцию, распадающуюся на волокна по сравнению с более плотной консистенцией контрольных образцов мышечной ткани филе рыб (1–2 балла). В образцах мышечной ткани филе макруруса консистенция была мажущаяся (5 баллов).
Ароматические характеристики образцов с культурами БЗК L. bulgariсus (Пб), P. freudenreichii KM-186 и B. bifidum 83 характеризуются как специфичные и негармоничные (1–3 балла). В частности, при обработке пропионовыми (P. freudenreichii KM-186) и бифидобактериями (B. bifidum 83), присутствовали неприятные, несвойственные запахи, что связано со способностью данных микроорганизмов продуцировать уксусную и пропионовые кислоты, которые и обуславливают специфическое органолептическое восприятие [13].
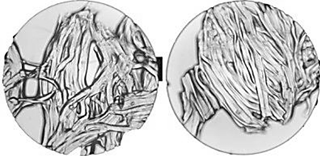
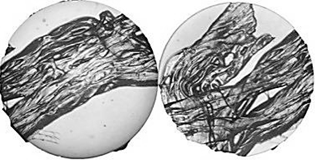
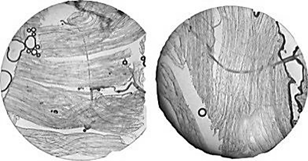
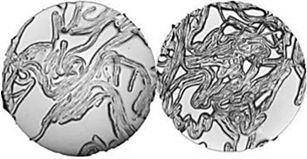
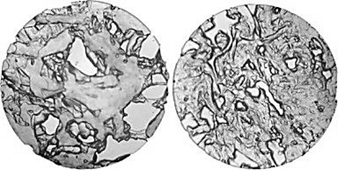
Были проведены микроструктурные исследования мышечной ткани филе выбранных видов рыб до и после процесса биотрансформации БЗК (рис. 2).
|
|
|
|
а
|
б
|
|
|
|
|
в
|
г
|
|
|
|
|
д
|
е
|
|
|
|
|
ж |
з |
Рис. 2. Микроструктура мышечной ткани филе рыб до и после биотрансформации БЗК:
а – минтай до обработки; б – минтай после обработки; в – треска до обработки; г – треска после обработки;
д – макрурус до обработки; е – макрурус после обработки; ж – бычок до обработки; з – бычок после обработки.
Ув. × 40
Fig. 2. Microstructure of muscle tissue of fish fillets before and after biotransformation of BZK:
a – pollock before processing; б – pollock after processing; в – cod before processing; г – cod after processing;
д – macrurus before processing; е – macrurus after processing; ж – goby before processing; з – goby after processing.
Enlargement × 40
Следует отметить, что микроструктура мышечной ткани не зависела от вида используемого БЗК и среды при обработке и изменения были аналогичны друг другу, в связи с этим показана общая закономерность микроструктурных изменений.
Проанализировав микроструктуру мышечной ткани филе рыб до и после биотрансформации, можно сделать вывод, что после процесса волокна миофибрилл отделялись друг от друга и распадались на «нити», что, вероятнее всего, связано с воздействием кислот на белковую структуру самих волокон с последующей их деструкцией, приводящей к снижению прочности. Таким образом, обработанное рыбное сырье может являться оптимальной пищевой матрицей для создания гомогенизированных и тонкоизмельченных продуктов, что позволит модернизировать параметры измельчения за счет более мягкой структуры мышечной ткани [14].
В мышечной ткани филе рыб наблюдается незначительное снижение pH после 5 ч выдержки в используемых для процесса биотрансформации модельных растворах с БЗК, при этом под действием L. acidophilus А630 и St. thermophilus ST 440, по сравнению с другими БЗК (L. casei LC 4P1, L. bulgaricus (Пб), P. freudenreichii KM-186, B. bifidum 83), протекало более активное подкисление: в среде с глюкозой – для мышечной ткани филе минтая до 6,51, трески – 6,01, макруруса – 6,84, бычка – 5,98; в среде восстановленной молочной сыворотки для мышечной ткани филе минтая до 6,30, трески – 5,98, макруруса – 6,70, бычка – 5,70.
В сыворотке снижение рН в кислую сторону интенсивней по сравнению с раствором глюкозы. С целью ингибирования микроорганизмов кислые значения рН предпочтительнее, чем щелочные, но при этом сильного подкисления в образцах мышечной ткани рыб после процесса биотрансформации не наблюдается [15].
В модельных растворах (3,5 %-й раствор глюкозы и восстановленная молочная сыворотка) для биотрансформации вне зависимости друг от друга наблюдается снижение рН в среднем до 4,4 единицы, что связано с процессом метаболизма и последующим образованием органических кислот, влияющих на кислотности растворов [13]. Как показали исследования, характер изменения активной кислотности идентичен для всех образцов мышечной ткани филе рыб и растворов, поэтому выбранные растворы могут являться взаимозаменяемыми. Также рН сред для биотрансформации в конце процесса коррелировал с данными, полученными при математическом моделировании, статистическая ошибка минимальна.
В процессе биотрансформации происходит уменьшение ВСС в образцах мышечной ткани филе рыб (в среднем – в растворе глюкозы: минтай на 15,32 %, треска – 11,34 %; макрурус – 17,58 %; бычок – 12,79 %; в восстановленной молочной сыворотке: минтай на 15,47 %; треска – 12,35 %; макрурус – 16,89 %; бычок – 13,29 %). Данную закономерность можно объяснить смещением рН в кислую сторону, а также деструктивными изменениями мышечной ткани, вследствие чего для дальнейшего применения обработанного филе в технологиях производства формованных и структурированных продуктов необходимо использовать специальные технологические приемы и структурообразующие агенты [3].
После процесса биотрансформации было определено количество остаточных живых клеток БЗК в обработанных образцах мышечной ткани филе рыб для подтверждения их наличия (табл. 2).
Таблица 2
Table 2
Количество БЗК в образцах мышечной ткани филе рыб после биотрансформации, КОЕ/г
The amount of BSC in muscle tissue samples of fish fillets after biotransformation, CFU/g
|
Образцы |
L. casei |
L. acidophilus А630 |
L. bulgaricus (Пб) |
St. |
P. freudenreichii |
B. bifidum 83 |
|
Раствор глюкозы 3,5 % |
||||||
|
Минтай |
2 · 1010 |
2 · 1010 |
1 · 1010 |
2 · 1010 |
3 · 1010 |
2 · 1010 |
|
Треска |
2 · 1010 |
2 · 1010 |
3 · 1010 |
|||
|
Макрурус |
3 · 1010 |
3 · 1010 |
2 · 1010 |
|||
|
Бычок |
2 · 1010 |
2 · 1010 |
3 · 1010 |
|||
|
Восстановленная молочная сыворотка |
||||||
|
Минтай |
2 · 1010 |
3 · 1010 |
2 · 1010 |
2 · 1010 |
2 · 1010 |
2 · 1010 |
|
Треска |
2 · 1010 |
1 · 1010 |
3 · 1010 |
|||
|
Макрурус |
2 · 1010 |
1 · 1010 |
2 · 1010 |
3 · 1010 |
||
|
Бычок |
3 · 1010 |
1 · 1010 |
2 · 1010 |
2 · 1010 |
||
Количество клеток БЗК в исследуемых образцах мышечной ткани филе рыб превышает 107–109 КОЕ/г [16–19], что обосновывает возможность применения в рецептурных составах пробиотических пищевых продуктов на рыбной основе.
Для определения возможности использования полученного сырья для продуктов питания, подвергаемых термической обработке, были проведены исследования по способности БЗК, находящихся в мышечной ткани филе рыб, выдерживать определенные температурные режимы (табл. 3).
Таблица 3
Table 3
Выживаемость БЗК в мышечной ткани рыбы после биотрансформации под действием температуры, КОЕ/г
Survival of BSC in fish muscle tissue after biotransformation under the influence of temperature, CFU/g
|
Температура, °C |
Продолжительность температурного |
L. casei LC 4P1 |
L. acidophilus А630 |
L. bulgaricus (Пб) |
St. thermophilus ST 440 |
P. freudenreichii |
B. bifidum 83 |
|
50 |
15 |
1 · 10 10 |
|||||
|
30 |
|||||||
|
45 |
|||||||
|
60 |
|||||||
|
60 |
15 |
||||||
|
30 |
|||||||
|
45 |
1 · 10 9 |
||||||
|
60 |
1 · 10 8 |
||||||
|
70 |
15 |
1 · 10 5 |
– |
– |
1 · 10 4 |
– |
– |
|
30 |
1 · 10 4 |
1 · 10 3 |
|||||
|
45 |
1 · 10 3 |
||||||
|
60 |
|||||||
Не выявлено влияния вида мышечной ткани филе рыб на выживаемость БЗК, в соответствии с этим показана обобщенная, для всех образцов, тенденция к изменению изучаемого показателя.
Согласно полученным данным по выживаемости БЗК под воздействием различных термических режимов обработки в течение 15, 30, 45 и 60 мин было определено, что L. casei LC 4P1 и St. thermophilus ST 440 способны оставаться жизнеспособными в количестве 30 % при температуре 70 °С в течение 60 мин. Все остальные культуры БЗК выживают при температуре 60 °С в количестве 80 % от изначального значения. Таким образом, оптимальным режимом термической обработки полученного биотрансформированного рыбного сырья является воздействие температуры от 60 до 70 °С в течение 60 мин, что необходимо учитывать при разработке пищевого продукта на его основе и подразумевает использование щадящих режимов термического воздействия, например технология «Су-Вид» [20].
Следует отметить, что количество L. casei LC 4P1 и St. thermophilus ST 440 при температуре 70 °С в течение продолжительности обработки 15, 30, 45, 60 мин составляет меньше 106–109 КОЕ/г, а остальные культуры БЗК погибают, что не соответствует требованиям, предъявляемым к пробиотическим продуктам питания [16, 17], в связи с этим необходимо включать в рецептурный состав продукта простые углеводы и пищевые протекторы, чтобы защитить БЗК и активировать их рост [21], а также созревание (выдержку), продолжительность которого зависит от стационарной фазы роста [13]. В случае гибели клеток бактерий пробиотический эффект будут оказывать постбиотики, определение которым дала Международная научная ассоциация пробиотиков и пребиотиков (ISAPP) в 2021 г. и определила постбиотик как «препарат из неживых микроорганизмов и/или их компонентов, который приносит пользу для здоровья хозяина» [22].
Также в качестве защитного механизма возможно использовать сублимацию, которая активно используется для получения сухих форм БЗК и позволяет сохранить их жизнеспособность за счет анабиоза и последующего их активирования оптимальными условиями, в частности температурой и воздействием внутренней среды желудочно-кишечного тракта человека [1, 3, 13].
В последующих исследованиях определялась устойчивость клеток БЗК к выживанию в течение 7 суток при температуре 0–4 °С в образцах мышечной ткани филе рыб после биотрансформации для обоснования динамики их скорости отмирания (табл. 4).
Таблица 4
Table 4
Динамика изменения численности БЗК при хранении образцов мышечной ткани филе рыб
после биотрансформации, КОЕ/г
Dynamics of changes in the number of BSCs during storage of fish fillet muscle tissue samples
after biotransformation, CFU/g
|
Образцы мышечной ткани филе рыб |
L. casei LC 4P1 |
L. acidophilus А630 |
L. bulgaricus (Пб) |
St. thermophilus ST 440 |
P. freudenreichii KM-186 |
B. bifidum 83 |
||||||
|
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
|
|
Раствор глюкозы 3,5% |
||||||||||||
|
Минтай |
2 · 1010 |
2 · 107 |
2 · 1010 |
2 · 107 |
1 · 1010 |
2 · 107 |
2 · 1010 |
1 · 108 |
3 · 1010 |
3 · 107 |
2 · 1010 |
3 · 107 |
|
Треска |
1 · 108 |
2 · 1010 |
1 · 108 |
3 · 107 |
2 · 1010 |
1 · 108 |
3 · 1010 |
2 · 107 |
||||
|
Макрурус |
3 · 1010 |
2 · 107 |
3 · 1010 |
1 · 108 |
3 · 107 |
1 · 108 |
3 · 107 |
2 · 1010 |
||||
|
Бычок |
2 · 1010 |
3 · 107 |
2 · 1010 |
2 · 107 |
3 · 1010 |
3 · 107 |
1 · 108 |
1 · 108 |
||||
|
Восстановленная молочная сыворотка |
||||||||||||
|
Минтай |
2 · 1010 |
2 · 107 |
3 · 1010 |
2 · 108 |
2 · 1010 |
1 · 108 |
2 · 1010 |
2 · 108 |
2 · 010 |
3 · 107 |
2 · 1010 |
2 · 107 |
|
Треска |
2 · 108 |
2 · 1010 |
1 · 1010 |
3 · 107 |
3 · 1010 |
4 · 107 |
2 · 108 |
|||||
|
Макрурус |
3 · 107 |
2 · 1010 |
2 · 108 |
1 · 1010 |
1 · 108 |
2 · 010 |
2 · 108 |
3 · 1010 |
4 · 107 |
|||
|
Бычок |
3 · 1010 |
4 · 107 |
1 · 1010 |
2 · 108 |
1 · 108 |
2 · 1010 |
3 · 107 |
2 · 1010 |
2 · 107 |
|||
Анализируя данные табл. 4, можно предположить, что количество клеток БЗК в среднем уменьшается на 102–103 КОЕ/г, что связано с началом их фазы отмирания и температурой хранения. Исходя из этого можно аппроксимировать количественное содержание бактерий на 14 и 28 сутки хранения, что будет равняться 104 и 101 КОЕ/г соответственно. Наиболее устойчивыми культурами БЗК в процессе хранения обработанных образцов являются L. acidophilus А630 и St. thermophilus ST 440. Полученные данные по выживаемости БЗК в процессе хранения мышечной ткани филе рыб также подтверждают необходимость дополнительного внесения углеводов и протекторных пищевых веществ
в рецептурный состав продуктов для поддержания их количества на уровне 106–107 КОЕ/г в течение всего срока годности [16, 17].
При исследовании микробиологической безопасности было отмечено, что по прошествии 7 суток хранения при 0–4 °С в контрольных образцах необработанной мышечной ткани филе рыб наблюдалось превышение показателя КМАФАнМ [3, 12] по сравнению с обработанными образцами мышечной ткани (табл. 5).
Таблица 5
Table 5
Динамика изменения КМАФАнМ после биотрансформации и в процессе хранения, КОЕ/г
Dynamics of changes in CMAFAnM after biotransformation and during storage, CFU/g
|
Образцы мышечной ткани |
Контроль |
L. casei LC 4P1 |
L. acidophilus |
L. bulgaricus |
St. thermophilus ST 440 |
P. freudenreichii |
B. bifidum 83 |
||||||||||
|
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
0 сут |
7 сут |
||||
|
Раствор глюкозы 3,5 % |
|||||||||||||||||
|
Минтай |
2 · 103 |
1 · 106 |
1,2 · 101 |
1,3 · 102 |
1,2 · 101 |
1,4 · 102 |
1,3 · 101 |
1,2 · 102 |
1,4 · 101 |
1 · 102 |
1,3 · 101 |
1,3 · 102 |
1,1 · 101 |
1,6 · 102 |
|||
|
Треска |
5 · 102 |
7 · 105 |
1,2 · 101 |
5,1 · 102 |
1,2 · 101 |
2 · 102 |
2 · 101 |
2,1 · 102 |
1,3 · 101 |
2,3 · 102 |
5 · 101 |
4,3 · 102 |
2,3 · 101 |
2,1 · 102 |
|||
|
Макрурус |
3 · 102 |
2 · 106 |
1,3 · 101 |
4,2 · 102 |
1,5 · 101 |
1 · 102 |
1,4 · 101 |
3 · 102 |
4 · 101 |
1,8 · 102 |
3,1 · 101 |
3,2 · 102 |
4,2 · 101 |
1,6 · 102 |
|||
|
Бычок |
2 · 103 |
2 · 106 |
1,1 · 101 |
3 · 102 |
2 · 101 |
1 · 102 |
1,1 · 101 |
2,2 · 102 |
6 · 101 |
3,1 · 102 |
4,2 · 101 |
4,1 · 102 |
5,1 · 101 |
1,8 · 102 |
|||
|
Восстановленная молочная сыворотка |
|||||||||||||||||
|
Минтай |
2 · 103 |
1 · 106 |
1,2 · 101 |
2 · 102 |
3,3 · 101 |
1,2 · 102 |
2 · 101 |
1 · 102 |
2 · 101 |
2 · 102 |
2,7 · 101 |
1,3 · 102 |
2,1 · 101 |
6,2 · 102 |
|||
|
Треска |
5 · 102 |
7 · 105 |
2,1 · 101 |
2,2 · 102 |
2 · 101 |
1 · 102 |
3,1 · 101 |
2,3 · 102 |
2 · 101 |
3,2 · 102 |
3,5 · 101 |
2,4 · 102 |
3,6 · 101 |
2,9 · 102 |
|||
|
Макрурус |
3 · 102 |
2 · 106 |
3,2 · 101 |
1,2 · 102 |
1,2 · 101 |
1 · 102 |
4,1 · 101 |
1,2 · 102 |
1,2 · 101 |
1,6 · 102 |
4,1 · 101 |
1,2 · 102 |
3,4 · 101 |
4,4 · 102 |
|||
|
Бычок |
2 · 103 |
2 · 106 |
1,8 · 101 |
2,4 · 102 |
1 · 101 |
3,2 · 102 |
2,6 · 101 |
3,1 · 102 |
2,3 · 101 |
3 · 102 |
2,7 · 101 |
2,5 · 102 |
2,2 · 101 |
5,2 · 102 |
|||
В образцах мышечной ткани филе рыб после биотрансформации БЗК, во время модельного хранения, среднее значение КМАФАнМ составляло 2 · 102 КОЕ/г, что находится в пределах допустимого уровня (не более 1 · 105 КОЕ/г) [18, 23]. При этом следует отметить, что средний минимальный рост КМАФАнМ установлен при обработке филе рыб раствором глюкозы и восстановленной молочной сывороткой, содержащих L. acidophilus А630. Максимальный средний рост КМАФАнМ зафиксирован при обработке филе рыб молочной сывороткой, содержащей B. bifidum 83.
Данные микробиологических исследований подтверждают эффект биоконсервирования в обработанных образцах рыбного филе. Культуры БЗК за счет своего развития и продуцирования активных метаболитов (молочной, уксусной и пропионовой кислот и бактериоцинов) оказывают угнетающее действие на общую обсемененность и, соответственно, на нежелательную микрофлору, развивающуюся в рыбном сырье в процессе модельного хранения.
Заключение
Для обработки рыбного сырья отобраны БЗК St. thermophilus ST 440 и L. acidophilus А630, которые оказывают положительное влияние на органолептические показатели обработанного рыбного филе, более активно замедляют рост КМАФАнМ, являются более устойчивыми культурами при хранении, в частности St. thermophilus ST 440 способен выдерживать более высокие температуры воздействия, чем другие культуры. Следует отметить, что P. freudenreichii KM-186, B. bifidum 83 и L. bulgaricus (Пб) также имеют положительные характеристики, но отрицательно влияют на ароматические характеристики мышечной ткани филе рыб.
Верифицированы оптимальные условия и параметры биотрансформации мышечной ткани филе рыб:
– доза внесения БЗК в количестве 4,5 · 1010 КОЕ/г с продолжительностью обработки в течение 5 ч, что подтверждают данные, полученные при математическом моделировании процесса биотрансформации;
– рН среды для биотрансформации – не более 5,3–5,9 в начале процесса и не менее 4,3–4,6 в конце процесса;
– продолжительность процесса биотрансформации – не менее 5 ч;
– температура процесса биотрансформация – 37 °С;
– соотношение «сырье : раствор» 1 : 2.
Модельные среды могут быть взаимозаменяемыми, но предпочтение отдано раствору глюкозы концентрацией 3,5 %, т. к. при его использовании
у большинства образцов ВСС имеет более высокие показатели, менее интенсивное подкисление, а выбранные БЗК в ее составе оказывают положительное влияние на органолептические показатели, в частности запах. Также необходимо отметить, что молочная сыворотка относится к отходам производства молочной продукции, вследствие этого после процесса биотрансформации отработанную среду на ее основе необходимо рационально утилизировать или восстанавливать, что подразумевает дополнительные финансовые затраты, т. к. она не рекомендована к сливу в канализационную систему [24].
Данная выборка БЗК, среды, параметров и условий позволит в дальнейшем получить образцы рыбного филе с приятным запахом, приемлемой консистенцией, необходимым количеством БЗК в филе в качестве основы для разработки пробиотических пищевых рыбных продуктов. На следующем этапе исследований будут проводиться разработки рецептурного состава продукта и, в связи с особенностями БЗК, технологических параметров термической обработки, а также изучаться защитные протекторы для сохранения их жизнедеятельности как во время технологического процесса, так и в процессе хранения
1. Стратегия повышения качества пищевой продукции в Российской Федерации до 2030 года: Распоряжение Правительства России от 29 июня 2016 г. № 1364-р. URL: https://www.garant.ru/products/ipo/prime/doc/71335844/ (дата обращения: 12.01.2023).
2. Валышев А. В., Валышева Н. А. Комбинация антибиотиков и бактериоцинов - эффективный способ борьбы с резистентными микроорганизмами // Бюл. Оренбург. науч. центра УрО РАН. 2016. № 4. С. 2.
3. Нестеренко А. А., Акопян К. В. Биомодификация мясного сырья с целью получения функциональных продуктов // Политемат. сетевой электрон. науч. журн. Кубан. гос. аграр. ун-та. 2014. № 101. С. 1719-1728.
4. Ардатская М. Д. Пробиотики, пребиотики и метабиотики в коррекции микроэкологических нарушений кишечника // Медицин. совет. 2015. № 13. С. 94-99.
5. Лаврухина Е. В., Зарубин Н. Ю., Бредихина О. В., Гриневич А. И. Интеграция бактериальных заквасочных культур с рыбным сырьем: подбор и обоснование // Рыб. хоз. 2022. № 6. С. 107-114. DOI:https://doi.org/10.37663/0131-6184-2022-6-107-114.
6. Ким Г. Н., Ким И. Н., Сафронова Т. М., Мегеда Е. В. Сенсорный анализ продуктов из рыбы и беспозвоночных. СПб.: Лань, 2014. 512 с.
7. ГОСТ 34134-2017. Мясо и мясные продукты. Метод определения состава свободных углеводов. М.: Стандартинформ, 2019. 12 с.
8. ГОСТ 7636-85. Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Методы анализа. М.: Стандартинформ, 2010. 123 с.
9. ГОСТ 3624-92. Молоко и молочные продукты. Титриметрические методы определения кислотности. М.: Стандартинформ, 2009. 8 с.
10. МУК 4.2.2884-11. Методы микробиологического контроля объектов окружающей среды и пищевых продуктов с использованием петрифильмов. М.: Федеральный центр госсанэпиднадзора Минздрава России, 2011. 24 с.
11. Зарубин Н. Ю., Лаврухина Е. В., Бредихина О. В.,Гриневич А. И. Прогнозирование параметров биотрансформации рыбного сырья бактериальными заквасочными культурами с применением математических моделей // Пищ. пром-сть. 2023. № 3. С. 92-96. DOI:https://doi.org/10.52653/PPI.2023.3.3.019.
12. Стась Н. Ф., Свинцова Л. Д. Химия растворов. Томск: Изд-во ТПУ, 2006. 155 с.
13. Рябцева С. А., Панова Н. М. Микробиология молока и молочных продуктов: учеб. пособие. Ставрополь: Изд-во Северо-Кавказ. федер. ун-та, 2017. 220 с.
14. Лаврухина Е. В., Зарубин Н. Ю., Харенко Е. Н., Бредихина О. В., Архипов Л. О. Полуконсервы рыбной паштетной группы с иммуномодулирующими компонентами // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2022. № 2. С. 106-114. DOI:https://doi.org/10.24143/2073-5529-2022-2-106-114.
15. Ким И. Н., Кращенко В. В. Микробиология переработки водных биологических ресурсов: учеб. пособие для вузов. М.: Моркнига, 2015. 349 с.
16. ГОСТ Р 52349-2005. Продукты пищевые. Продукты пищевые функциональные. Термины и определения. М.: Стандартинформ, 2008. 12 с.
17. ГОСТ Р 55577-2013. Продукты пищевые функциональные. Информация об отличительных признаках и эффективности. М.: Стандартинформ, 2014. 17 с.
18. СанПиН 2.3.2.1078-01. Продовольственное сырье и пищевые продукты. Гигиенические требования безопасности и пищевой ценности пищевых продуктов. М.: Рид Групп, 2012. 448 c.
19. О безопасности рыбы и рыбной продукции: технический регламент Евразийского экономического союза ТР ЕАЭС 040/2016 от 18 октября 2016 г. № 162. URL: https://docs.cntd.ru/document/420394425 (дата обращения: 12.01.2023).
20. Фофанова Т. С. Технология су-вид - некоторые аспекты качества и микробиологической безопасности // Теория и практика переработки мяса. 2018. № 1. С. 59-68.
21. Кригер О. В., Носкова С. Ю. Разработка приемов длительного сохранения свойств молочнокислых микроорганизмов // Техника и технология пищевых производств. 2018. № 4. С. 30-38.
22. Vinderola G., Sanders M. E., Salminen S. The Concept of Postbiotics // Foods. 2022. V. 11 (8). P. 1077. URL: https://doi.org/10.3390/foods1108107 7 (дата обращения: 09.01.2023.).
23. О безопасности пищевой продукции: технический регламент Таможенного союза ТР ТС 021/2011-2011 от 09 декабря 2011 г. № 880. URL: https://docs.cntd.ru/document/902320560 (дата обращения: 09.01.2023).
24. Бережная Е. А. Современное состояние и перспективы переработки молочной сыворотки // Вестн. науки. 2021. № 1 (34). Т. 3. С. 131-135.