Россия
В настоящее время весьма актуален поиск решений, направленных на повышение качества кормов для рыб, особенно для осетровых. Активно ведется поиск альтернативных источников кормового протеина и способов повышения переваримости и усвояемости использующихся традиционных ингредиентов комбикормов. Одним из таких альтернативных источников протеина является использование личинок мухи черная львинка (Hermetia illucens). Проведена оценка использования сухой биомассы личинок мухи черная львинка по показателям крови особей стерляди – количеству общего сывороточного белка, соотношению белковых фракций и белковому коэффициенту. В качестве объектов исследования использовали годовиков стерляди (Acipenser ruthenus), содержащихся в условиях аквакультуры: 40 рыб средней массой 145 ± 15,7 г были индивидуально взвешены с точностью до 0,1 г и помещены на выращивание в стеклопластиковые бассейны размером 1,1 × 1,1 м в 2 группах (контроль и опыт). Кормление рыб осуществляли по поедаемости в дневное время с интервалом в 4 ч. В течение всего периода исследований (30 сут) проверялись параметры качества воды, включая дневные температурные показатели с минимумом 24 °C и максимумом 27 °C (средняя температура составила 26 ± 0,97 °C). Другие измерения варьировались следующим образом: концентрация кислорода 7,9–9,4 мг/л, насыщение 81–99 %. В результате исследования был получен положительный опыт. Уровень общего сывороточного белка, его фракционный состав у стерляди из опытной группы был близок к норме, характерной для осетровых, тогда как у рыб из контрольной группы наблюдали повышенный уровень γ-глобулинов и снижение белкового коэффициента, что может свидетельствовать о напряжении защитно-приспособительных сил организма, в отличие от рыб из опытной группы, где доля этой фракции была в пределах нормы.
стерлядь, черная львинка, сывороточный белок, белковые фракции, альбумины, глобулины
Введение
Аквакультура осетровых начинала развиваться как способ удовлетворения растущего спроса населения на икру и мясо, а также для уменьшения нагрузки на чрезмерно эксплуатируемые дикие ресурсы. С 1997 г. все виды осетровых были добавлены в приложения СИТЕС (Конвенция о международной торговле видами, находящимися под угрозой исчезновения) для защиты популяций от вымирания [1]. Это определило окончательный переход от диких осетровых к выращиваемым на фермах для производства товарной продукции во многих странах.
Одним из краеугольных камней обеспечения рыб подходящей средой для роста при сохранении их в хорошем состоянии с высокими показателями выживаемости является обеспечение надлежащего качества корма. Надлежащее качество корма гарантирует не только высокие темпы роста, но и более высокую выживаемость рыбы [2].
Помимо того, что в аквакультуре корма должны полностью удовлетворять физиологическим потребностям выращиваемых рыб, не менее важна и экономическая выгода, т. к. затраты на кормление рыб в рыбоводстве весьма масштабны. Считается, что рыбная мука больше не способна поддерживать развитие индустрии аквакультуры в ближайшие годы. В связи с этим становится актуальным поиск альтернативных источников белка для устойчивого производства комбикормовой промышленности. Источники белка животного происхождения, такие как мука из насекомых, могут использоваться в качестве альтернативных источников рыбной муки в кормах для объектов аквакультуры. В последние годы резко возрос интерес к изучению муки из насекомых в рыбоводстве как возможной альтернативы корму.
Мука из насекомых – хороший источник белка, минералов и витаминов, аналогичный белку рыбной муки. Она также богата незаменимыми аминокислотами, особенно лизином, метионином и лейцином. Среди насекомых личинки мухи черной львинки особенно перспективны из-за их способности превращать пищевые отходы в белок высшего сорта [3]. Мука из личинки содержит около 30–58 % белка, 10–30 % липидов, незаменимые аминокислоты, макро- и микроэлементы, а также ценные витамины.
Соотношение фракций белков в сыворотке крови рыб является индикатором оценки физиолого-биохимического состояния рыб. Изменение состава и соотношения компонентов сыворотки крови приводит к нарушению гомеостаза, снижению иммунного ответа организма на воздействие внешней среды, болезням и является наиболее ранним ответом функциональных систем на неблагоприятные условия среды содержания рыб [4]. Таким образом, целью данной работы явилась оценка частичной замены рыбной муки на сухую биомассу личинок мухи черной львинки по белковым показателям крови особей стерляди – количеству общего сывороточного белка, соотношению белковых фракций и белковому коэффициенту.
Материалы и методы
В качестве объектов исследования использовали годовиков стерляди (Acipenser ruthenus), содержащихся в условиях аквакультуры. 40 рыб (большая выборка n > 30, согласно Г. Ф. Лакину [5]) средней массой 145 ± 15,7 г были индивидуально взвешены с точностью до 0,1 г и помещены на выращивание в стеклопластиковые бассейны размером 1,1 × 1,1 м в 2 группах (контроль и опыт). Контрольный и опытный рационы готовили методом влажного прессования [6]. Кормосмесь при производстве кормовых гранул перемешивали и добавляли в нее воду для получения крутого теста. Затем для формирования гранул (2 мм) кормосмесь пропускали через пресс-гранулятор. Полученные влажные гранулы собирали и обезвоживали в сушильном шкафу с горячим воздухом при температуре 50 °C до достижения трехпроцентного содержания влаги, затем помещали в пластиковые пакеты и хранили при температуре 4 °C.
Опытный корм готовили с добавкой сухой биомассы личинок мухи черной львинки. Для этого в корме произвели замену рыбной муки в количестве 30 % на биомассу из личинок мухи черной львинки. При выборе процентного соотношения замены рыбной муки полагались на ранее полученные данные об использовании личинок мухи черной львинки
в аквакормах для устойчивой аквакультуры [7].
В состав контрольного и опытного рационов входили следующие компоненты: рыбная мука, мясная и мясокостная мука, соевый шрот, пшеничная мука, витазар, килечный жир, кормовые аминокислоты, минерально-витаминный премикс, пробиотическая добавка. Соотношение протеин/жир в готовых кормах составляло 45 / 15. Корма были сбалансированы по аминокислотному и витаминно-минеральному составу. Кормление рыб осуществляли по поедаемости в дневное время с интервалом в 4 ч. Содержание основных питательных веществ контрольного и опытного рационов представлены
в табл. 1.
Таблица 1
Table 1
Химический состав контрольного и опытного рационов для годовиков стерляди
Chemical composition of control and experimental rations for sterlet yearlings
|
Корм |
Содержание, % |
Валовая энергия, МДж/кг |
||||
|
сырой протеин |
сырой жир |
клетчатка |
влага |
зола |
||
|
Контроль |
45 |
15 |
3,0 |
9 |
10,8 |
19 |
|
Опыт |
15,5 |
11 |
19,1 |
|||
В течение всего периода исследований (30 сут) проверялись параметры качества воды, включая дневные температурные показатели с минимумом 24 °C и максимумом 27 °C (средняя температура составила 26 ± 0,97 °C). Другие измерения варьировались следующим образом: концентрация кислорода 7,9–9,4 мг/л, насыщение 81–99 %.
В конце эксперимента, исходя из биометрических измерений, были определены основные показатели роста: абсолютный и среднесуточный прирост массы, коэффициент массонакопления, среднесуточная и удельная скорость роста. Рыбоводно-биологические показатели вычислялись в контрольной и опытной экспериментальных группах по следующим формулам [8–11]:
Абсолютный прирост массы = Wf – Ws;
Среднесуточный прирост массы = 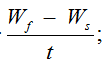
Среднесуточная скорость роста = 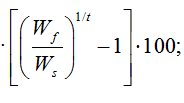
Удельная скорость роста = 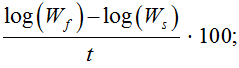
Коэффициент массонакопления = 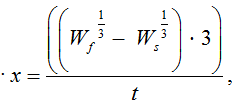
где Ws и Wf – масса рыбы в начале и в конце эксперимента; t – продолжительность опыта, сут.
У выращенных особей стерляди прижизненным методом отбирались образцы крови. Далее кровь центрифугировали при 1 000 об/мин в течение 10 мин для получения сыворотки крови. В крови определяли количество общего сывороточного белка (ОСБ) биуретовым методом, процентное соотношение белковых фракций методом осаждения нейтральными солями и белковый коэффициент (соотношение количества альбуминов к количеству глобулинов) расчетным методом [12, 13].
Экспериментальную часть работ проводили в двойной повторности. Все числовые данные подвергались статистической обработке и представлены в виде среднего и стандартной ошибки среднего, достоверность различий рассчитывали с помощью t-критерия Стьюдента при нормальном распределении данных или с помощью критерия Манна – Уитни при ненормальном (Excel, Microsoft Office 2019, SigmaStat 3.5.).
Результаты и обсуждение
Рыбоводно-биологические и гематологические показатели являются адекватным показателем качества и сбалансированности потребляемого корма. Оценка эффективности частичной замены рыбной муки на муку из личинок мухи черной львинки показала, что лучшие показатели роста были отмечены в опытной группе рыб, где абсолютный прирост, среднесуточный прирост, среднесуточная скорость роста и коэффициент накопления массы были выше, чем в контроле (табл. 2, рис.).
Таблица 2
Table 2
Рыбоводно-биологические показатели годовиков стерляди, выращенной на контрольном и опытном
(частичная замена рыбной муки на муку из личинок мухи черной львинки) рационах
Fish-breeding and biological indicators of sterlet yearlings grown on the control and experimental
(partial replacement of fishmeal with flour from the larvae of black lion flies) rations
|
Показатель |
Вариант эксперимента |
|
|
Контроль |
Опыт |
|
|
Масса начальная, г |
145 ± 15,7 |
|
|
Масса конечная, г |
166,8 ± 24,1 |
169,3 ± 28,9 |
|
Длина абсолютная начальная, мм |
29,6 ± 1,8 |
|
|
Длина абсолютная конечная, мм |
34,6 ± 2,3 |
35,1 ± 3,4 |
|
Абсолютный прирост, г |
21,8 |
24,3 |
|
Среднесуточный прирост, г |
0,73 |
0,81 |
|
Среднесуточная скорость роста, % |
0,46 |
0,51 |
|
Удельная скорость роста, % |
0,20 |
0,23 |
|
Коэффициент массонакопления, ед. |
0,0072 |
0,008 |
|
Выживаемость, % |
100 |
|
|
Продолжительность опыта, сут |
30 |
|
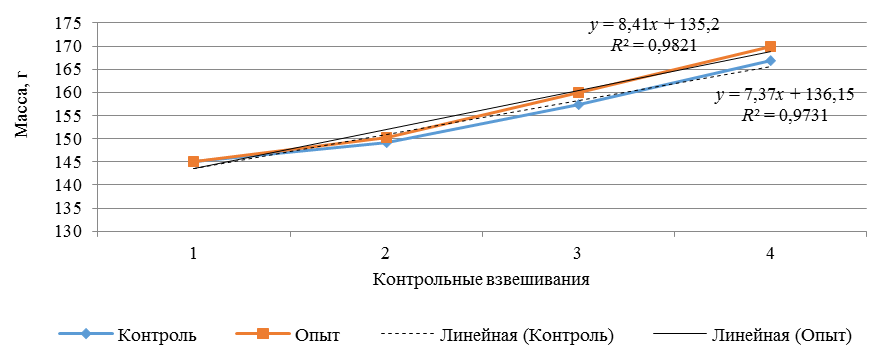
Прирост массы годовиков стерляди на контрольном и опытном рационах
Weight gain of sterlet yearlings on control and experimental diets
Однако данные не являются достоверными, что говорит об эффективности и контрольного, и опытного вариантов корма. Выживаемость стерляди в обоих вариантах составила 100 %. Поскольку эффективность переработки корма прямо пропорциональна интенсивности кормления, можно сказать, что среднесуточная скорость роста в 0,51 % массы тела
в день в опытном варианте не является верхним пределом для удовлетворения потребностей годовиков стерляди, которые, скорее всего, способны эффективно использовать дополнительные объемы корма с проверенным уровнем белка.
Коэффициент достоверности аппроксимации, показывающий степень соответствия трендовой модели исходным данным в контрольном и опытном вариантах, приближался к значению 1 (см. рис.), это говорит о том, что модель точнее описывает имеющиеся данные.
Сведения, характеризующие белковый обмен в крови стерляди, полученные в процессе экспериментального кормления, представлены в табл. 3.
Таблица 3
Table 3
Соотношение белковых фракций сывороточного белка крови стерляди
The ratio of protein fractions of sterlet blood serum protein
|
Показатель |
Начало |
Конец эксперимента |
|
|
Опыт |
Контроль |
||
|
ОСБ, г/л |
20,70 ± 1,02А-Б* |
24,55 ± 2,57А-Б |
22,05 ± 1,31 |
|
Альбумины, % |
39,60 ± 7,32А-Б |
46,72 ± 7,79А-Б, Б-В |
42,43 ± 9,30Б-В |
|
α-глобулины, % |
34,98 ± 6,79 |
24,96 ± 5,66 |
20,47 ± 6,36 |
|
β-глобулины, % |
7,74 ± 2,05 |
17,17 ± 0,89 |
17,06 ± 5,11 |
|
γ-глобулины, % |
17,68 ± 4,73 |
11,16 ± 0,74Б-В |
20,04 ± 3,87Б-В |
|
Белковый коэффициент, усл. ед. |
0,90 ± 0,26 |
0,94 ± 0,19Б-В |
0,88 ± 0,31Б-В |
* Достоверно статистически значимые различия между: начало эксперимента – А; конец эксперимента, опыт – Б; конец эксперимента, контроль – В (р < 0,05).
Сывороточный белок в крови рыб представляет собой суммарную концентрацию альбуминов и глобулинов. Белки крови выполняют в организме множество важнейших функций: свертывание крови, поддержание постоянства рН крови, осуществление транспорта веществ (перенос жиров, билирубина, стероидных гормонов в ткани и органы), участвуют в иммунных реакциях и т. п. [14]. Уровень ОСБ в крови стерляди в процессе экспериментального кормления увеличился, особенно в опытной группе (достоверно) и соответствовал референсным значениям (см. табл. 3) [15]. Повышение концентрации белка в крови рыб свидетельствует о достаточной питательности корма и способствует увеличению прироста в результате наращивания мышечной массы, а следовательно, и более быстрому росту осетровых рыб [16]. Также высокая концентрация ОСБ является показателем оптимизации обменных процессов и высокой неспецифической резистентности организма осетровых рыб [17].
Фракционный состав белков сыворотки крови осетровых рыб высокогетерогенный и содержит от 15 до 21 компонента, которые представлены альбуминами (преальбуминами), α-, α2, β-, γ-глобулинами [18]. В норме, например, у русского осетра доля альбуминов составляет 32 %, α-глобулинов – 28 %, β-глобулинов – 25,5 %, γ-глобулинов – 14,5 % [19].
Как в начале, так и в конце эксперимента наибольшая доля в сывороточном белке стерляди приходилась именно на альбумины, причем достоверно эта доля увеличивалась в опытной группе и стала у них наибольшей в конце периода наблюдения (см. табл. 3). Альбумины отражают субстратную обеспеченность анаболических процессов организма рыбы и напряженность пластического обмена. Показатель доли альбуминов является одним из оценочных критериев адаптационных возможностей и жизнестойкости организма. Они осуществляют транспортную функцию, участвуют в поддержании коллоидно-осмотического давления плазменных белков, что играет ведущую роль в перераспределении воды и солей тканями, влияющими на вязкость крови [15]. Доля альбуминов у осетровых может составлять при средних 25 до 55 % и всегда наибольшая среди других фракций белков [14, 20].
На фоне увеличения доли альбуминов как в опытной, так и в контрольной группе снизилось количество α-глобулинов, в норме вторых по размеру доли сывороточных белков у русского осетра. Альфа-глобулины – это гликопротеиды, т. е. белки, связанные с углеводами. У животных опасным сигналом считается повышение их доли [21]. Уровень β-глобулинов в процессе экспериментального кормления с патологичного минимального увеличился и стал почти таковым как в норме, например у русского осетра, третьим по количеству в опытной группе, тогда как в контрольной он по-прежнему был минимальным (см. табл. 3). Бета-глобулины – это липопротеины. В их состав входят фосфолипиды и холестерин. К этой белковой фракции относится белок трансферрин, обеспечивающий транспорт железа [22]. Количество γ-глобулинов в опытной группе снизилось, а в контрольной увеличилось и стало достоверно выше в 2 раза, чем в крови рыб, получавших корм с добавкой биомассы черной львинки (см. табл. 3). Для γ-глобулиновой фракции характерна наименьшая концентрация, например
у русского осетра в норме, по литературным данным, 5,4–14,5 % [16, 19]. Эта фракция белков состоит из иммуноглобулинов, функционально представляющих собой антитела, которые обеспечивают иммунную защиту организма от инфекций и чужеродных веществ. Повышение уровня γ-глобулинов свидетельствует о напряжении защитно-приспособи-
тельных сил организма [22]. Белковый коэффициент на протяжении всего эксперимента у особей стерляди был в норме, но минимальный уровень был отмечен для контрольной группы. Снижение этого коэффициента может быть связано с ухудшением питания, патологиями работы печени, снижением иммунитета и пр.
Таким образом, эксперимент по использованию добавки в корм для осетровых рыб биомассы личинок мухи черная львинка показал ее положительное влияние на белковый обмен их организма. Количество сывороточного белка, как и доля фракции альбумина в крови у рыб из опытной группы, выросли и были выше, чем у рыб из контрольной, что свидетельствует о полноценном использовании белковой составляющей испытуемого корма. Фракционный состав сывороточного белка у стерляди из опытной группы был близок к норме, характерной для осетровых, тогда как у рыб из контрольной группы наблюдали повышенный уровень γ-глобулинов и снижение белкового коэффициента, что может свидетельствовать о напряжении иммунитета организма, в отличие от рыб из опытной группы, где доля этой фракции была в пределах нормы.
Заключение
Основная цель текущего эксперимента заключалась в установлении эффективности использования в кормах для годовиков стерляди сухой биомассы из личинок мухи черной львинки в качестве альтернативного источника белка. Полученные экспериментальные данные имеют особую практическую ценность, поскольку позволяют рекомендовать частичную замену рыбной муки (30 %)
в кормах для стерляди с целью повышения иммунного статуса выращиваемых рыб. В результате проведенных исследований был получен положительный опыт. Уровень общего сывороточного белка, его фракционный состав у стерляди из опытной группы был близок к норме, характерной для осетровых, тогда как у рыб из контрольной группы наблюдали повышенный уровень γ-гло-
булинов и снижение белкового коэффициента, что может свидетельствовать о напряжении защитно-приспособительных сил организма, в отличие от рыб из опытной группы, где доля этой фракции была в пределах нормы.
1. Boscari E., Vitulo N., Ludwig A., Caruso C., Mugue N. S., Suciu R., Onara D. F., Papetti C., Marino I. A. M., Zane L. Fast genetic identification of the Beluga sturgeon and its sought-after caviar to stem illegal trade // Food Control. 2017. V. 75. P. 145–152.
2. Kolman R. Sturgeon. Rearing and cultivation. A guide book for fish farmers, 2nd edn. Wyd. IRS, 2010. 134 p.
3. Basto A., Matos E., Valente L. M. Nutritional value of different insect larvae meals as protein sources for European sea bass (Dicentrarchus labrax) juveniles // Aquaculture. 2020. V. 521 (1–2). P. 735085. DOI:https://doi.org/10.1016/j.aquaculture.2020. 735085.
4. Королева А. В., Залевская И. Н. Сравнительный анализ электрофоретического состава белков печени и мышечной ткани морского ерша, обитающего в бухтах с различным антропогенным воздействием // Экосисте-мы, их оптимизация и охрана. 2010. Т. 3. С. 110–118.
5. Лакин Г. Ф. Биометрия. М.: Высш. шк., 1990. 293 с.
6. Пономарев С. В., Гамыгин Е. А., Никоноров С. И., Пономарева Е. Н., Грозеску Ю. Н., Бахарева А. А. Технологии выращивания и кормления объектов аквакультуры юга России (справочное, учебное пособие). Астрахань: Нова плюс, 2002. 264 с.
7. Mohan K., Karthick R. D., Muralisankar T., Ganesan A., Sathishkumar P., Revathi N. Use of black soldier fly (Hermetia illucens L.) larvae meal in aquafeeds for a sustainable aquaculture industry: A review of past and future needs // Aquaculture. 2022. V. 553. P. 738095. https://doi.org/10.1016/j.aquaculture.2022.738095.
8. Castell J. D., Tiews K. Report of the EIFAC, IUNS and ICES Working Group on the standardization of the methodology in fish nutrition research (Hamburg, Federal Republic of Germany, March 21-23, 1979) // EIFAC Tech. pap. 36. 1979. P. 1–24.
9. Резников В. Ф., Баранов С. А., Стариков Е. А., Толчинский Г. И. Стандартная модель массонакопления рыбы // Механизация и автоматизация рыбоводства и рыболовства во внутренних водоемах: сб. науч. тр. ВНИИПРХ. 1978. Вып. 77. С. 12–14.
10. Купинский С. В. Продукционные возможности объектов аквакультуры. М.: ЗАО «Экон-Информ», 2010. 140 с.
11. Lugert V. A review on fish growth calculation: multiple functions in fish production and their specific application // Reviews in aquaculture. 2016. V. 8. N. 1. P. 30–42.
12. Алейникова Т. Л., Рубцова Г. В. Биохимия. Руководство к практическим занятиям по биологической химии. М.: Высш. шк., 1988. 240 с.
13. Методические указания по определению уровня естественной резистентности и оценке иммунного статуса рыб (утв. Департаментом ветеринарии Минсельхозпрода РФ от 25 ноября 1999 г. № 13-4-2/1795). URL: https://base.garant.ru/2158921/#friends (дата обращения: 18.08.2024).
14. Симон М. Ю. Основні гематологічні показники осетрових видів риб (Аcipenseridae) // Рибогосподарська наука України. 2017. № 1 (39). С. 92–117.
15. Пронина Г. И., Корягина Н. Ю. Референсные значения физиолого-иммунологических показателей гидробионтов разных видов // Вестн. Астрахан. гос. техн. ун-та. Сер. Рыбное хозяйство. 2015. № 4. С. 103–108.
16. Мухрамова A. A. Оценка состояния молоди русского осетра по рыбоводно-биологическим параметрам и биохимическим показателям крови посла кормления экспериментальными кормами // Вестн. КазНУ. Сер. экологическая. 2012. № 1 (33). С. 103–106.
17. Бахарева А. А. Научно-обоснованные методы повышения продуктивности ремонтно-маточных стад осетровых рыб за счет оптимизации технологии кормления и содержания в условиях рыбоводных хозяйств Волго-Каспийского бассейна: автореф. дис. … д-ра с.-х. наук. Усть-Кинельский, 2016. 32 с.
18. Баль Н. В., Гераскин П. П., Мишин Е. А. Фракционный состав сывороточных белков русского осетра с признаками миопатии // Осетровое хозяйство водоемов СССР: материалы Всесоюз. совещ. (Астрахань, ноябрь 1989 г.). Волгоград: Волгоградская правда, 1989. С. 16–20.
19. Базелюк Н. Н., Козлова Н. В., Макарова Е. Г., Файзулина Д. Р., Барегамян М. А. Протеинограммы сыворотки крови русского осетра (лат. Acipenser gueldenstaedtii) // Актуальные проблемы биоразнообра-зия и природопользования: материалы Всерос. науч.-практ. конф. (Керчь, 26 сентября – 01 октября 2017 г.). Керчь: Ариал, 2017. С. 20–25.
20. Лукьяненко В. И. Токсикология рыб. М.: Пищ. пром-сть, 1967. 216 с.
21. Ерохина И. А. Протеинограммы плазмы крови тюленей в связи с оценкой физиологического состояния животных // Актуальные вопросы ветеринарной биологии. 2009. № 1 (1). С. 7–13.
22. Кцоева И. И., Габолаева А. Р., Цалиев Б. З. Сравнительная характеристика белков крови рыб и их фракций // Изв. Горского гос. аграр. ун-та. 2010. Т. 47. № 1. С. 110–113.
















