Калининградская область, Россия
Россия
Россия
Россия
Россия
Россия
с 01.01.2012 по настоящее время
Россия
Россия
Россия
Россия
Россия
Проблема дефицита животного белка актуальна в кормопроизводстве для предприятий аквакультуры. Все более широкое применение находят личинки мухи черной львинки Нermetia illucens, однако из-за наличия хитина она усваивается неполностью. Целью исследования являлась оценка рациональности исполь-зования гидролизата личинки в биологических испытаниях по выращиванию молоди радужной форели. В эксперименте на основе высокотемпературного гидролиза личинки получали водорастворимую добавку в сухой форме, вводили ее в состав комбикормов взамен части рыбной муки и анализировали показатели рыб. Изучен химический состав личинки и ее гидролизата. Содержание белка в личинке и добавке составило 17,8 и 43,4 % соответственно, хитина в личинке было 7,5 %, а в гидролизате он отсутствовал. Анализ аминокислотного состава протеинов личинки, ее водорастворимой добавки и рыбной муки показал, что они близки. Биологические испытания проводили на рыбоводном предприятии ООО «ПРОМКОРМ» в течение 30 дней в УЗВ-установках на 2-х партиях форели (экспериментальная и контрольная). В контрольных опытах использовали рецептуры промышленного корма для форели. В эксперименте 10 % рыбной муки в базовой рецептуре корма заменяли на 10 % гидролизата личинки. Изучали весовые, гематологические и морфофизиологические показатели рыб. В конце эксперимента химический состав молоди обеих групп был практически идентичен. При сравнении показателей длины, массы, коэффициента упитанности по Фультону, степени ожирения, индексов печени, сердца и селезенки достоверных различий не отмечено. Показатели крови (концентрация эритроцитов, лимфоцитов, гемоглобина в крови и в эритроците, белка в сыворотке крови) были несколько лучше у экс-периментальных рыб, но различия статистически не достоверны. Водорастворимый гидролизат личинки Нermetia illucens можно считать перспективной кормовой добавкой для аквакультуры.
личинка мухи черной львинки Нermetia illucens, высокотемпературный гидролиз, аквакультура, радужная форель, комбикорма, биологические испытания
Введение
Российское кормопроизводство в индустриальной аквакультуре остро нуждается в качественных белковых добавках, необходимых для создания полноценных комбикормов, которые предназначены для хищных пород рыб (лососевых, форелевых, сиговых, осетровых) [1]. Основным источником протеина в кормах для рыб традиционно является кормовая рыбная мука, которая в настоящее время в России не производится в достаточном количестве.
Перспективным источником животного протеина считается личинка мухи черной львинки Hermetia illucens, которая отличается быстрым ростом и используется в составе различных комбикормов [2]. Проблемой применения данного сырья является наличие в экоскелете личинки хитина, плохо перевариваемого пищеварительными органами животных, птиц и рыб [3]. Специалисты ФГБУН «Федеральный исследовательский центр питания, биотехнологии и безопасности пищи» для повышения усвояемости белка Hermetia illucens рекомендуют проводить предварительную модификацию личинки тем или иным способом [4].
Рациональным способом повышения усвояемости личинки представляется ее глубокий гидролиз высокотемпературным методом по технологии Калининградского государственного технического университета (КГТУ), позволяющий уменьшать содержание хитина в водорастворимом гидролизате и переводить белки в усвояемое низкомолекулярное состояние [5]. Эксперименты по термогидролизу хитинсодержащих отходов от разделки крабов и креветок показали практическое отсутствие хитина в водорастворимой фракции гидролизатов при существенном повышении содержания белка в их сушеных формах (44 и 48 %). Полученные таким способом крабовые и креветочные протеиновые добавки были успешно использованы в составе комбикормов для молоди радужной форели, выращиваемой в индустриальной аквакультуре [6].
В России во многих регионах выращивают личинки Hermetia illucens для кормовых нужд. Анализ опубликованных материалов показывает, что данное сырье, в зависимости от питания, содержит (% на сухую массу) около 40 % протеина, более 20 % жира, 10–12 % усвояемых углеводов, 3–7 % хитина и 1–4 % минеральных веществ [7].
Имеющиеся сведения по применению различных форм личинки в питании рыб показывают, что разнообразные корма из личинки полностью рыбами не усваиваются, а причиной этого авторы считают наличие в них хитина, устойчивого к пищеварительным ферментам рыб [8].
Целью исследования являлась оценка рациональности использования водорастворимого гидролизата личинки мухи черной львинки Нermetia illucens в биологических испытаниях по выращиванию в аквакультуре молоди радужной форели путем введения его в состав комбикормов взамен части рыбной муки при анализе морфометрических и гематологических показателей.
Материалы и методы
Экспериментальные исследования проводили на кафедре пищевой биотехнологии КГТУ и в ООО «ПРОМКОРМ». Личинку получали в агрофирме ИП Лихварь Петр Вячеславович (Калининградская область).
Модификацию личинки проводили термогидролизом в водной среде по технологии КГТУ в термореакторе при 130 °С в течение 60 мин под давлением 0,20 МПа [9]. Из гидролизованной суспензии после разделения получали 2 фракции – водорастворимую (пептидно-протеиновую) и водонерастворимую (белково-минеральную), которые высушивали и измельчали. Анализ химического состава сырья и гидролизованных добавок проводили по стандартным и общепринятым методикам. Содержание влаги устанавливали по ГОСТ Р 54951-2012, сырого протеина – по ГОСТ 13496.4-2019, жира – по ГОСТ 13496.15-2016, хитина – по ГОСТ 7635-1986. Содержание аминокислот в белках личинки и протеиновой добавки оценивали по ФР.1.31.2015.19761 в научно-исследовательской лаборатории UBF. Содержание минеральных веществ определяли методом DIN EN ISO 11885-2009-09 с предварительной минерализацией сырья и идентификацией минералов методом молекулярной абсорбционной спектроскопии. Статистическую обработку результатов проводили общепринятыми методами математической статистики на 95 %-м доверительном уровне.
В эксперименте 10 % водорастворимой добавки из личинки с молекулярной массой ММ 5–10 кДа вводили вместо соответствующей части рыбной муки в состав кормов молоди радужной форели (Oncorhynchus mykiss). Корма были произведены методом экструзии. Все компоненты взвешивали согласно рецептуре, перемешивали, подавали в цилиндр экструдера, где материал при транспортировке термообрабатывался, гомогенизировался, формовался в форме цилиндров.
Рецептуры контрольного и экспериментального кормов, предназначенных для мальков радужной форели, представлены в табл. 1, их питательная ценность показана в табл. 2.
Таблица 1
Table 1
Состав контрольного и экспериментального комбикормов, %
Composition of control and experimental compound feeds, %
|
Компонент корма |
Контроль |
Эксперимент |
|
Рыбная мука |
40,8 |
30,8 |
|
Соевый концентрат |
14,0 |
|
|
Пшеничная мука |
10,0 |
10,0 |
|
Кукурузный глютен |
||
|
Добавка из личинки |
– |
|
|
Мука кровяная |
8,0 |
|
|
Рыбий жир |
10,0 |
|
|
Креветка сушеная |
4,0 |
|
|
Заменитель цельного молока |
2,0 |
|
|
Лизин |
0,01 |
|
|
Метионин |
||
|
Витамин С |
0,05 |
|
|
Эмульгатор жиров |
0,01 |
|
Окончание табл. 1
Ending of table 1
|
Компонент корма |
Контроль |
Эксперимент |
|
Танин акватан |
0,01 |
|
|
Сорбент |
||
|
Субтилис |
||
|
Антиоксидант |
||
|
КОК «Фермин» |
0,03 |
|
|
Пробиотик «Арлен» |
0,05 |
|
|
Бентонин |
0,50 |
|
|
Витаминно-минеральный премикс для форели |
||
Таблица 2
Table 2
Расчетные показатели питательной ценности кормов, использованных
в биологических испытаниях с радужной форелью
Estimated nutritional values of feeds used in biological trials with rainbow trout
|
Показатель |
Контроль |
Эксперимент |
|
Обменная энергия, ккал/100 г |
285 |
277 |
|
Влажность, % |
8,13 |
7,12 |
|
Сырой протеин, % |
54,74 |
53,76 |
|
Сырой жир, % |
6,62 |
|
|
Линолевая кислота, % |
0,63 |
0,71 |
|
Сырая клетчатка, % |
1,98 |
1,87 |
|
Сырая зола, % |
10,21 |
9,12 |
|
ЛПУ (крахмал + сахар), % |
10,17 |
11,12 |
|
Лизин, % |
3,40 |
3,54 |
|
Метионин, % |
1,16 |
1,09 |
|
Метионин + цистин, % |
1,74 |
1,66 |
|
Треонин, % |
2,04 |
2,12 |
|
Триптофан, % |
0,57 |
0,47 |
|
Аргинин, % |
3,06 |
3,17 |
|
Изолейцин, % |
1,95 |
1,99 |
|
Лейцин, % |
4,61 |
4,75 |
|
Валин, % |
2,72 |
2,83 |
|
Гистидин, % |
1,56 |
1,77 |
|
Фенилаланин, % |
2,49 |
2,51 |
|
Ca, % |
2,39 |
|
|
P, % |
1,75 |
|
|
Na, % |
0,64 |
|
|
Cl, % |
0,45 |
|
|
Витамин А, тыс. МЕ |
15,0 |
|
|
Витамин D3, тыс. МЕ |
3,0 |
|
|
Витамин Е, мг/кг |
20,0 |
|
|
Витамин К3, мг/кг |
1,25 |
|
|
Витамин В1, мг/кг |
15,0 |
|
|
Витамин В2, мг/кг |
30,0 |
|
|
Витамин В3, мг/кг |
87,5 |
|
|
Витамин В4, мг/кг |
250,0 |
|
|
Витамин В5, мг/кг |
25,0 |
|
|
Витамин В6, мг/кг |
7,5 |
|
|
Витамин В12, мг/кг |
0,05 |
|
|
Витамин Вс, мг/кг |
2,5 |
|
|
Витамин С, мг/кг |
995,0 |
|
|
Fе, мг/кг |
5,0 |
|
|
Cu, мг/кг |
1,25 |
|
|
Zn, мг/кг |
9,0 |
|
|
Mn, мг/кг |
12,5 |
|
|
Co, мг/кг |
0,25 |
|
|
I, мг/кг |
0,50 |
|
|
Se, мг/кг |
0,05 |
|
В течение 30 дней (с 5 июня по 4 июля 2024 г.) проводили сравнительные испытания в 2-х партиях форели (экспериментальная и контрольная) из 50 экземпляров каждая, массой на начало эксперимента 4–5 г. Для этого задействовали 2 рыбоводные установки, работающие по принципу замкнутого водоснабжения (УЗВ-установки). Кормление рыб осуществлялось 3 раза в сутки при взвешивании через каждые 10 дней.
Параметры воды в системе измерялись ежедневно. Уровень растворенного кислорода составил 7,5 ± 1,0 мг/л (Handy Polaris, OxyGuard International A/S, Биркерод, Дания), а средняя температура воды поддерживалась на уровне 18,9 ± 1,4 °C за счет работы чиллера (Hailea HC-2 200BH, Guangdong Hailea Group Co., Ltd, China). Концентрацию соединений азота определяли с помощью eXact® Eco-Check Photometer-Kit (Industrial Test Systems, Inc., Рок-Хилл, США), показатель содержания нитрита (в виде NO2) составил 0,08 ± 0,03 мг/л, нитрата (NO3) – 6,6 ± 1,8 мг/л. Циркуляция воды в системе осуществлялась за счет циркуляционного насоса производительностью 9,6 м3/ч (Pedrollo JSWm 3CL, Pedrollo S.p.A, Italy). Аэрация воды в бассейнах обеспечивалась за счет работы вихревого компрессора.
В период выращивания молоди радужной форели изучали весовые, гематологические и морфофизиологические показатели рыб, т. к. они позволяют определить физиологический статус выращенной молоди [10].
При оценке морфометрических особенностей выполняли следующие промеры: длина зоологическая, длина промысловая, длина по Смитту, длина головы, диаметр глаза, максимальная и минимальная высота тела, по стандартной методике.
Для оценки скорости роста молоди применяли общепродукционный коэффициент массонакопления [11]:
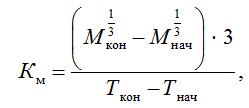
где Мнач и Мкон – начальная и конечная масса рыб, г; Тнач и Ткон – возраст рыб в начале и конце периода, сут.
Кроме того, рассчитывали относительный среднесуточный прирост по формуле [2, 9]
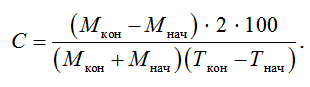
Для оценки упитанности рассчитывали коэффициент упитанности по Фультону. По результатам вскрытия оценивали уровень ожирения по 5-балльной шкале М. Л. Прозоровской [12, 13].
Для оценки физиологических показателей использовали метод морфофизиологических индикаторов, рассчитывались индексы печени, селезенки, сердца [14].
Гематологические исследования проводили по единым отработанным методикам. Отлов рыбы производили непосредственно перед проведением исследования – использовались активные и клинически здоровые особи, без видимых повреждений. Забор крови осуществляли из гемального канала хвостового стебля прижизненно.
Из концентрационных показателей крови определяли концентрацию гемоглобина, эритроцитов, лимфоцитов, общего белка в сыворотке крови, содержание гемоглобина в эритроците. Концентрацию гемоглобина определяли гемиглобинцианидным методом на гемо-глобинометре МИНИ-Гем 540, концентрацию эритроцитов – пробирочным методом, концентрацию общего белка в сыворотке крови – рефрактометрически, по коэффициенту преломления сыворотки, который измеряли на рефрактометре ИРФ-454 Б2М [15, 16].
Результаты и их обсуждение
Результаты исследования показали, что личинка Hermetia illucens, выращенная в условиях агрофирмы Лихварь П. В., является перспективным источником кормовых веществ и содержит (% массы на сухое вещество) белка 40,1 %, жира 21,6 %, минеральных веществ 13,1 %, углеводов 17,0 %, в том числе усвояемых 9,5 %, при этом количественный уровень неусвояемого хитина составляет 7,5 %. Полученная высокотемпературным гидролизом и высушенная сублимационно водорастворимая добавка содержала (% сырой массы) протеина 43,4 %, воды 12,3 %, жира 4,5 %, усвояемых углеводов 24,0 % и минеральных веществ 15,8 %. При этом хитин практически отсутствовал, был обнаружен только в следах.
Сравнительный анализ аминокислотного состава протеинов личинки Hermetia illucens, ее водорастворимой добавки и рыбной муки показал, что они близки. Все образцы содержали практически все незаменимые для рыб аминокислоты. Максимальное количество приходилось на аланин (8,5 %), глутаминовую кислоту (5,4 %), пролин (3,6 %), гистидин (3,5 %), лизин (2,3 %), а суммарное содержание незаменимых аминокислот в добавке было несколько выше относительно их количества в личинке (18,2 и 17,7 % соответственно). Установленная аналогия в аминокислотном профиле потенциально свидетельствует о питательной сбалансированности белков гидролизата личинки [17].
Установлено, что при гидролизе личинки основная масса минеральных веществ переходит в осадочную (водонерастворимую) фракцию, в сухой форме их содержание в водорастворимой добавке составило 15,8 %, а в водонерастворимой – 24,1 %. Результаты анализа показали, что минеральная фракция содержит калий, фосфор, кальций, магний и другие ценные минеральные вещества, необходимые для роста форели [17].
По окончании эксперимента был установлен химический состав молоди обеих групп. Он оказался практически идентичным (табл. 3), что свидетельствует об отсутствии отрицательного влияния компонентов добавки из гидролизованной личинки на формирование белковой массы, жировых накоплений и минерального скелета на данной стадии роста форели.
Таблица 3
Table 3
Общий химический состав молоди радужной форели,
выращенной с применением контрольных и экспериментальных комбикормов,
обогащенных гидролизатом личинки Нermetia illucens
General chemical composition of juvenile rainbow trout grown using control
and experimental feeds enriched with Нermetia illucens larval hydrolysate
|
Образец рыбы |
Вода |
Белок |
Жир |
Минеральные вещества |
|
Эксперимент |
77,21 ± 0,14 |
15,84 ± 0,09 |
4,76 ± 0,03 |
3,12 ± 0,05 |
|
Контроль |
76,72 ± 0,12 |
15,43 ± 0,11 |
5,17 ± 0,04 |
2,70 ± 0,06 |
В табл. 4 приведены усредненные данные по некоторым морфометрическим и морфофизиологическим показателям молоди форели, задействованной в эксперименте.
Таблица 4
Table 4
Морфометрические и морфофизиологические показатели молоди радужной форели
Morphometric and morphophysiological parameters of juvenile rainbow trout
|
Показатель |
Начало эксперимента* |
Завершение эксперимента (30 сут) |
||||
|
М |
m |
Контроль |
Опыт |
|||
|
М |
m |
М |
m |
|||
|
Длина зоологическая, см |
7,36 |
0,15 |
12,24 |
0,47 |
12,76 |
0,54 |
|
Длина промысловая, см |
6,40 |
0,12 |
10,98 |
0,42 |
11,42 |
0,52 |
|
Длина по Смитту, см |
7,08 |
0,14 |
11,80 |
0,45 |
12,12 |
0,47 |
|
Длина головы, см |
1,48 |
0,07 |
2,74 |
0,09 |
2,86 |
0,11 |
|
Диаметр глаза, см |
0,54 |
0,04 |
0,72 |
0,01 |
0,78 |
0,04 |
|
Максимальная высота тела, см |
1,72 |
0,03 |
3,30 |
0,12 |
3,56 |
0,14 |
|
Минимальная высота тела, см |
0,58 |
0,01 |
1,26 |
0,06 |
1,24 |
0,04 |
|
Масса, г |
4,32 |
0,22 |
26,29 |
3,06 |
29,78 |
3,66 |
|
Коэффициент упитанности по Фультону |
1,65 |
0,06 |
1,91 |
0,03 |
1,94 |
0,04 |
|
Ожирение в баллах |
3,00 |
0,33 |
3,00 |
0,24 |
2,60 |
0,30 |
|
Индексы внутренних органов |
||||||
|
Печень |
1,57 |
0,34 |
2,07 |
0,31 |
2,29 |
0,19 |
|
Сердце |
0,16 |
0,16 |
0,19 |
0,03 |
0,14 |
0,02 |
|
Селезенка |
0,14 |
0,06 |
0,14 |
0,05 |
0,11 |
0,02 |
* М – средневзвешенное значение; m – доверительный интервал.
При исходной средней массе 4,32 ± 0,22 г и зоологической длине 7,36 ± 0,15 см за 30 сут выращивания молодь форели контрольной группы достигла средней массы 26,29 ± 3,06 г и длины 12,24 ± 0,47 см (см. табл. 4). За этот же период времени молодь форели из опытной группы достигла средней массы 29,78 ± 3,66 г и длины 12,76 ± 0,54 см. При сравнении данных статистически достоверных различий не отмечается. Также не отмечено статистически достоверных различий и по остальным промерам.
Общепродукционный коэффициент массонакопления за период исследований у молоди форели контрольной группы составил 0,18, у опытной – 0,21. Относительный среднесуточный прирост в контрольной группе составил 3,50 %, в опытной – 3,64 %.
Таким образом, экспериментальные корма в период исследования обеспечивали темп линейного и весового роста молоди форели, несколько более высокий и сопоставимый с таковым у контрольной группы, питающейся стандартным рационом.
Коэффициент упитанности у форели контрольной группы составил 1,91 ± 0,03, у форели опытной группы – 1,94 ± 0,04, что можно считать достаточно высоким значением (удовлетворительные значения коэффициента для радужной форели должны быть не меньше 1) [18–20]. Достоверных различий по данному показателю, а также по уровню жирности по 5-балльной шкале между контрольной и опытной группой нет, что свидетельствует о схожем характере жиронакопления при кормлении кормами контрольной и опытной рецептур.
При вскрытии и визуальном осмотре молоди патологические изменения внутренних органов на начальном этапе исследований встречались единично и выражались в изменениях печени, некотором увеличении размеров желчного пузыря с изменением цвета желчи. На заключительном этапе исследований патологические изменения печени встречались у 2 особей в контрольной группе. В опытной группе особей с патологическими изменениями внутренних органов отмечено не было.
По результатам вскрытия оценивали морфофизиологические показатели молоди форели в период исследований (см. табл. 4).
По данным различных авторов, гепатосоматический индекс молоди форели (с учетом массы) может находиться в диапазоне 1,2–2,24 (чаще 1,2–1,5) [20, 21]. По некоторым данным, гепатосоматический индекс печени форели в возрасте до 2 лет в среднем не должен превышать 1,5 % массы рыбы; нормальная масса печени радужной форели – 1–1,4 % массы тела [21]. Однако ряд авторов приводят и более высокие значения гепатосоматического индекса для молоди форели (от 2,24 [22] до 2,5 (выше – ожирение органа) [19]). Основываясь на приведенных данных, полученные нами значения индекса печени (2,29 ± 0,19 в опытной, 2,07 ± 0,31 в контрольной группе) не имеют достоверных различий; в рамках имеющегося диапазона данных их можно признать относительно высокими. Однако, учитывая отсутствие рыб с патологическими изменениями органа при визуальной оценке в опытной группе, а также отсутствие достоверных различий между молодью контрольной и опытной групп, можно утверждать, что данные значения не связаны с включением в корма экспериментальной добавки из гидролизата личинки.
Индекс сердца молоди опытной группы составил 0,19 ± 0,03, контрольной группы – 0,14 ± 0,02. Достоверных различий не выявлено. В целом данные по индексу сердца близки к значениям, известным из литературных источников для форели схожей массы (0,10–0,24) [10, 14, 20].
Индекс селезенки у молоди форели опытной группы составил 0,11 ± 0,02, контрольной группы – 0,14 ± 0,05. Достоверных различий не отмечено. Полученные значения в целом близки к нижней границе диапазона значений для форели схожей массы и возраста из литературных источников (0,09–0,28) [14, 20]. В целом ввиду сложности и разнообразия физиологических функций селезенки ее средняя масса достаточно лабильна [20]; в эксперименте относительно невысокие ее значения могут быть связаны с особенностями кислородного режима и гидрохимических условий в установке.
Гематологические показатели экспериментальных и контрольных образцов молоди форели крови приведены в табл. 5.
Таблица 5
Table 5
Концентрационные показатели крови молоди радужной форели
Blood concentration indices of juvenile rainbow trout
|
Показатель |
Начало |
Завершение эксперимента (30 сут) |
|
|
Контроль |
Опыт |
||
|
Концентрация эритроцитов, млн/мкл |
1,08 ± 0,4 |
1,10 ± 0,5 |
1,08 ± 0,4 |
|
Концентрация лимфоцитов, % |
65 ± 1,1 |
79 ± 1,3 |
94 ± 1,6 |
|
Концентрация гемоглобина, г% |
10 ± 0,1 |
11 ± 0,1 |
10 ± 0,1 |
|
Содержание гемоглобина в эритроците, пг |
62,0 ± 1,0 |
62,5 ± 1,2 |
62,5 ± 1,4 |
|
Общий белок в сыворотке крови, г% |
5,8 ± 0,1 |
5,8 ± 0,1 |
5,6 ± 0,1 |
Из данных табл. 5 можно сделать заключение, что форменные элементы крови в обеих группах молоди форели находятся в норме, без патологических изменений. Клетки крови моноциты (не зернистые лейкоциты, участвующие в иммуногенезе) в контрольной группе составили 11 %, тогда как в опытной группе 14 %. Считается, что в норме у взрослой форели этот показатель должен быть на уровне 16 % [16]. С учетом того, что исследования проводилось на молоди, полученные данные свидетельствуют о несколько лучшем формировании иммунного статуса у рыб экспериментальной группы на данном этапе исследований. Несколько повышенное содержание белка в крови форели контрольной группы (5,8 г% в начале и в конце эксперимента) показывает некоторое сгущение крови у данных рыб и более высокую потенциальную склонность к гемолизу, хотя различия недостоверны. Идентичное содержание гемоглобина в крови обеих партий рыб свидетельствует о практически одинаковом уровне обмена кислорода.
Заключение
Результаты биологических исследований по применению продуктов гидролиза личинки Hermetia illucens в составе комбикорма для молоди радужной форели, выращиваемой в индустриальной аквакультуре, показали целесообразность использования личинки в виде ее водорастворимого сушеного гидролизата, полученного высокотемпературным гидролизом. Данная обработка позволила удалить хитин из состава и перевести белки в низкомолекулярное физиологически усвояемое состояние. Аминокислотный состав личинки и ее водорастворимого гидролизата показал близость их по данному показателю протеинам рыбной кормовой муки. В составе гидролизата обнаружены ценные минеральные вещества – калий, фосфор, кальций, магний и другие, полезные растущему организму.
Введение в составе комбикормов для молоди форели взамен 10 % рыбной муки гидролизата личинки в течение 30 сут испытаний не привело к изменению химического состава рыб, достоверным различиям в значениях морфометрических и морфофизиологических характеристик. По основным гематологическим показателям крови также не было обнаружено достоверных различий между контрольной и экспериментальной группой рыб. Все показатели находились на уровне, характерном для здоровых рыб.
Установленная идентичность в показателях экспериментальных и контрольных групп рыб свидетельствует о перспективности протеинового потенциала личинки Hermetia illucens в форме ее водорастворимого бесхитинового гидролизата в кормопроизводстве для развития аквакультуры.
1. Лагуткина Л. Ю. Перспективное развитие мирового производства кормов для аквакультуры: альтернативные источники сырья // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2017. № 1. С. 67–78.
2. Ушакова Н. А., Пономарев С. В., Федоровых Ю. В., Бастраков А. И., Павлов Д. С. Физиологические основы питательной ценности концентрата личинок Hermetia illucens в рационе рыб // Изв. РАН. Сер. биологическая. 2020. № 3. С. 293–300.
3. Матросова С. В., Лябзина С. Н., Горбач В. В., Ильмаст Ю. Н. Оценка эффективности кормления радужной форели (Oncorhynchus mykiss) диетой на основе личинки черной львинки // Изв. КГТУ. 2023. № 71. С. 11–23.
4. Тышко Н. В., Жминченко В. М., Никитин Н. С., Требух М. Д., Шестакова С. И., Пашорина В. А., Сады-кова Э. О. Комплексные исследования биологической ценности белка личинки Hermetia illucens // Вопр. пита-ния. 2021. Т. 90. № 5. С. 49–58. DOI: org/10.33029/0042-8833-2021-90-5-49-58.
5. Мезенова О. Я., Максимова С. Н., Агафонова С. В., Романенко Н. Ю., Калинина Н. С., Волков В. В., Мерзель Й. Т. Оценка биопотенциала вторичного крабового сырья и продуктов его гидролиза для использования в аквабиотехнологии // Вестн. Междунар. акад. холода. 2023. № 3. С. 44–53. DOI:https://doi.org/10.17586/1606-4313-2023-22-3-44-52.
6. Shakhova E., Mezenova O., Romanenko N., Agafonova S., Volkov V., Kalinina N., Pyanov D. Effect of inclusion of fish protein hydrolysate in diet for european whitefish (Coregonus lavaretus Linnaeus, 1758) juveniles on their hematological parameters // BIO Web of Conferences 64, 01010. 2023. V. 64. DOI: https://doi.org/10.1051/bioconf/20236401010.
7. Садыкова Э. О., Шумакова А. А., Шестакова С. И., Тышко Н. В. Пищевая и биологическая ценность биомассы личинок Hermetia illucens // Вопр. питания. 2021. Т. 90. № 2. С. 73–82.
8. Fairuz Liyana Mohd Rasdi, Ahmad Razali Ishak, Pui Wee Hua, Siti Norashikin Mohd Shaifuddin, Nazri Che Dom, Farah Ayuni Shafie, Abdul Mujid Abdullah, Zulhisyam Abdul Kari, Hisham Atan Edinur. Evaluating the growth and development of black soldier fly (BSF) (Hermetia illucens (L.)) (Diptera: Stratiomyidae) larvae reared on different agricultural waste materials // Serranga. 2023. V. 289 (1). P. 55–68.
9. Мезенова О. Я. Биотехнологические способы по-лучения протеиновых и белково-минеральных добавок из вторичного рыбного сырья коптильных производств // Изв. вузов. Пищевая технология. 2019. № 2-3. С. 68–71.
10. Князева Л. М., Шумилина А. К., Костюничев В. В.,Остроумова И. Н. Биологические особенности молоди сиговых и форели в условиях индустриального выращивания. СПб.: Изд-во ГосНИОРХ, 2007. 56 с.
11. Купинский С. Б. Продукционные возможности объектов аквакультуры. М.: Экон-Информ, 2010. 139 с.
12. Никольский Г. В. Экология рыб. М.: Высш. шк., 1974. 368 с.
13. Правдин И. Ф. Руководство по изучению рыб (преимущественно пресноводных). М.: Пищ. пром-сть, 1966. 376 с.
14. Шварц С. С., Смирнов В. С., Добринский Л. Н. Метод морфофизиологических индикаторов в экологии наземных позвоночных. Свердловск: Урал. фил. Акад. наук СССР, 1968. Т. 3. Вып. 58. 137 с.
15. Методические указания по проведению гематологического обследования рыб (утв. Минсельхозпродом 02 февраля 1999 г. № 13-4-2-/1487). URL: https://e-ecolog.ru/docs/pQbF13m1UU6Pwog1f85Wo?utm_referrer=https%3A%2F%2Fwww.yandex.ru%2 (дата обращения: 26.05.2024).
16. Иванова Н. Т. Атлас клеток крови рыб. М.: Лег. и пищ. пром-сть, 1983. 86 с.
17. Щербина М. А., Гамыгин Е. А. Кормление рыб в пресноводной аквакультуре. М.: Изд-во ВНИРО, 2006. 360 с.
18. Ворошилина З. П., Саковская В. Г., Хрусталев Е. И. Товарное рыбоводство. М.: Колос, 2009. 266 с.
19. Габолаева А. Р. Морфофизиологические изменения органов радужной форели // Актуальные вопросы совершенствования технологии производства и переработки продукции сельского хозяйства: материалы Междунар. науч.-практ. конф. (Йошкар-Ола, 16–17 марта 2022 г.). Йошкар-Ола: Изд-во Марийс. гос. ун-та, 2022. Т. XXIV. С. 484–487.
20. Курицын А. Е., Ефремов С. А., Макарова Т. А. Морфофизиологические характеристики радужной форели (Oncorhynchus mykiss Walbaum) и муксуна (Coregonus muksun (Pallas)) при садковом выращивании // Изв. ТСХА. М.: 2017. Вып. 3. С. 84–94.
21. Молчанова К. А. Рыбоводно-биологические особенности формирования маточного стада радужной форели в установках замкнутого водоснабжения: дис. … канд. биол. наук. Калининград: Изд-во КГТУ, 2018. 180 с.
22. Кошак Ж., Кошак А., Долгая Д., Кохович А., Рукшан Л. Комбикорма для радужной форели с различными видами протеина // Комбикорма. 2019. № 7-8. С. 32–36. DOI:https://doi.org/10.25741/2413-287X-2019-07-3-077.
















