Россия
Рассматривается опыт преднерестовой гормональной стимуляции карпа на центральном рыбоводном заводе Аль-Сувайра, в провинции Васит Республики Ирак. Приводится сравнительный анализ эффек-тивности применения высушенного гипофизарного экстракта и синтетического препарата «Нерестин» при искусственном воспроизводстве карпа. Исследовалось влияние биологически активного фактора на репродуктивные процессы как у самцов, так и у самок карпа в контролируемых искусственных условиях. Результаты показали, что исследуемые в преднерестовый период препарат на основе высушенного гормона гипофиза и Нерестин при применении по отдельности привели к успешному нересту карпа, с небольшими различиями в показателях оплодотворения и вылупления. При экспериментальной преднерестовой гормональной стимуляции обыкновенного карпа (Cyprinus carpio) в условиях искусственного воспроизводства на рыбоводном заводе Аль-Сувайра после введения гормонального препарата «Нерестин» нерестующим самкам доля зрелой икры у особей достигла в среднем 98 %. Однако комбинированное применение гипофизарного экстракта и Нерестина привело к большей вариативности результатов и сопровождалось снижением эффективности. Показатели процента оплодотворения и выхода предличинок для группы, в которой применялось комбинированное воздействие препаратов, также отличались более низкими усредненными значениями при большей ширине доверительного интервала для измеряемой величины. Для обесклеивания икринок использовали разбавленный сок ананаса, выдерживая их в этом растворе в течение 20 минут, с добавлением разбавленного экстракта зеленого чая для укрепления оболочки икры. Препарат «Нерестин», являясь синтетическим и экономически выгодным препаратом в силу более низкой цены, может стать перспективной альтернативой распространенным в настоящее время препаратам на основе гипофизарного экстракта для стимуляции нереста карпа в аквакультуре Ирака.
карп, искусственное разведение, гормональная стимуляция, гипофизарный экстракт, икра, оплодотворение, предличинки
Введение
На протяжении последних трех десятилетий аквакультура является самым быстрорастущим в мире подсектором производства продуктов питания, в котором производится более половины всей рыбы, потребляемой непосредственно человеком [1].
Рыба – важный источник животного белка и других питательных веществ в рационе питания людей. Рыбная продукция содержит необходимые белки и микроэлементы, включая кальций, витамин А, витамин В12 и омега-3 жирные кислоты [2, 3]. Рассматривая динамику среднегодового потребления пищевой рыбы в мире в период с 1961 по 2016 г., можно увидеть, что годовой рост этого показателя (примерно 3,2 %) в последнее время опережал рост численности населения (1,6 %) [4]. Потребление пищевой рыбы на душу населения возросло с 9 кг в 1961 г. до 20,5 кг в 2017 г. Спрос на рыбу в последние годы увеличился в связи с ростом населения, а также тенденцией, связанной с растущим запросом на продовольственную продукцию, соответствующую принципам здорового питания. По данным Бразильского института географии и статистики [5], в условиях постоянного роста численности населения планеты
к 2050 г. предложение продовольствия и кормов должно увеличиться на 70 % [6].
Аквакультура – это сложный сектор производства продуктов питания, в рамках которого выращивается большое число различных видов водных животных и растений, при этом значительная доля предложения аквакультуры обусловлена ростом мирового спроса на рыбу [7]. На долю азиатских стран приходится около 89 % мирового объема производства аквакультуры, причем доминирующее положение занимает Китай (61,5 %), за которым следуют Индия, Индонезия, Вьетнам, Бангладеш, Египет, Норвегия, Чили, Мьянма и Таиланд [8]. Рыбу часто выращивают на ограниченных территориях, таких как пруды или сетчатые садки, стремясь максимизировать производство на единицу площади [9]. Одомашнивание – это повышение способности рыб регулировать гормональные и репродуктивные процессы в неволе и получать личинок хорошего качества для продажи [10, 11]. Однако из-за различий, возникающих в результате сочетания стресс-факторов в неволе, таких как недостаток питания, изменение температуры, а также различий в экологических факторных нагрузках между дикой и искусственно выращиваемой рыбой, у многих объектов, выращенных в неволе, наблюдаются некоторые формы репродуктивных нарушений. Сочетание существующих необходимых адаптаций запускает эндокринные механизмы, которые приводят к окончательному созреванию ооцитов (FOM) и овуляции [12]. Выращенные в неволе самки часто не успевают завершить FOM, овулировать и отложить икру, а у самцов снижается количество или качество спермы [12, 13]. Результатом подобных проблем порой становится нехватка молоди для выращивания.
Однако в целом искусственное разведение является эффективным способом увеличения производства рыбы и сохранения исчезающих видов. На рыб влияют факторы окружающей среды (качество воды, температура, кормление, осадки, фотопериод), которые стимулируют выделение гонадотропин-рилизинг-гормонов [14]. Они стимулируют выработку гонадотропных гормонов в передней доле гипофиза, а именно лютеинизирующего гормона и фолликулостимулирующего гормона. Фолликулостимулирующий гормон регулирует вителлогенез
и сперматогенез в эндокринной системе, а лютеинизирующий гормон – FOM и сперматогенез [15].
У рыб, содержащихся в неволе, часто отсутствуют экологические сигналы, необходимые для репродуктивной активности эндокринной системы. Поэтому для снижения репродуктивных проблем в неволе следует применять различные гормоны, регулирующие размножение рыб [10, 15]. Кроме того, такой подход гарантирует наличие молоди в течение всего года [16]. Учитывая, что многие виды рыб размножаются только раз в год, искусственное разведение также может стать одним из лучших решений для удовлетворения спроса и позволит сократить объемы вылова и, соответственно, изъятия биоресурсов из природных экосистем.
Препараты на основе гормонов применяются в аквакультуре для решения задач искусственного воспроизводства и изменения пола выращиваемых объектов. За счет первой задачи поддерживается постоянный выпуск мальков, лежащий в основе производственных цепочек технологических процессов. Необходимость в решении второй задачи возникает в случаях, когда скорость роста или масса прироста самцов и самок различны, и обычно возникает в период полового созревания [17].
Известно, что высушенный гормон гипофиза во многих странах считается основным препаратом, используемым в технологическом процессе искусственного размножения рыб, несмотря на сложность его приготовления и высокую рыночную цену. В Ираке его стоимость иногда достигает 700 долл. за 1 г, в том числе из-за фактора монополии на его производство. В связи с достаточно высокой ценой препарата у производителей осетровых и карпа возникла необходимость замены его другими гормональными препаратами. Более того, получение гипофиза карпа (CPE) сложно, трудоемко и неэффективно, поскольку требует жертвовать большим количеством выводкового поголовья для сбора большого количества питуитарных желез с низким процентом успеха [12, 18]. Кроме того, CPE весьма вариативен в отношении показателя качества, имеет низкий уровень активности по оси HPG и может передавать заболевания от донора к рыбе-реципиенту [19]. Ученые разработали препараты, основанные на использовании рилизинг-гормонов, активирующих гипофиз у производителей рыбы. В настоящий момент известны такие препараты, как «Сурфагон» (ЛГ-РГ-А), «Оваприм», «Оватид», «Овапель», «GnRH» и «Нерестин» [20, 21]. Однако в целом в настоящее время экстракт гипофиза карпа является наиболее широко применяемым гормоном для стимуляции икрометания рыбы во всем мире и используется фермерами, особенно при разведении обыкновенного, индийского и китайского карпов [22].
Цель исследования заключается в сравнительном анализе эффективности препарата высушенного гипофиза с препаратом-аналогом – Нерестином – как фактора преднерестовой гормональной стимуляции обыкновенного карпа (Cyprinus carpio) в условиях товарного рыбоводства Республики Ирак. Данная цель представляется актуальной в силу того, что эксперименты по использованию синтетического препарата «Нерестин» и исследованию его влияния как биологически активного фактора на репродуктивные процессы у производителей карпа проводятся впервые в условиях рыбоводного завода Аль-Сувайра.
Материалы и методы
Исследование проводилось в течение 14 дней, с 20 июля по 2 августа 2024 г., на иракском центральном рыбоводном заводе Аль-Сувайра в провинции Васит. Бетонные рыбоводные емкости объемом 1 000 л, в которых содержались особи, снабжались водой из скважин с помощью трехдюймовых электрических водяных насосов. Аэрацию воды проводили при помощи воздушного компрессора для достижения необходимого уровня содержания растворенного кислорода в резервуарах. При инкубации икры использовали 180 конусообразных резервуаров (емкостью 10 л), оборудованных водопроводными трубами, которые помогают перемешивать оплодотворенную икру с целью дополнительной аэрации и профилактики сапролегниоза, а сверху расположены трубки для воды, которые, в свою очередь, помогают переносить вылупившихся личинок в отведенные для этого инкубаторы. В период проведения эксперимента температура воды колебалась в пределах 22–23 ºС. Температура наружного воздуха колебалась от 37 ºС ночью до 48 ºС днем. Путем визуального и ручного осмотра были отобраны 12 явно зрелых самок карпа средней массой 5,0 кг и 12 самцов средней массой 3,0 кг. За неделю до начала процесса инъецирования, стимулирующего половое созревание, рыбы прошли акклиматизацию и карантин.
Через неделю после помещения рыб в акклиматизационные пруды они были распределены по трем группам – A, B, C, в каждой из которых было по 4 рыбы из расчета 20 кг на группу. Всех рыб инъецировали в одно и то же время и в одинаковых условиях. Объектам в группах A, C (первая доза) вводили 10 % гипофизарного экстракта, в группе B – 20 % препарат «Нерестин» [23]; по истечении 12 ч рыбам группы A вводили гипофизарный экстракт (вторая доза) – 90 %, особям же групп B и С – 80 % «Нерестин».
С учетом проводившихся ранее исследова-
ний [23], где в двухкомпонентных схемах стимулирования нереста с помощью препарата гипофиза чаще всего использовалась схема «10 % – 90 %», с учетом рекомендованной дозы введения гормонального препарата и во избежание ее превышения при инъецировании особей, для группы С, где использовалась двухкомпонентная комбинированная схема на основе препарата гипофиза и препарата «Нерестин», для первого компонента вводимая доза препарата гипофиза составила 10 %, что по эффективности, как предполагалось в рамках планирования эксперимента, должно быть эквивалентно 20 % дозе Нерестина – первого компонента в группе B, второй же компонент – Нерестин – в группе С, как и в случае группы B, составлял 80 %.
Самцам также вводили одну дозу гипофизарного экстракта в то же время, что и самкам. За рыбами следили и периодически осматривали их после второй инъекции, через 10 ч после введения второй дозы икру отбирали (рис. 1).
|
|
|
|
|
а |
б |
в |
Рис. 1. Получение половых продуктов у самок и самцов после инъецирования:
а, б – отцеживание; в – искусственное оплодотворение
Fig. 1. Preparation of sex products in females and males after injection:
a, б – separation; в – artificial insemination
В период между второй инъекцией и наступлением половой зрелости готовили разбавленный ананасовый сок (разбавление 1 : 50 по объему), который использовали для промывки икры. Также был приготовлен раствор на основе чайных листьев (50 г чайных листьев на 100 л воды), который использовался для укрепления стенок икры в процессе обесклеивания.
При осеменении использовали 10 мл спермы на каждый 1 кг икринок, перемешивая их в течение минуты с помощью тонкого пера. После промывки икринок использовали разбавленный сок ананаса для окончательного обесклеивания, выдерживая их в этом растворе в течение 20 мин с добавлением разбавленного экстракта зеленого чая для укрепления оболочки икры (рис. 2 а, б). Набухшую икру закладывали в аппараты порциями по 150 г (рис. 2, в).
|
|
|
|
|
а |
б |
в |
Рис. 2. Процесс получения потомства:
а – обесклеивание оплодотворенной икры; б – укрепление оболочки икры; в – инкубация
Fig. 2. The process of obtaining offspring:
a – desecration of fertilized caviar; б – strengthening of the calf shell; в – incubation
Исследование икринок для определения коэффициента оплодотворения проводили при помощи электронного микроскопа (рис. 3).


Рис. 3. Определение процента оплодотворения
Fig. 3. Determination of the percentage of fertilization
Эффективность ответной реакции на введение внешних гормонов-стимуляторов искусственного воспроизводства карпа оценивали по результатам рыбоводных показателей:
– процент созревшей икры = количество зрелых яиц / общее количество икры · 100;
– процент оплодотворения икры = количество оплодотворенной икры / количество зрелой икры · 100;
– процент выхода предличинок = количество вылупившихся предличинок / количество оплодотворенной икры / нормально развивающихся эмбрионов · 100.
Дополнительно рассчитывалась величина коэффициента зрелости как процент массы гонад от массы тела рыбы.
По результатам экспериментов для измеряемых показателей рассчитывались величины средних значений и доверительного интервала для уровня надежности 95 %. Сравнение средних в группах и оценка выявленных отличий при уровне значимости p < 0,05 осуществлялись с помощью дисперсионного анализа, для поправки на множественные сравнения использовался критерий Тьюки.
Результаты и обсуждение
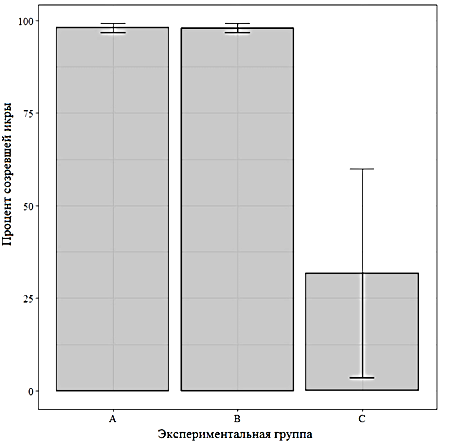
Через 10 ч после введения второй дозы внешних гормонов-стимуляторов у рыб групп А и В появились признаки зрелости, которые определяются: 1) повышенной активностью и движением; 2) образованием пены на поверхности воды. В группе С наблюдаются аналогичные признаки, но в меньшей степени, чем в группах А и В. Процент созревшей икры в группах А и В составил 98,0 % (табл. 1).
Таблица 1
Table 1
Эффективность нерестового процесса
Efficiency of spawning process
|
Показатели нерестового процесса |
Группа |
||
|
А |
B |
C |
|
|
Инъекция |
Гипофиз |
Нерестин |
Гипофиз + Нерестин |
|
Первая доза, % |
10 |
20 |
10 |
|
Вторая доза, % |
90 |
80 |
|
|
% созревшей икры |
98,0 ± 1,3 |
31,0 ± 28,2 |
|
|
Масса самок, г |
5 087 ± 130 |
5 117 ± 225 |
5 055 ± 113 |
|
Масса икры, г |
875,0 ± 46 |
853,0 ± 79 |
142,0 ± 101 |
|
% оплодотворения |
86,0 ± 3,8 |
85,0 ± 3,4 |
55,5 ± 23 |
|
% выхода предличинок |
89,0 ± 2,9 |
86,0 ± 5,3 |
66,0 ± 9,0 |
Как видно из данных табл. 1 и рис. 4, эффективность применения гормонов-стимуляторов – экстракта гипофиза и Нерестина – в качестве монокомпонентных препаратов более высока в сравнении с комбинированным их воздействием в случае группы С.
Также при сочетании в рамках комбинированной двухкомпонентной схемы препаратов гипофиза и Нерестина наблюдается, согласно полученным в ходе эксперимента результатам, существенное снижение величин исследуемых показателей в сравнении с результатами для препарата гипофиза – как процента оплодотворения, так и показателя созревшей икры, – и, в меньшей степени, процента выхода предличинок.
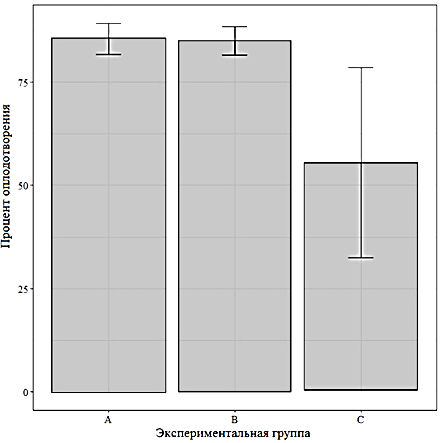
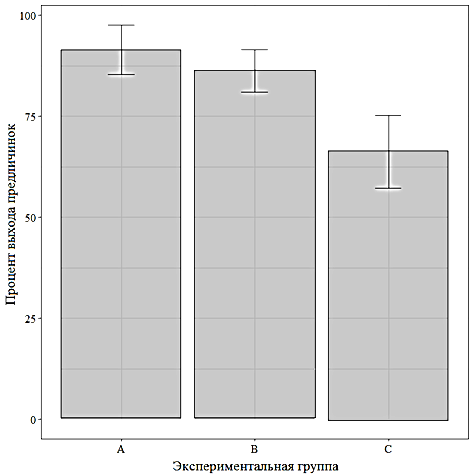
Процент оплодотворения для группы А составил 86,0 % при доле созревшей икры 98,0 %, предличинки начали вылупляться через 78 ч, процент вылупления составил 89,0 %. Коэффициент зрелости составил 17,2 ± 0,68 % (около 172 г массы гонад на 1 кг массы тела самок.
а б
Рис. 4. Показатели средневыборочных значений по результатам определения эффективности нерестового процесса
с учетом величин доверительных интервалов (при уровне надежности 95 %):
а – показатель доли созревшей икры; б – показатель эффективности оплодотворения.
Обозначения экспериментальных групп в соответствии с табл. 1
Fig. 4. Indicators of average values based on the results of evaluation of the efficiency
of the spawning process with 95% family-wise confidence intervals:
а – an indicator of the proportion of mature fish eggs; б – fertilization efficiency indicator.
Designations of experimental groups according to Table 1
в
Рис. 4 (окончание). Показатели средневыборочных значений по результатам определения эффективности
нерестового процесса с учетом величин доверительных интервалов (при уровне надежности 95 %):
в – процент выхода предличинок
Fig. 4 (ending). Indicators of average values based on the results of evaluation of the efficiency
of the spawning process with 95% family-wise confidence intervals:
в – % of hatched prelarvae
Что касается группы B, то установлено, что уровень половой зрелости у всех рыб достигал 98 %, коэффициент зрелости составил 16,7 ± 1,94 % (около 166,7 г массы гонад на 1 кг массы тела самки), уровень оплодотворения и вылупляемости 85,0 %. Вылупление личинок происходило через 78 ч.
В группе С наблюдалась простая реакция рыб, т. к. у некоторых из них наблюдались признаки половой зрелости в виде движения и контакта со стенками рыбоводной емкости со стороны брюшка, в то время как другие не проявляли никаких признаков половой зрелости, но при осмотре и изъятии икры все рыбы в разных пропорциях дали икру, со средней массой гонад 28,1 г на 1 кг массы тела (см. табл. 1). Коэффициент зрелости гонад в группе С также в итоге оказался существенно ниже, нежели в группах A и B, составив 2,8 ± 1,8 %. Процент оплодотворения для группы С составил 55,5 %, выхода предличинок – 66,25 %. Следует отметить, что в группе С использовалась комбинированная схема из групп А и B, где первая доза (препарат на основе экстракта гипофиза) соответствовала группе A, вторая доза (препарат Нерестин) – группе B. В результате снижение в группе С первой дозы стимуляторов в сравнении
с группой B (где использовался Нерестин) и второй дозы стимуляторов в сравнении с группой А (с препаратом на основе высушенного гипофизарного экстракта) составило по 10 %, что может обуславливать итоговое уменьшение результирующих показателей эффективности нерестового процесса.
Результаты проведенного эксперимента в отношении показателей доли созревшей икры, процента оплодотворения и вылупившихся из икры предличинок приведены на рис. 4 в виде диаграмм с отмеченными для средних значений величинами доверительного интервала при доверительной вероятности 95 %.
Можно заметить, что существенно отличаются в сторону снижения показатели группы С, при этом для нее по всем показателям существенно шире величина доверительного интервала, тогда как отличия между группами A и B визуально незначительны.
Однако помимо визуального анализа для подтверждения наблюдаемых результатов был проведен дисперсионный анализ различий между средневыборочными значениями по исследуемым показателям. Результаты дисперсионного анализа для этих трех показателей представлены в табл. 2.
Таблица 2
Table 2
Результаты дисперсионного анализа показателей эффективности искусственного воспроизводства
Results of analysis of variance of artificial reproduction efficiency indicators
|
Оцениваемые параметры |
% созревшей икры |
% оплодотворения |
% вылупившихся |
|
F* |
24,753 |
7,449 |
24,843 |
|
p |
0,002 |
0,03 |
0,002 |
* Рассчитано в соответствии с F-тестом Уэлча.
Из данных табл. 2 очевидно, что во всех случаях для трех исследуемых групп были выявлены статистически значимые отличия для выбранного уровня значимости p < 0,05.
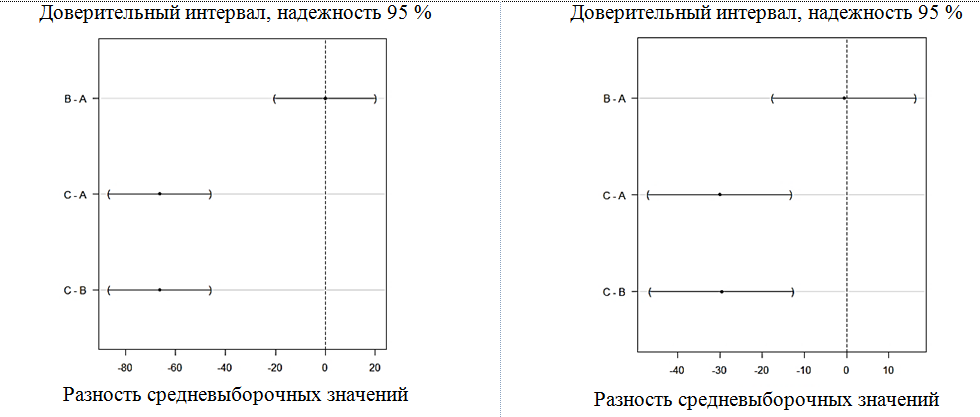
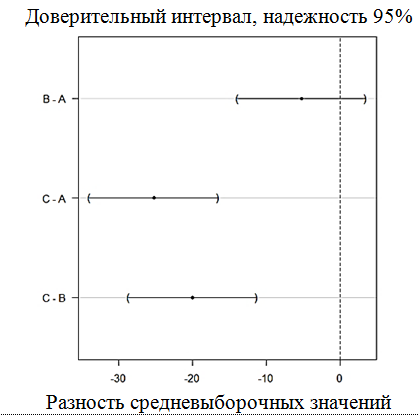
Результаты этого анализа с учетом поправки на множественные сравнения при использовании критерия Тьюки приведены на рис. 5.
а б
в
Рис. 5. Результаты дисперсионного анализа показателей эффективности нерестового процесса
в экспериментальных группах с учетом поправок на множественные сравнения по критерию Тьюки:
а – показатель доли созревшей икры; б – показатель эффективности оплодотворения;
в – процент вылупившихся личинок. Обозначения экспериментальных групп в соответствии с табл. 1
Fig. 5. Results of the ANOVA of the efficiency indicators of the spawning process in experimental groups,
adjusted for multiple comparisons according to the Tukey’s range test:
а – the proportion of ripe eggs; б – the efficiency of fertilization; в – the percentage of hatched larvae.
Designations of the experimental groups according to Table 1
По результатам дисперсионного анализа можно увидеть, что для всех показателей – доли cозревшей икры, процента оплодотворения и вылупившихся личинок – группа C значимо (p < 0,05) отличается от групп A и B, тогда как различий средневыборочных значений между группами A и B не выявлено: в рассчитанный для разности средневыборочных по группам A и B доверительный интервал с надежностью 95 % для каждого из показателей входит нулевое значение, тогда как для разностей средних в группах С – А, C – B доверительный интервал с аналогичной надежностью нулевого значения не покрывает.
Учитывая приведенные в табл. 1 и на рис. 4 величины, можно сделать вывод о том, что совместное последовательное применение препаратов гипофиза и Нерестина статистически значимо (p < 0,05) и довольно существенно снижает общую эффективность процесса преднерестовой гормональной стимуляции у карпа. Это снижение составляет 68,4 % в отношении показателя доли созревшей икры, 35,5 % для показателя эффективности оплодотворения, 25,8 % в случае показателя вылупления предличинок, если сопоставлять результаты с показателями для препарата гипофиза, при сравнении с показателями препарата «Нерестин» аналогичное снижение составляет 68,4, 34,7 и 23,3 % соответственно. Вместе с тем показатели при применении Нерестина вполне сравнимы с показателями при применении препарата гипофиза, таким образом, для Нерестина как отдельного препарата подтверждена эффективность применения, соответствующая результатам для применения экстракта гипофиза CPE.
Заключение
Преднерестовая гормональная стимуляция карпа в условиях центрального рыбоводного завода Аль-Сувайра при использовании Нерестина в качестве отдельного препарата улучшает процесс полового созревания и выхода икры карпа с высокой эффективностью. Результаты преднерестового стимулирования созревания гонад и выделения половых продуктов с использованием комбинирования препаратов уступают по достигнутым в эксперименте значениям показателей эффективности технологии применения CPE в отношении как доли созревшей икры, так и процента оплодотворения и выхода предличинок, а также оценок коэффициента зрелости (% массы гонад от массы тела). При этом полученные в результате эксперимента средние величины показателей эффективности синтетического препарата «Нерестин» при его применении в схемах стимулирования нереста, не включающих инъекции CPE, обуславливают предпочтительность использования этого препарата в сравнении с высушенным экстрактом гипофиза с точки зрения экономической привлекательности. Учитывая более низкую цену препарата, в перспективе за счет его использования возможно увеличение объемов выращивания карпа без потребности в существенном росте объема инвестиций в производство продукции аквакультуры.
1. Filipski M., Belton B. Give a man a fishpond: Modeling the impacts of aquaculture in the rural economy // World Development. 2018. V. 110. P. 205–223. https://doi.org/10.1016/j.worlddev.2018.05.023.
2. Carbone D., Faggio C. Importance of prebiotics in aquaculture as immunostimulants. Effects on immune system of Sparus aurata and Dicentrarchus labrax // Fish and Shellfish Immunology. 2016. V. 54. P. 172–178. https://doi.org/10.1016/j.fsi.2016.04.011.
3. Jayasankar P. Present status of freshwater aquaculture in India. A review // Indian Journal of Fisheries. 2018. V. 65 (4). P. 157–165. https://doi. org/10.21077/ijf.2018.65.4.81300-20.
4. FAO. 2018. The state of world fisheries and aquaculture 2018 – Meeting the sustainable development goals. FAO, Rome. 210 p. http://www.fao.org/3/i9540en/i9540en.pdf.
5. IBGE. Produção da Pecuária Municipal – 2015. Rio de Janeiro, RJ: Instituto Brasileiro de Geografia e Estatística, 2015. URL: http://biblioteca.ibge.gov.br/visualizacao/periodicos/84/ppm_2014_v42_br.pdf (дата обращения: 22.07.2024).
6. De Bruijn I., Liu Y., Wiegertjes G. F., Raaijmakers J. M. Exploring fish microbial communities to mitigate emerging diseases in aquaculture // FEMS Microbiology Ecology. 2017. V. 94 (1). fix161. https://doi.org/10.1093/femsec/ fix161.
7. Karim M., Leemans K., Akester M., Phillips M. Perfor-mance of emergent aquaculture technologies in Myanmar; challenges and opportunities // Aquaculture. 2020. V. 519. P. 734875. https:// doi.org/10.1016/j.aquaculture.2019.734875.
8. Ahmed N., Thompson S. The blue dimensions of aquaculture: A global synthesis // Science of The Total Environment. 2019. V. 652. P. 851–861. https://doi.org/10.1016/j.scitotenv.2018.10.163.
9. Mehana E., Rahmani A., Aly S. Immunostimulants and fish culture: An overview // Annual Research and Review in Biology. 2015. V. 5 (6). P. 477–489. https://doi.org/10.9734/ arrb/2015/9558.
10. Mylonas C. C., Fostier A., Zanuy S. Broodstock management and hormonal manipulations of fish reproduction // General and Comparative Endocrinology. 2010. V. 165 (3). P. 516–534. https://doi.org/10.1016/j.ygcen.2009.03.007.
11. Passini G., Carvalho C., Sterzelecki F. C., Baloi M. F., Cerqueira V. R. Spermatogenesis and steroid hormone profile in puberty of laboratory-reared common snook (Centropomus undecimalis) // Aquaculture. 2019. V. 500. P. 622–630. https:// doi.org/10.1016/j.aquaculture.2018.10.031.
12. Zohar Y., Mylonas C. C. Endocrine manipulations of spawning in cultured fish: From hormones to genes // Aquaculture. 2001. V. 197 (1–4). P. 99–136. https://doi.org/10.1016/s0044-8486(01)00584-1.
13. Mylonas C. C., Bridges C., Gordin H., Ríos A. B., García A., de la Gándara F., Fauvel C., Suquet M., Medina A., Papadaki M., Heinisch G., de Metrio G., Corriero A., Vassallo-Agius R., Guzmán J. M., Mañanos E., Zohar Y. Preparation and administration of gonadotropin-releasing hormone agonist (GnRHa) implants for the artificial control of reproductive maturation in captive-reared atlantic bluefin tuna (Thunnus thynnus thynnus) // Reviews in Fisheries Science. 2007. V. 15 (3). P. 183–210. https://doi.org/10.1080/10641260701484572.
14. Fakriadis I., Zanatta E. M., Fleck R. P. D. S., Sena Mateo D. L., Papadaki M., Mylonas C. C. Endocrine regulation of long-term enhancement of spermiation in meagre (Argyrosomus regius) with GnRHa controlled-delivery systems // General and Comparative Endocrinology. 2020. V. 297. P. 113549. https://doi. org/10.1016/j.ygcen.2020.113549.
15. Mosha S. S. Recent comparative studies on the performance and survival rate of African catfish (Clarias gariepinus) larval produced under natural and synthetics hormones: A review // Journal of Aquaculture Research and Development. 2018. V. 9 (3). P. 1000528. https://doi. org/10.4172/2155-9546.1000528.
16. Ochokwu I. J., Apollos T. G., Oshoke J. O. Effect of egg and sperm quality in successful fish breeding // IOSR Journal of Agriculture and Veterinary Science. 2015. V. 8 (8). P. 48–57.
17. Taranger G. L., Carrillo M., Schulz R. W., Fontaine P., Zanuy S., Felip A., Hansen T. Control of puberty in farmed fish // General and Comparative Endocrinology. 2010. V. 165. P. 483–515.
18. Kutwal B. Y., Wokton W. J., Vou A. K., Sambo A. B., Okunsebor S. A. Manipulation of synthetic hormones in induced breeding of catfish Clarias gariepinus (Burchell, 1822) // International Journal of Multidisciplinary Research and Development. 2017. V. 4 (10). P. 1–5.
19. Dunham R. A., Lambert D. M., Argue B. J., Ligeon C., Yant D. R., Liu Z. Comparison of manual stripping and pen spawning for production of Channel catfish × Blue catfish hybrids and aquarium spawning of Channel catfish // North American Journal of Aquaculture. 2000. V. 62 (4). P. 260–265. https://doi.org/10.1577/1548-8454(2000)062%3C0260:COMSAP%3E2.0. CO;2.
20. Bubunec E. V., Revyakin A. O., Labenec A. V. An Innovative Model of Combined Stimulation of Ovulation in Sturgeons and the Cytometric Features of the Produced Oocytes // Biomedicina. 2014. N. 4. P. 65–69.
21. Sariev B. T., Tumenov A. N., Bakiyev S. S. The Influence of a Combination of Various Technological Factors on the Efficiency of Maturation and Production of Intravital Caviar // International Research Journal. 2019. N. 10-1 (88). P. 95–98.
22. Kahkesh F. B., Feshalami M. Y., Amiri F., Nickpey M. Effect of ovaprim, ovatide, HCG, LHRH-A2, LHRHA2 + + CPE and carp pituitary in benni (Barbus sharpeyi) artificial breeding // Global Veterinaria. 2010. V. 5 (4). P. 209–214.
23. Туменов А., Джунусов А. М., Бакиев С. С. Результаты комбинированного применения различных схем стимулирования овуляции икры у производителей стерляди в условиях регулируемых систем // Природные системы и ресурсы. 2020. Т. 10 (2). С. 51–55.






















