Санкт-Петербург, г. Санкт-Петербург и Ленинградская область, Россия
Казахстан
Россия
Россия
Россия
Цель работы – оценка биологических характеристик основных популяций промысловых рыб Малого Аральского моря в 2022 г. и изменений, которые произошли в них за период с 2013 г. Рыб для исследо-вания отлавливали по всему Малому Аралу в шести промысловых районах. По итогам 2022 г. в ихтиофауне насчитывалось 15 промысловых видов, из которых лещ, судак, плотва и сазан были наиболее многочисленными. На долю остальных рыб в исследовательских уловах приходилось от 0,5 до 5 %. В сравнении с 2013 г. видовой состав промысловой части ихтиофауны почти не изменился. Средние размеры большинства видов рыб за период 2013–2022 гг. также практически не изменились, отмечается только незначительное измельчание леща и плотвы. Возрастной состав некоторых рыб заметно изменился. Промысловая популяция сазана, толстолобика, сома и змееголова в 2022 г. представлена более возрастными особями, чем в 2013 г. В популяциях чехони и плотвы, наоборот, преобладают более молодые рыбы. Были исследованы соотношения полов у рыб в зависимости от изменения солености воды в Малом Арале. В результате были получены достоверные положительные корреляции для леща, белого толстолобика, белого амура и судака. Для красноперки, наоборот, была получена достоверная отрицательная корреляция.
Малое Аральское море, промысловые рыбы, видовой состав, рост, соотношение полов, промысловое значение
Введение
Аральское море в недавнем прошлом было большим континентальным водоемом – 66 000 км2 в 1960 г. Оно имело обедненную, по сравнению с другими крупными бассейнами Понто-Арало-Каспийской зоогеографической провинции, фауну свободноживущих беспозвоночных и рыб. Всего в XX в. в Арале обитали 20 аборигенных видов рыб, из которых 12 видов относились к карповым. В результате плановых и случайных вселений в Аральское море список рыб пополнился еще 17 видами [1]. С 1961 г. началась регрессия Арала, причиной которой было изменение баланса прихода и расхода воды в водоеме, вызванное изъятием воды на орошение. Падение уровня сопровождалась увеличением солености моря, которое сначала привело к заметному снижению выживаемости личинок и молоди пресноводных рыб, а впоследствии и к вымиранию взрослых рыб. Когда в 1988–1989 гг. прежде единый Арал распался на Большой и Малый, в его ихтиофауне оставалось 7 видов, и 6 из их числа были вселенцами [2]. Насыпанная в 1992 г. земляная дамба в проливе Берга остановила дальнейшее падение уровня Малого Арала и рост его солености [3]. Из-за того, что эта дамба была без устройства для сброса излишков воды, то, когда весной сток р. Сырдарьи увеличивался, она прорывалась, и каждый раз дамбу восстанавливали [2]. Уровень Малого в целом стабилизировался, а соленость продолжала постепенно снижаться. Малый Арал к началу 2000 г. «созрел» для возвращения пресноводных рыб, блестяще подтвердив гипотезу Г. В. Никольского [4] о том, что ихтиофауна Арала возникла из фауны впадающих
в море рек.
В настоящее время благодаря построенной в 2004–2005 гг. в проливе Берга надежной Кокаральской плотине с водосбросом и увеличению в отдельные годы стока р. Сырдарьи уровень Малого Аральского моря достиг отметки 42,5 м, и площадь его составляет около 330 000 га. Результаты повышения уровня Малого Арала и снижения его солености стали заметны уже в 2005–2006 гг. Ускорилось возвращение пресноводных рыб в Малый Арал, и в нем постепенно сформировались их постоянные популяции. К настоящему времени Малое Аральское море после десятилетий рукотворного кризиса вернуло свое значение для рыбного хозяйства. В настоящее время Малое Аральское море, наряду с Каспийским морем и оз. Балхаш, имеет большое значение для рыбного хозяйства Республики Казахстан. Официальные выловы на этом водоеме достигают 7 тыс. т в год и могли бы быть больше на несколько тысяч тонн, если бы не гибель большого количества рыбы, уносимой с водой при ее сливе весной через водосброс Кокаральской плотины. По имеющимся сведениям, браконьерство на Малом Арале также наносит значительный урон [2, 5]. Если считать, что общий вылов рыбы на внутренних водоемах Казахстана не превышает 40–45 тыс. т в год [6], то на долю Малого Арала ежегодно приходится 15–20 % общей добычи рыбы в Казахстане. Возобновление рыбного промысла на Малом Арале потребовало постоянного отслеживания состояния промысловых популяций основных видов рыб и исследования условий их обитания. Изучение гидролого-гидрохимического режима необходимо из-за того, что состояние ихтиофауны Малого Аральского моря во многом зависит от объема стока р. Сырдарьи. Сток р. Сырдарьи и уровень Малого моря влияют на концентрацию промысловых популяций рыб по рыбопромысловым районам. В маловодные годы на зиму рыба концентрируется в устьевом районе, а в многоводье в центре моря. По результатам зимнего подледного лова максимальная концентрация промысловых популяций была обнаружена в восточной части водоема напротив поселка Тастубек, а также в заливах Бутакова и Шевченко. Подъем уровня в весенний период приводит к расширению акваторий рыбопромысловых участков и к распространению рыб по всему Малому Аралу. Регулярный исследовательский лов, проводимый Казахским научно-исследовательским институтом рыбного хозяйства (КазНИИРХ), возобновился на Малом Аральском море в самом начале 2000 г. Большинство пресноводных видов рыб вновь образовали в водоеме популяции к началу 2010 г. Мы имеем возможность сравнить полученные нами данные по состоянию промысловых популяций рыб Малого Арала 2022 г. с данными, полученными КазНИИРХ в 2013 г. Целью настоящего исследования было оценить биологические характеристики популяций основных промысловых рыб Малого Арала и выявить изменения, которые произошли за время, прошедшее с 2013 г.
Материал и методика
Материал для исследования собирали в апреле 2022 г. на всей акватории Малого Аральского моря. По своей гидрографии, распределению минерализации воды и биотопов оно подразделяется на следующие 6 промысловых районов: залив Шевченко; центральный район, глубоководная часть; обособленный неглубокий залив Бутакова с повышенной соленостью; восточная часть; опресняемый стоком р. Сырдарьи приустьевой район; залив Сарышыганак (рис. 1).
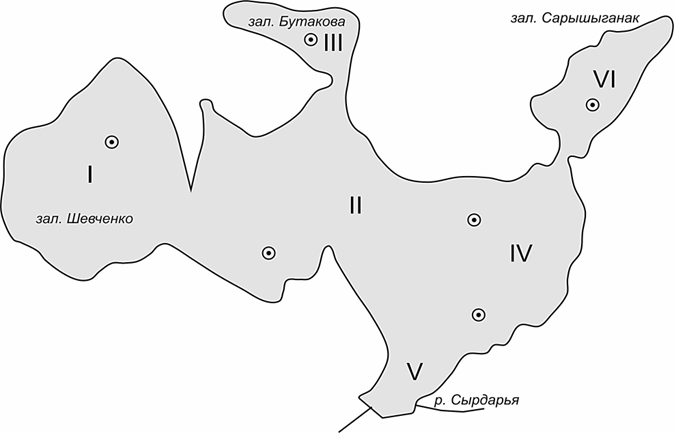
Рис. 1. Рыбопромысловые районы Малого Аральского моря:
I – залив Шевченко; II – центральный район, глубоководная часть;
III – обособленный неглубокий залив Бутакова с повышенной соленостью; IV – восточная часть;
V – опресняемый стоком р. Сырдарьи приустьевой район; VI – залив Сарышыганак
Fig. 1. Fishing areas of the Small Aral Sea:
I – Shevchenko Bay; II – the central area, the deep–water part;
III – the isolated shallow Butakov Bay with increased salinity; IV – the eastern part;
V – the estuary area desalinated by the runoff of the Syrdarya River; VI – Saryshyganak Bay
Рыб ловили ставными сетями с размером ячеи 30–65, 70–90 мм. Длину рыб, мм, измеряли мерной доской, а массу, г, – бытовыми весами (до 20 кг). Половозрелыми считались рыбы, чьи гонады находились на III–IV стадиях зрелости. Возраст почти всех видов рыб определялся по чешуе и только у камбалы-глоссы по отолитам.
Для анализа полового состава популяции был использован критерий χ2. Вычисляли также линейную регрессию между соленостью воды Малого Аральского моря и соотношением самцов и самок в популяциях промысловых видов. Для оценки качества регрессионных моделей был использован F-критерий Фишера.
Общий объем исследованного материала в 2022 г. составил 1 368 экземпляров. Для сравнения также были использованы данные 2013 г. и данные из статьи [7].
Соленость воды Малого Арала определяли в лаборатории титрованием по хлору с дальнейшим пересчетом согласно формулам [8]. Результаты измерений солености за 2002–2013 гг. и 2022 гг. приведены на рис. 2.
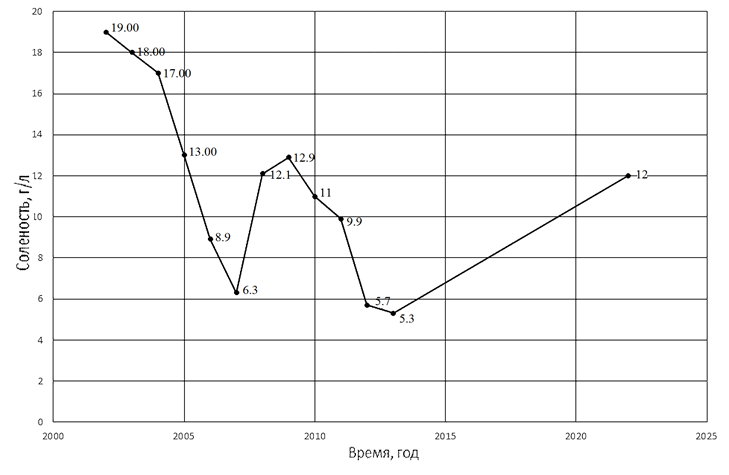
Рис. 2. Соленость Малого Аральского моря
Fig. 2. Salinity of the Small Aral Sea
Результаты
Нам доступны данные научно-исследовательских уловов за 2013, 2020 [6] и 2022 гг. Во всех уловах доминировали лещ и аральская плотва, в разные годы субдоминантами были красноперка и жерех (в 2013 г.), судак (в 2013 и 2022 гг.), сазан (в 2002 г.) (табл. 1).
Таблица 1
Table 1
Доли промысловых рыб Малого Арала в сетных уловах в 2013, 2020 и 2022 гг.
Portions of commercial fish of the Small Aral in net catches in 2013, 2020 and 2022
|
Вид |
2013 г. |
2020 г. |
2022 г. |
|||
|
Количество, экз. |
Доля, % |
Количество, экз. |
Доля, % |
Количество, экз. |
Доля, % |
|
|
Лещ |
522 |
26,84* |
523 |
16,44 |
462 |
33,77 |
|
Жерех |
169 |
8,69 |
28 |
0,88 |
26 |
1,9 |
|
Белый амур |
32 |
1,65 |
– |
– |
36 |
2,63 |
|
Сазан |
77 |
3,96 |
13 |
0,41 |
159 |
11,62 |
|
Белый толстолобик |
30 |
1,54 |
– |
– |
33 |
2,41 |
|
Чехонь |
56 |
2,88 |
232 |
7,29 |
27 |
1,97 |
|
Плотва |
444 |
22,83 |
845 |
26,56 |
135 |
9,87 |
|
Красноперка |
220 |
11,31 |
69 |
2,17 |
6 |
0,44 |
|
Сом |
20 |
1,03 |
– |
– |
25 |
1,83 |
|
Судак |
192 |
9,87 |
93 |
2,92 |
268 |
19,59 |
|
Серебряный карась |
– |
– |
– |
– |
71 |
5,19 |
|
Шемая |
5 |
0,37 |
||||
|
Змееголов |
30 |
1,54 |
18 |
1,31 |
||
|
Камбала-глосса |
104 |
5,35 |
41 |
3,0 |
||
|
Щука |
49 |
2,52 |
69 |
2,17 |
56 |
4,1 |
* Жирным шрифтом выделены доминировавшие в уловах виды.
Cyprinus carpio Linnaeus, 1758 – сазан. На Малом Аральском море сазан входит в число важнейших промысловых рыб. В 2022 г. длина сазана из научно-исследовательских уловов была в пределах 170–500 мм, в среднем составляя 345 мм, масса тела – от 117 до 3 150 г, в среднем 1 615 г. Возрастную структуру составляли поколения от 2+ до 8+, при преобладании 6-леток (рис. 3).
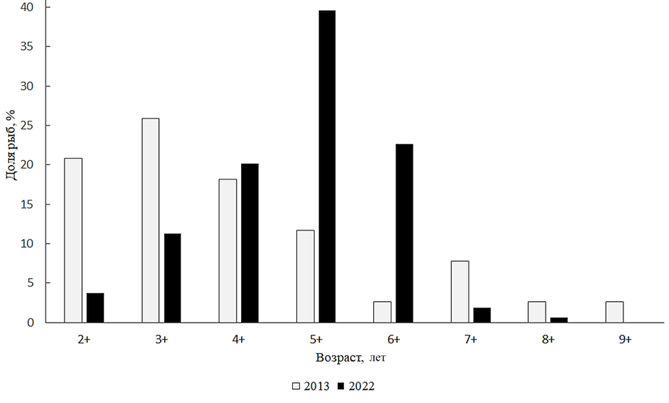
Рис. 3. Возрастной состав сазана
Fig. 3. Age composition of carp
Анализируя размерно-весовой состав сазана, необходимо отметить, что в промысловом стаде доминировали особи размером от 351 до 400 мм и массой 1 001–1 200 г. Соотношение полов сазана показало, что в 2022 г. в стаде незначительно доминировали самцы (1,11 : 1). По сравнению с 2013 г. заметно увеличилась доля рыб старших возрастов, 6–7-леток (см. рис. 3).
Abramis brama (Linnaeus, 1758) – лещ. Длина тела пойманных сетью лещей была 140–340 мм при среднем ее значении 245 мм. Их масса находилась в пределах 86–1 095 г при средней величине 524 г. По возрасту лещи из данных научно-исследовательских уловов принадлежали к 7 генерациям – от 2+ до 8+ при доминировании (30 %) семилеток. Анализ размерно-весовой структуры леща Малого Аральского моря за 2022 г. показал, что в стаде преобладают особи размером от 226 до 250 мм и массой 301–350 г. Анализируя соотношение полов леща, необходимо отметить преобладание в стаде самцов (1,78 : 1). По сравнению с 2013 г. незначительно увеличилась доля 6–7-леток (рис. 4).
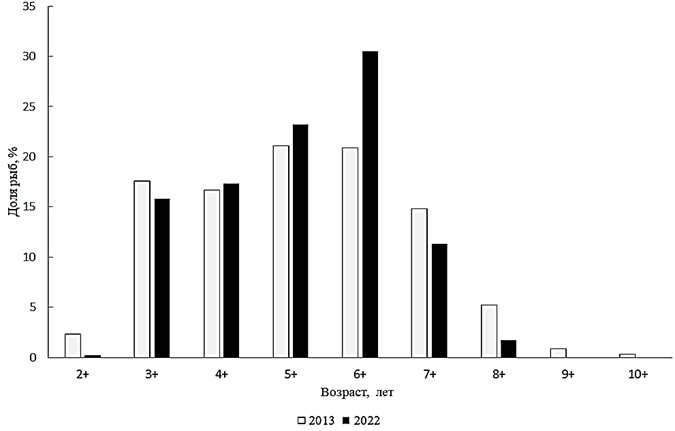
Рис. 4. Возрастной состав леща
Fig. 4. Age composition of bream
Leuciscus aspius (Linnaeus, 1758) – жерех.
В 2001–2004 гг. распространение жереха в Малом Аральском море было ограничено опресненным районом у устья Сырдарьи. Но уже в 2005 г. он расселился по всему водоему, кроме имеющего более высокую соленость зал. Бутакова. В 2008 г. жерех появился и в этом заливе [9]. В 2022 г. длина жереха из научно-исследовательских уловов была
в пределах 250–510 мм, в среднем составляя 364 мм, масса тела – от 262 до 1 880 г, в среднем 764 г. Возрастную структуру составляли поколения от 2+ до 7+, из которых преобладали 4-летки (рис. 5).
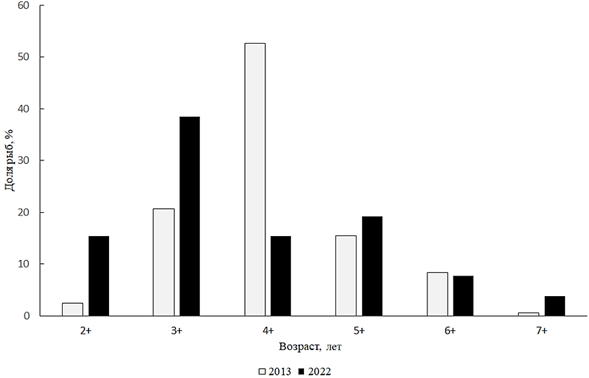
Рис. 5. Возрастной состав жереха
Fig. 5. Age composition of asp
Анализ размерно-весового состава жереха за 2022 г. показал, что в промысловом стаде доминировали особи размером от 301 до 350 мм и массой 401–600 г. Анализ соотношения полов жереха за 2022 г. показал, что в стаде резко преобладали самки (7,67 : 1). По сравнению с 2013 г. произошло заметное смещение возрастной структуры популяции в пользу младших возрастов.
Hypophthalmichthys molitrix (Valenciennes, 1844) – белый толстолобик. Белый толстолобик населяет приустьевую зону Малого Арала. К настоящему времени его численность увеличилась, и он присутствует в промысловых уловах. В 2022 г. длина белого толстолобика из научно-исследовательских уловов находилась в пределах 320–780 мм, в среднем
573 мм, масса тела – от 670 до 9 545 г, в среднем
3 960 г. Возрастную структуру составляли поколения от 1+ до 6+, из которых преобладали 4- и 5-летки (рис. 6).

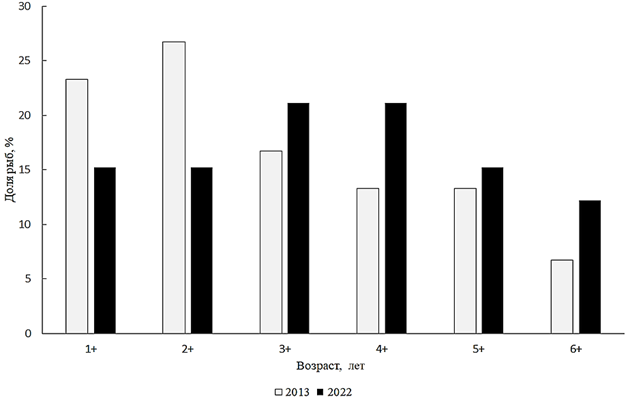
Рис. 6. Возрастной состав белого толстолобика
Fig. 6. Age composition of grass carp
За срок, прошедший с 2013 г., возрастная структура популяции заметно изменилась: ранее преобладали рыбы в возрасте 1+ и 2+. Анализ размерно-весовой структуры белого толстолобика за 2022 г. показал, что в стаде преобладали особи размером 601–650 мм и массой 4 001–5 000 г. Анализируя соотношение полов белого толстолобика за 2022 г., необходимо отметить, что в промысловом стаде резко преобладали самки, соотношение самцов и самок 1 : 2.
Ctenopharyngodon idella (Valenciennes, 1844) – белый амур. Численность белого амура в Малом Аральском море к настоящему времени возросла до промысловой. В 2022 г. длина белого амура из научно-исследовательских уловов находилась в пре-
делах 250–690 мм, в среднем 502 мм. Масса тела была от 790 до 7 190 г, в среднем 3 305 г. Возрастную структуру составляли поколения от 2+ до 7+, из которых преобладали 6- и 7-летки (рис. 7).
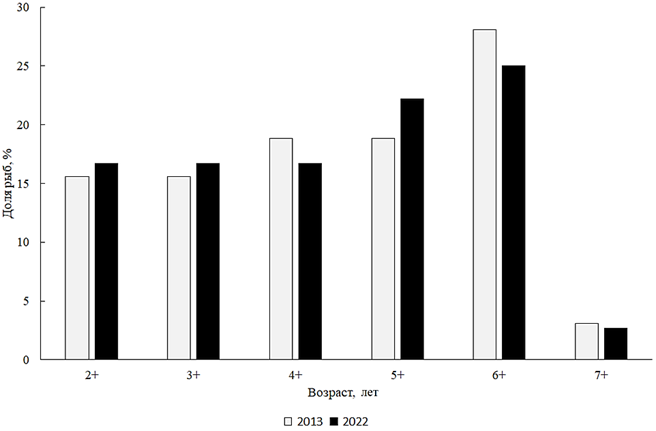
Рис. 7. Возрастной состав белого амура
Fig. 7. Age composition of silver carp
Анализ размерно-весового состава белого амура за 2022 г. показал, что в популяции доминировали особи размером 401–500 мм и массой 3 501–4 000 г. Следует отметить, что по сравнению с 2013 г. возрастной состав практически не изменился (см. рис. 7). Анализируя соотношение полов белого амура за 2022 г., необходимо отметить, что в стаде резко преобладали самки, соотношение самцов и самок 0,57 : 1.
Carassius gibelio (Bloch, 1782) – серебряный карась. По-видимому, этот вид только недавно вернулся в Малый Арал – в уловах 2013 г. он не встречался. В 2022 г. длина карася из научно-исследовательских уловов находилась в пределах 150–270 мм, в среднем 243,5 мм. Масса тела была от 75 до 708 г, в среднем 415 г. Возрастную структуру карася составляли поколения от 3+ до 8+, из которых преобладали 6- и 7-летки (рис. 8).
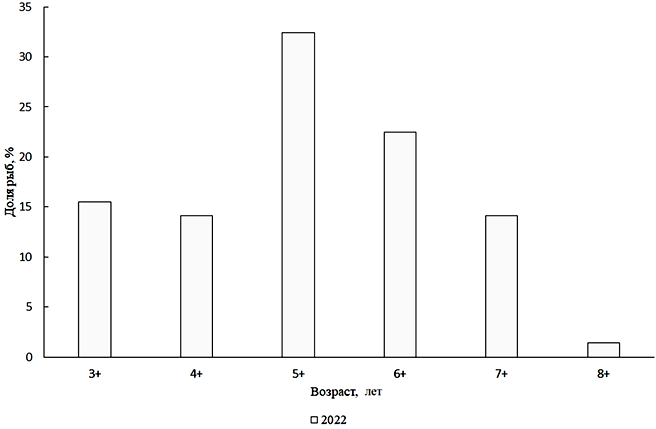
Рис. 8. Возрастной состав серебряного карася
Fig. 8. Age composition of crucian carp
Анализ размерно-весового состава серебряного карася за 2022 г. показал, что в популяции преобладали особи размером 226–250 мм и массой 401–450 г. Анализируя соотношение полов серебряного карася за 2022 г., необходимо отметить, что в промысловом стаде резко доминировали самки, соотношение самцов и самок 0,15 : 1.
Pelecus cultratus (Linnaeus, 1758) – чехонь. В Малом Аральском море в 2022 г. чехонь из научно-исследовательских уловов имела длину в пределах 250–300 мм, в среднем 275 мм. Масса была от 135 до 330 г, в среднем 286 г. Возрастную структуру составляли поколения от 3+ до 5+, из которых преобладали 5-летки. Ранее преобладали рыбы в возрасте 5+ (рис. 9).
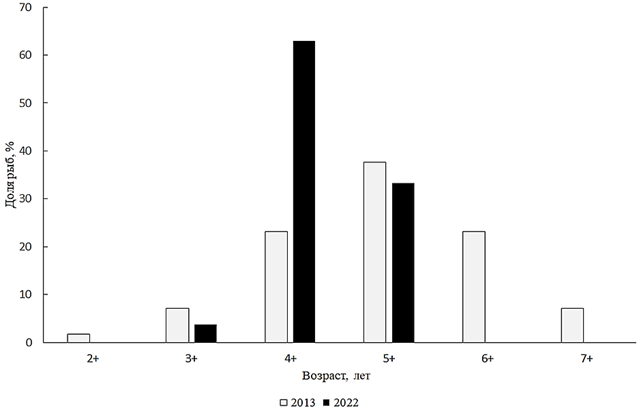
Рис. 9. Возрастной состав чехони
Fig. 9. Age composition of sabrefish
Анализируя размерно-весовой состав чехони, необходимо отметить, что в промысловом стаде доминировали особи размером 251–300 мм и массой 251–300 г. Анализ соотношения полов чехони показал, что в 2022 г. в стаде доминировали самцы (1,7 : 1).
Rutilus rutilus (Linnaeus, 1758) – плотва.
К настоящему времени вернувшаяся в Малое Аральское море плотва распространилась по всему водоему, включая зал. Бутакова, а в районе устья Сырдарьи она стала самым многочисленным видом [5].
В 2022 г. длина плотвы из научно-исследовательских уловов находилась в пределах 110–240 мм, в среднем 171 мм. Масса плотвы была от 46 до 267 г, в среднем 138 г. Возрастную структуру плотвы составляли поколения от 2+ до 7+, из которых преобладали 4- и 5-летки (рис. 10).
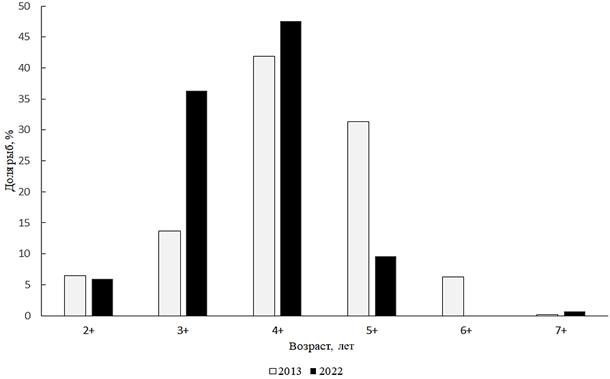
Рис. 10. Возрастной состав плотвы
Fig. 10. Age composition of roach
Ранее, в 2013 г., тоже доминировали рыбы этих возрастов. Анализ размерно-весового состава плотвы за 2022 г. показал, что в популяции преобладали особи размером 151–175 мм и весом 101–150 г. Анализируя соотношение полов плотвы за 2022 г., необходимо отметить, что в промысловом стаде резко преобладали самки, соотношение самцов
и самок составило 0,59 : 1.
Scardinius erythrophthalmus (Linnaeus, 1758) – красноперка. В 2022 г. (поймано только 6 экземпляров) длина красноперки из экспериментальных уловов варьировала от 180 до 200 мм, в среднем составляя 183,3 мм, а масса от 165 до 245 г, в среднем 227 г. Красноперка была представлена 4-летками и 5-летками, преобладали особи возраста 4+. Анализируя размерно-весовой состав красноперки, необходимо отметить, что промысловое стадо представлено особями размером 176–200 мм и весом 151–250 г. Анализ соотношения полов красноперки показал, что в 2022 г. в стаде доминировали самки, отношение самцов к самкам было 1 : 2.
Chalcalburnus chalcoides (Güldenstädt, 1772) – аральская шемая. В настоящее время шемая в Малом Аральском море встречается редко. После выпадения в конце XX в. ее популяция до конца не восстановилась. Всего было поймано только 5 экземпляров этого вида. В уловах в 2022 г. длина шемаи колебалась от 200 до 240 мм, в среднем
216 мм, а масса тела от 112 до 245 г при среднем ее значении 157 г. Шемая была представлена только двумя возрастами при доминировании 6-леток. Анализируя размерно-весовой состав шемаи, необходимо отметить, что в промысловом стаде доминировали особи размером 126–150 мм и массой 101–150 г. Формальный анализ соотношения полов шемаи показал, что в 2022 г. в стаде резко преобладали самки, соотношение самцов и самок 0,2 : 1.
Silurus glanis (Linnaeus, 1758) – сом. К настоящему времени, с увеличением своей численности, сом в Малом Аральском море стал объектом промысла. В 2022 г. сом в научно-исследовательских уловах имел длину от 400 до 1 050 мм, в среднем 733 мм. Масса тела сома была от 741 до 9 360 г, в среднем 4 665 г. Сом был представлен пятью возрастами – от 3+ до 7+. Явного доминирования какого-либо возраста в 2022 г. не было, тогда как ранее заметно преобладали особи возраста 7+ (рис. 11).
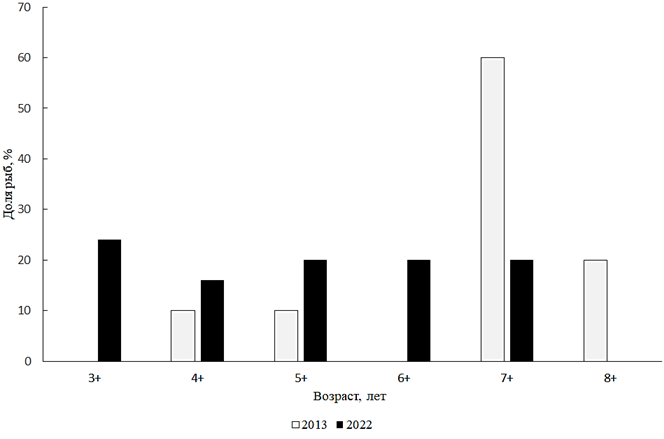
Рис. 11. Возрастной состав сома
Fig. 11. Age composition of wels
Анализ размерно-весового состава сома за 2022 г. показал, что в популяции преобладали особи размером 801–900 мм и весом 6 001–8 000 г. Следует отметить, что в 2022 г. в промысловом стаде доминировали самки, соотношение полов сома 0,47 : 1.
Esox lucius Linnaeus, 1758 – щука. В уловах 2022 г. длина тела щуки Малого Аральского моря составляла от 240 до 650 мм, в среднем 431 мм, масса тела была от 143 до 1 740 г, в среднем 744 г. Возрастная структура рыб из научно-исследовательских уловов представлена поколениями от 2+ до 7+, из которых преобладали 6-летки. Ранее, в 2013 г., явно доминировали 7-летки (рис. 12).
Как показал анализ размерно-весового состава щуки в 2022 г., в промысловом стаде доминируют особи с длиной тела 401–450 мм и с массой 601–800 г. Анализ соотношения полов щуки показал, что в промысловом стаде в 2022 г. преобладали самки (0,7 : 1).

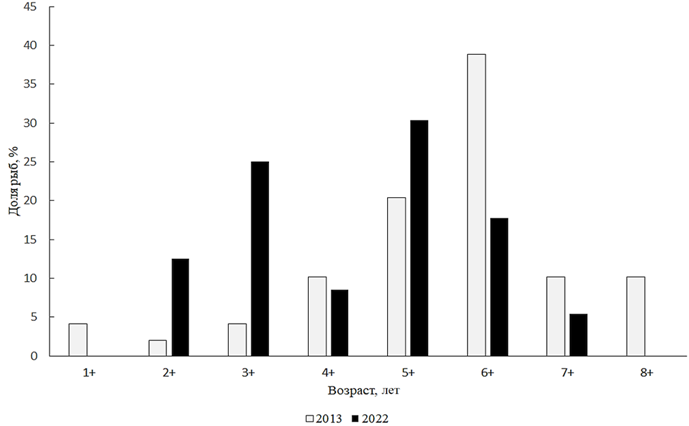
Рис. 12. Возрастной состав щуки
Fig. 12. Age composition of pike
Stizostedion lucioperca (Linnaeus, 1758) – судак. Судак в 2001–2003 гг. населял только опресненный район у устья Сырдарьи. В 2004 г. он появился на востоке и северо-востоке, а в 2005 г. расселился уже по всему Малому Аральскому морю кроме зал. Бутакова. В настоящее время судак обитает и в этом заливе [5, 10]. Длина тела судаков из научно-исследовательских уловов 2013 г. была от 21,0 до 62 см, при средних длине и массе тела 38,5 см и 787 г соответственно. В 2013 г. судак был представлен семью возрастами, от 1+ до 7+, из которых преобладали 5–6-летки (66,6 %). В настоящее время доминируют особи в возрасте 3+ и 4+ (рис. 13).
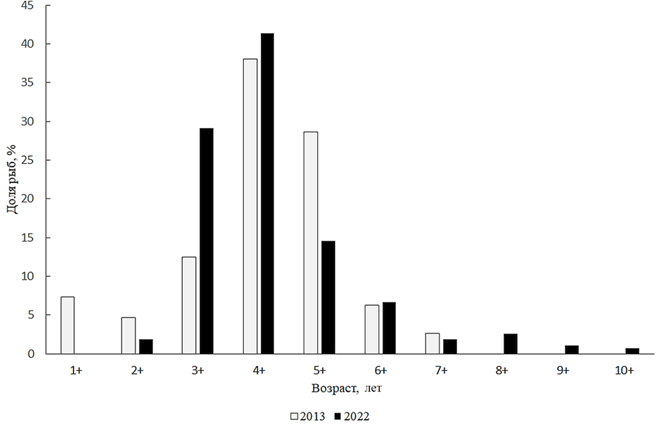
Рис. 13. Возрастной состав судака
Fig. 13. Age composition of zander
Анализ соотношения полов судака показал, что в промысловом стаде в 2022 г. незначительно преобладали самцы, соотношение полов 1,1 : 1.
Channa argus (Cantor, 1842) – змееголов.
К настоящему времени численность змееголова в Малом Аральском море достигла промысловой величины, но его распространение ограничено опресненным приустьевым районом. В опытных уловах длина рыб была от 30,0 до 64,0 см при среднем значении 42,7 см. К 2022 г. возрастная структура популяции змееголова сместилась в сторону преобладания старших возрастов (рис. 14).
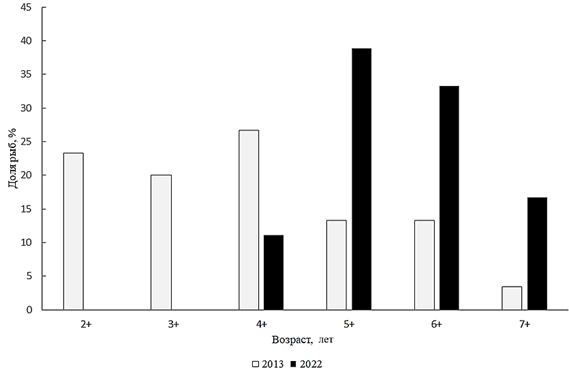
Рис. 14. Возрастной состав змееголова
Fig. 14. Age composition of snakehead
Platichthys flesus (Linnaeus, 1758) – камбала-глосса. Если в 2000 г. камбала нерестилась почти по всей акватории Малого Аральского моря, то
в 2004–2005 гг., со снижением солености его восточной и северно-восточной частей, нерест имел место только на западе, юго-западе и северо-востоке залива Шевченко и по всему заливу Бутакова [5]. В 2022 г. длина тела камбал из научно-исследовательских уловов варьировала от 170 до 300 мм и была в среднем 223 мм, масса тела составляла 80–410 г при среднем значении 180 г. Камбала-глосса в этих уловах была представлена особями пяти возрастов, от 3+ до 7+ (рис. 15).
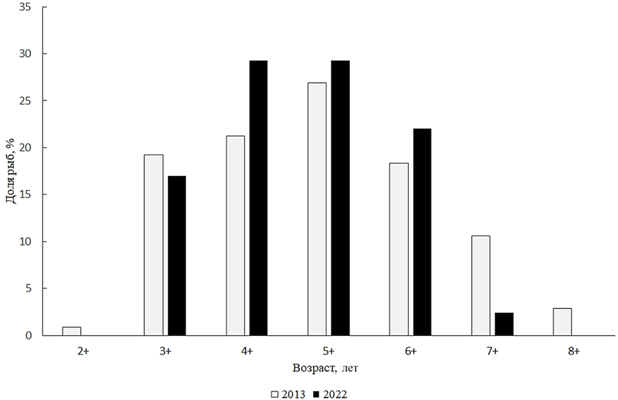
Рис. 15. Возрастной состав камбалы-глоссы
Fig. 15. Age composition of flounder
Преобладали 5- и 6-летки (в сумме 58,6 %). Камбалы в возрасте 7+ являются редкими (пойман 1 экземпляр). В 2022 г. отмечено двукратное доминирование самок над самцами. В уловах 2013 г. камбала-глосса была представлена особями, длина тела которых колебалась в пределах 18,0–30,0 см. Средняя длина тела камбалы была 22,8 см. Таким образом, последние 10 лет состояние популяции камбалы-глоссы остается стабильным.
Обсуждение
По сравнению с 2013 г. видовой состав промысловых рыб Малого Арала почти не изменился. Исключением являются два вида: серебряный карась и шемая. В 2002–2013 гг. они в уловах не встречались, поэтому будет логичным предположить, что их вселение в водоем произошло после 2013 г. на фоне падения солености моря.
Как уже указывалось выше, доминантами как научно-исследовательских, так и рыбопромысловых уловов являются лещ и плотва. Во все годы они составляют большой процент от улова (см. табл. 1). В 2002 г. научно-исследовательские уловы проводились в апреле, во время нереста многих рыб Малого Арала. Неожиданно большой процент в уловах судака, по-видимому, объясняется тем, что во время нереста судак подходит к берегам водоема, где в основном и проводились уловы, в то время как после нереста этот вид обычно держится в глубоких частях озера.
Средние размеры большинства видов рыб за период 2013–2022 гг. практически не изменились. Можно отметить только незначительное измельчание леща и плотвы, которые являются основными объектами промысла в Малом Аральском море (табл. 2).
Таблица 2
Table 2
Размерные характеристики и их варьирование у промысловых рыб Малого Арала
в сетных уловах в 2013 и 2022 гг.
Size characteristics and their variation in commercial fish of the Small Aral
in net catches in 2013 and 2022
|
Вид |
Средний размер, см |
|
|
2013 г. |
2022 г. |
|
|
Лещ |
27,9 (13–42) |
24,5 (14–34) |
|
Жерех |
40,4 (30–53) |
36,4 (25–51) |
|
Белый амур |
51,9 (29–70) |
50,2 (25–69) |
|
Сазан |
32,0 (18–56) |
34,5 (17–50) |
|
Белый толстолобик |
51,7 (30–76) |
57,3 (32–78) |
|
Чехонь |
31,3 (26–36) |
27,5 (25–30) |
|
Плотва |
21,0 (14–29) |
17,1 (11–24) |
|
Красноперка |
21,0 (13–27) |
18,3 (18–20) |
|
Сом |
80,9 (60–92) |
73,3 (40–105) |
|
Судак |
38,5 (21–62) |
35,1 (19–75) |
|
Серебряный карась |
– |
24,4 (15–27) |
|
Шемая |
21,6 (20–24) |
|
|
Змееголов |
42,7 (30–64) |
54,8 (45–63) |
|
Камбала-глосса |
22,8 (18–30) |
22,3 (17–30) |
|
Щука |
44,2 (25–65) |
43,1 (24–65) |
Возрастной состав некоторых рыб заметно изменился. Промысловая популяция сазана, толстолобика, сома и змееголова в 2022 г. представлена более возрастными особями, чем в 2013 г. В популяциях чехони и плотвы, наоборот, преобладают более молодые рыбы. Возрастной состав популяций остальных видов рыб не претерпел заметных изменений.
Изменение соотношения полов у рыб – тема многочисленных исследований. Причины отклонения от соотношения полов 1 : 1 могут быть различны. Это может быть из-за различной смертности самцов и самок, конкуренции самок за самцов, эндокринных нарушений в результате загрязнения среды, различной экологической роли самцов и самок, влияния абиотических факторов среды и многого другого.
У многих животных, в том числе и рыб, выбор пола регулируется как генетической программой, так и влиянием природных факторов. В настоящее время популярна гипотеза о том, что стрессовые условия влияют на уровень кортизола у рыб, который, в свою очередь, влияет на пол, отдавая предпочтение маскулинизации [11]. Как показали в [11] авторы, это, по-видимому, верно в отношении воздействия температуры. Имеются свидетельства о том, что у большей части исследованных видов рыб на соотношение полов влияет температура воды, но не влияет соленость окружающей среды. Это было показано для атлантической атерины Menidia menidia (Linnaeus) [12], для розового барбуса Pethia conchonius (Hamilton) и карликового гурами Trichopsis pumila (Arnold) [13], для нильской тиляпии Oreochromis niloticus (Linnaeus) [14] и для американского речного угря Anguilla rostrata (Lesueur), для которого существуют эмпирические [15] и экспериментально подтвержденные [16] данные, что соленость не влияет на пол. Вместе с тем имеются экспериментальные данные о том, что у пецилии парусной Poecilia velifera (Regan) соленость повлияла на соотношение полов: процентное соотношение самцов и самок было 32,5 и 67,5 %, 27,5 и 72,5 % при солености 24 и 36 г/л соответственно [17].
Популяции серебряного карася в прибрежных к Балтийскому морю озерах Эстонии состоят почти из одних самок. Если самцы и встречаются, то в очень небольшом количестве. Напротив, в водах Балтийского моря популяция этого вида имела почти одинаковое соотношение самцов и самок [18].
Известно, что осморегуляторный стресс также вызывает повышение уровня кортизола у ряда видов рыб. Многочисленными работами было показано, что кортизол является гормоном, позволяющим рыбам адаптироваться к морской воде у большого числа видов костистых рыб. Кортизол, как правило, больше всего участвует в первичной реакции на стресс, которая связана с первоначальной адаптацией к новой солености окружающей среды. Кроме того, есть сведения, что кортизол также участвует в поглощении ионов из воды [14, 19]. Важным вопросом является то, какое изменение солености для конкретного вида рыб будет являться стрессовым. Очевидно, что незначительные изменения солености среды не будут вызывать повышенную секрецию кортизола. Однако существование в условиях, близких к границе выживаемости, должны быть стрессовыми. Современная соленость Малого Арала около 12 г/л (см. рис. 2). Эта величина близка к критической. Когда в первой половине 1970-х гг. соленость единого тогда Арала превысила 12–14 г/л, выживаемость личинок и молоди пресноводных рыб стала резко снижаться [2, 5]. Нас заинтересовал вопрос, как связаны соотношение полов и соленость водоема.
После повторного вселения рыб в Малое море в 2002–2013 гг. практически для всех рыб (кроме белоглазки) было характерно значительное отклонение соотношения полов в пользу самок (табл. 3: I – соотношение полов (самцы : самки); II – коэффициент корреляции соотношения полов с соленостью воды; χ2 – достоверность отличия от соотношения полов 1 : 1).
Таблица 3
Table 3
Соотношение полов рыб Малого Аральского моря из научно-исследовательских уловов
Sex ratio of fish in the Small Aral Sea from research catches
|
Период |
Характеристика |
Лещ |
Жерех |
Белый амур |
Сазан |
Белый |
Чехонь |
Плотва |
Красноперка |
|
2002–2013 |
I |
0,81** |
0,822** |
0,567** |
0,869** |
0,592* |
0,836* |
0,696*** |
0,675*** |
|
χ2 |
45,231 |
7,802 |
8,415 |
8,035 |
6,174 |
4,75 |
141,325 |
18,426 |
|
|
II |
0,62* |
0,29 |
0,67* |
–0,12 |
0,95* |
–0,03 |
0,42 |
–0,75* |
|
|
2022 |
I |
1,783*** |
0,130*** |
0,565 |
1,107 |
0,500 |
1,700 |
0,588** |
0,500 |
|
χ2 |
36,580 |
15,385 |
2,778 |
0,405 |
3,667 |
1,815 |
9,074 |
0,667 |
|
|
Период |
Характеристика |
Белоглазка |
Сом |
Судак |
Серебряный |
Шемая |
Змееголов |
Камбала-глосса |
Щука |
|
2002–2013 |
I |
0,79 |
0,586** |
0,756** |
– |
– |
0,567** |
0,417*** |
0,613** |
|
χ2 |
3,249 |
7,576 |
33,155 |
8,415 |
993,262 |
10,051 |
|||
|
II |
–0,16 |
0,18 |
0,61* |
–0,41 |
–0,34 |
–0,46 |
|||
|
2022 |
I |
– |
0,471 |
1,103 |
0,145*** |
0,250 |
0,500 |
0,640 |
0,697 |
|
χ2 |
3,240 |
0,638 |
39,563 |
1,800 |
2,000 |
1,976 |
1,786 |
* P < 0,05; ** p < 0,01; *** p < 0,001.
В 2022 г. нарушенное соотношение полов наблюдалось только у леща, жереха, плотвы и вселившегося в водоем после 2013 г. серебряного карася.
По нашему мнению, изменения солености воды также могут вызывать соответствующее изменение соотношения полов у рыб в Малом Арале. Чтобы проверить эту гипотезу, мы сосчитали коэффициент корреляции солености воды моря с соотношением полов у рыб за 2002–2013 гг. (или за меньший срок, прошедший с момента вселения вида в водоем) с соотношением полов. В результате были получены достоверные положительные корреляции для леща, белого толстолобика, белого амура и судака. Для красноперки, наоборот, была получена достоверная отрицательная корреляция (см. табл. 3). Положительные корреляции вполне согласуются с гипотезой об осморегуляторном стрессе, в то время как отрицательная корреляция, полученная для красноперки, – нет.
В целом можно констатировать, что популяции промысловых рыб Малого Аральского моря мало изменились за прошедшее десятилетие. По-видимому, период их адаптации после вселения в водоем закончился.
Заключение
Предположительно, к 2013 г. повторное естественное вселение рыб в водоем практически завершилось. За последующие 10 лет в распресненной воде Малого Арала появились только 2 вида: серебряный карась и шемая. Размерно-весовые характеристики рыб также практически не изменились. Можно только отметить некоторое измельчание леща и плотвы, вероятно, в результате интенсивного промысла.
Следует отметить, что возрастной состав некоторых видов заметно изменился. Изначально, сразу после вселения, у промысловых рыб резко преобладали самки. Через более чем два десятилетия адаптации популяций к новым условиям, прежде всего к новой минерализации среды, соотношение полов стало заметно выравниваться. Этот процесс еще продолжается, и на него может влиять временное увеличение солености моря в результате сброса в него недостаточного объема воды. Для обоих указанных случаев наблюдается тенденция к достаточно скорому окончанию процесса адаптации. Основной период акклиматизации рыб в Малом Аральском море, по-видимому, завершился.
1. Аладин Н. В., Плотников И. С., Смуров А. О., Гонтарь В. И. Роль чужеродных видов в экосистеме Аральского моря // Биологические инвазии в водных и наземных экосистемах. М.-СПб.: Изд-во КМК, 2004. С. 275–296.
2. Смуров А. О., Плотников И. С., Аладин Н. В. Рыбы современного Аральского моря // Вопр. рыболовства. 2024. Т. 25. № 2. С. 33–50.
3. Аладин Н. В. Плотина жизни или плотина длиною в жизнь. Часть первая. «Пролог» или Первая Пятилетка (1988–1992 гг.) // Астрахан. вестн. эколог. образования. 2012. № 3 (21). С. 206–216.
4. Никольский Г. В. Рыбы Аральского моря. М.: МОИП, 1940. 215 с.
5. Ермаханов З. К., Плотников И. С., Аладин Н. В. Оценка биологического состояния популяций основных промысловых видов рыб Малого Аральского моря // Тр. Зоолог. ин-та РАН. 2013. Т. 317. № S3. С. 105–112.
6. Исбеков К. Б. Устойчивое использование рыбных ресурсов и перспективы сохранения биологического разнообразия ихтиофауны в основных рыбохозяйственных водоемах Казахстана: автореф. дис. ... д-ра биол. наук. Новосибирск, 2020. 41 с.
7. Berdiakhmetkyzy S., Assylbekova S. Zh., Abdybekova А. M., Barakbaev Т. Т. Current state of populations of the main commercial fish species of the Small Aral Sea // Experimental Biology. 2021. N. 3 (88). Р. 119–129.
8. Гидрометеорология и гидрохимия морей СССР. Л.: Гидрометеоиздат, 1990. Т. 7. Аральское море. 196 с.
9. Ермаханов З. К. Современное состояние промысловой ихтиофауны Малого Аральского моря // Устойчивое развитие южного Приаралья: материалы Междунар. конф. Нукус: Илим, 2011. С. 29–30.
10. Жубанов К. У. Современное состояние популяций судака в Малом Аральском море // Изв. Национ. акад. наук Республики Казахстан. Серия аграрных наук. 2011. Т. 5. № 5. С. 51–54.
11. Goikoetxea A., Todd E., Gemmell N. Stress and sex:Does cortisol mediate sex change in fish? // Reproduc-tion. 2017. V. 154. N. 6. P. R149–R160.
12. Conover D. O., Heins S. W. The environmental and genetic components of sex ratio in Menidia menidia (Pisces: Atherinidae) // Copeia. 1987. V. 1987. N. 3. P. 732–743.
13. Ramee S. W., Lipscomb T. N., DiMaggio M. A. Evaluation of the effect of larval stocking density, salinity, and temperature on stress response and sex differentiation in the Dwarf Gourami and Rosy Barb // Aquaculture reports. 2020. V. 16. P. 100287.
14. Abucay J. S., Mair G. C., Skibinski D. O. F., Beardmore J. A. Environmental sex determination: the effect of temperature and salinity on sex ratio in Oreochromis niloticus L. // Aquaculture. 1999. V. 173. N. 1–4. P. 219–234.
15. Davey A. J. H., Jellyman D. J. Sex determination in freshwater eels and management options for manipulation of sex // Reviews in Fish Biology and Fisheries. 2005. V. 15. P. 37–52.
16. Côté C. L., Pavey S. A., Stacey J. A., Pratt T. C., Castonguay M., Audet C., Bernatchez L. Growth, Female Size, and Sex Ratio Variability in American Eel of Different Origins in Both Controlled Conditions and the Wild: Implications for Stocking Programs // Transactions of the American Fisheries Society. 2015. V. 144. N. 2. P. 246–257.
17. Neves L. C., Cipriano F., Cipriano L., Pedro G. J., Nakayama C. L., Kennedy R., Filho K. C. M. Effects of salinity on sexual maturity and reproduction of Poecilia velifera // Aquaculture Research. 2019. V. 50. N. 10. P. 2932–293.
18. Vetemaa M., Eschbaum R., Albert A., Saat T. Distribution, sex ratio and growth of Carassius gibelio (Bloch) in coastal and inland waters of Estonia (north-eastern Baltic Sea) // Journal of Applied Ichthyology. 2005. V. 21. N. 4. P. 287–291.
19. McCormick S. D. Endocrine Control of Osmoregulation in Teleost Fish // American Zoologist. 2001. V. 41. N. 4. P. 781–794.
















