Петрозаводск, Республика Карелия, Россия
Россия
Кондопожская губа Онежского озера испытывает антропогенную нагрузку в связи с поступлением в залив сточных вод ЦБК (вершинная часть) и деятельностью форелевых хозяйств (центральная часть). Оценены первично-продукционные (фотосинтез, хлорофилл а, удельный фотосинтез, ассимиляционные числа) характеристики экосистемы залива в период «вспышки» численности и биомассы фитопланктона в августе 2021 г. Доказано, что скорость фотосинтеза в заливе в период исследований определялась небольшими диатомеями. Клетки диатомового планктона объемом менее 600 мкм составляли 80‒90 % в численности Bacillariophyta, которые являлись доминантной группой сообщества. Величины фотосинтеза (150‒330 мкг/л•сут) не выходили за пределы олиго-мезотрофных экосистем. Величины удельного фотосинтеза (0,4‒1,2 сут–1) и ассимиляционные числа (22‒40 мкг C/мкг Chl) также были умеренными и не указывали на значительное биогенное загрязнение воды. Выявлено, что невысокое содержание хлорофилла а в биомассе фитопланктона (0,13‒0,39 %) определялось главным образом численностью продуктивных зеленых водорослей. Доля этой группы фитопланктона в биомассе сообщества не превышала 5‒26 %, в численности – 1‒11 %. В то же время биомассы фитопланктона (2,1‒5,7 мг/л) и концентрации хлорофилла а (5,1‒9,8 мкг/л) достигали показателей, свойственных мезо-эвтрофным экосистемам. Сравнение результатов исследования с многолетними данными по фотосинтезу показало, что трофическое состояние центральной части залива, где расположены большие форелевые фермы, не изменилось. Многолетние данные о биомассе фитопланктона указывают на повышение трофического статуса центральной части губы в настоящее время. Несогласованность уровня трофии по количественным и функциональным показателям фитопланктона может свидетельствовать о начальном этапе эвтрофирования Кондопожской губы в районе расположения форелевых хозяйств и примыкающей к нему пелагической части залива.
Онежское озеро, форелевые хозяйства, фитопланктон, хлорофилл а, фотосинтез, эвтрофирование
Введение
Товарное производство форели является перспективной и быстро развивающейся отраслью сельского хозяйства в Республике Карелия. Основой успешного разведения садковой форели служат благоприятные климатические условия и большое количество глубоких озер с чистой водой [1]. Большая часть форелевых хозяйств сосредоточена на двух крупнейших озерах Европы – Онежском и Ладожском, где есть развитая инфраструктура, в том числе удобные пути доставки продукции в другие регионы. Учитывая стратегическую ценность водных и биологических ресурсов этих озер, необходим тщательный контроль состояния водной среды в условиях садкового выращивания форели. Как известно, такая деятельность в случае чрезмерной нагрузки на водоем биогенных и органических веществ приводит к эвтрофированию и ухудшению качества воды [2], что снижает ресурсную ценность водного объекта.
В Онежском озере, согласно сведениям из открытых источников [3], расположены 24 форелевых фермы, в том числе 11 – в Кондопожской губе. Кроме того, в залив поступают сточные воды Кондопожского ЦБК. В последнее десятилетие нагрузка сточных вод на залив в виде взвешенных, органических, биогенных веществ сократилась в 5‒10 раз по сравнению с 1980‒1990 гг. [4]. В связи с этим в настоящее время деятельность форелевых ферм общей мощностью около 4 тыс. т [3] стала важнейшим фактором загрязнения воды в Кондопожской губе. В последние годы были обнаружены признаки эвтрофирования в районе форелевых хозяйств и прилегающей пелагической части губы по химическим (насыщение воды кислородом, концентрации фосфора) и биологическим (деструкция органического вещества, фитопланктон) показателям [5–7].
Первым откликом водной экосистемы на увеличение фосфорной нагрузки является увеличение количественных, затем – функциональных характеристик фитопланктона. Летом 2021 г. в Кондопожской губе в районе форелевых хозяйств и прилегающей пелагической части залива была зафиксирована «вспышка» численности и биомассы фитопланктона за счет резкого увеличения количества диатомовых и золотистых водорослей по сравнению с предшествующим многолетним периодом исследований [7].
Целью настоящей работы была оценка функциональных характеристик фитопланктона в Кондопожской губе Онежского озера в период «вспышки» его численности и биомассы летом 2021 г.
Материал и методы исследования
Кондопожская губа – большой глубоководный залив, расположенный в северо-западной части Онежского озера. Его средняя глубина 21 м, максимальная – 82 м, объем воды 4,3 км3, период условного водообмена 1,9 лет.
Пробы воды отбирали 4‒5 августа 2021 г. на 6 станциях с борта научно-исследовательского судна «Эколог» из поверхностного слоя 0,5 м. Станция К_3 (глубина 14,0 м) расположена в вершинной части губы, которая находится под влиянием сточных вод ЦБК и небольшого форелевого хозяйства, ст. К50 (глубина 35,0 м) и К_6 (глубина 76,6 м) ‒ в пелагиали центральной части губы. Станции KF1 (глубина 23,0 м), KF2 (глубина 28,5 м) и KF4 (глубина 6,8 м) расположены в прибрежье центральной части губы в районе расположения крупных форелевых ферм (рис. 1).
Фотосинтез измеряли скляночным кислородным методом [8]. Пересчет скорости фотосинтеза из единиц кислорода в углерод проводили с учетом ассимиляционного коэффициента 1,25 [9]. Первичная продукция в фотическом слое воды рассчитывалась по общепринятой формуле [10].

Рис. 1. Карта-схема Кондопожской губы Онежского озера. Кругами обозначены места расположения
форелевых хозяйств, серыми точками – места отбора проб воды августе 2021 г.
Fig. 1. A map of Kondopogskaya Bay of Lake Onego. The circles indicate the locations of trout farms,
the gray dots indicate the locations of water sampling August 2021
Для изменения хлорофилла а фитопланктон концентрировали на мембранных фильтрах (Dпор = 0,8 мкм), которые сразу замораживались. Содержание хлорофилла а определяли спектрофотометрически при λ = 663 нм, λ = 645 нм, λ = 630 нм [11].
Пробы воды для изучения фитопланктона фиксировали 40 %-м формалином. Клетки осаждали на мембранные фильтры (Dпор = 0,8 мкм). Видовой состав и численность изучали при увеличении ×400 [12, 13]. Идентификацию видов проводили по определителям [14, 15]. Биомассу определяли из индивидуальных объемов клеток, вычисленных по геометрическим фигурам.
По соотношению фотосинтеза и биомассы фитопланктона рассчитали суточные величины удельного фотосинтеза (P/B-коэффициенты), по соотношению фотосинтеза и хлорофилла а – суточные ассимиляционные числа (САЧ).
Результаты и обсуждение
Уровень развития фитопланктона в Кондопожской губе в августе 2021 г. характеризовался чрезвычайно высокими величинами, в несколько раз превышающими данные 30-летних исследований [7]. Биомасса и численность фитопланктона на изученных станциях изменялись примерно в 2 раза (табл. 1).
Таблица 1
Table 1
Количественные характеристики и особенности структуры фитопланктона
в Кондопожской губе Онежского озера в августе 2021 г.
Quantitative characteristics and structural features of phytoplankton
in the Kondopoga Bay of Lake Onego in August 2021
|
Показатель |
Станция |
|||||
|
К_3 |
К50 |
К_6 |
KF1 |
KF2 |
KF4 |
|
|
Численность, тыс. кл./л |
5 681,2 |
6 062,5 |
4 990,0 |
5 637,5 |
9 150,0 |
8 212,5 |
|
Биомасса, мг/л |
5,685 |
2,083 |
2,289 |
2,036 |
3,562 |
5,402 |
|
Содержание хлорофилла в биомассе фитопланктона, % |
0,17 |
0,37 |
0,23 |
0,39 |
0,23 |
0,13 |
|
Доля Bacillariophyta в численности фитопланктона, % |
75,7 |
62,9 |
55,6 |
65,8 |
75,1 |
74,7 |
|
Доля Bacillariophyta в биомассе фитопланктона, % |
93,0 |
83,6 |
80,3 |
84,5 |
89,1 |
91,0 |
|
Доля мелких клеток в численности Bacillariophyta, % |
23,7 |
84,9 |
85,6 |
87,2 |
92,0 |
78,0 |
|
Доля мелких клеток Bacillariophyta в численности фитопланктона, % |
9,0 |
57,1 |
39,2 |
64,3 |
69,1 |
58,3 |
|
Доля Chlorophyta в численности фитопланктона, % |
10,4 |
25,8 |
16,5 |
23,1 |
11,2 |
4,9 |
|
Доля Chlorophyta в биомассе фитопланктона, % |
1,0 |
10,9 |
7,7 |
6,8 |
4,1 |
2,8 |
Наибольшие биомассы были зарегистрированы на мелководных ст. К_3 (вблизи выпуска сточных вод ЦБК) и KF4 (вблизи форелевых садков) – 5,7 и 5,4 мг/л соответственно. На глубоководных ст. К50, К_6, KF1 и KF2 биомасса фитопланктона составляла 2,0–3,6 мг/л. По величине биомассы большинство изученных участков залива характеризовались как мезотрофные, а на ст. К_3 и KF4 достигали уровня слабоэвтрофных экосистем (табл. 2).
Таблица 2
Table 2
Трофическое состояние Кондопожской губы Онежского озера
по показателям развития фитопланктона в поверхностном слое воды в августе 2021 г.
Trophic state of the Kondopoga Bay of Lake Onego
according to indicators of phytoplankton development in the surface water layer in August 2021
|
Станция |
Фотосинтез |
Концентрация хлорофилла а |
Биомасса фитопланктона |
|
К_3 |
Олиготрофный |
Мезотрофный |
α-эвтрофный |
|
К50 |
Мезотрофный |
||
|
К_6 |
|||
|
KF1 |
Олиго-мезотрофный |
||
|
KF2 |
Мезотрофный |
||
|
KF4 |
α-эвтрофный |
В то же время в 2000‒2010 гг. величины летней биомассы фитопланктона в центральной глубоководной части залива (ст. К50 и К_6), сопредельной с районом расположения форелевых хозяйств, не выходили за пределы для олиго-мезотрофных, а в вершинной части, где расположен выпуск сточных вод ЦБК, ‒ мезотрофных экосистем [7, 16].
Содержание хлорофилла а в воде исследованных участков губы (табл. 3) находилось в пределах 5‒10 мкг/л.
Таблица 3
Table 3
Продукционные характеристики фитопланктона
в Кондопожской губе Онежского озера в августе 2021 г.
Production characteristics of phytoplankton
in the Kondopoga Bay of Lake Onego in August 2021
|
Показатель |
Станция |
|||||
|
К_3 |
К50 |
К_6 |
KF1 |
KF2 |
KF4 |
|
|
Прозрачность воды, м |
1,3 |
2,6 |
2,6 |
2,5 |
2,5 |
2,5 |
|
Хлорофилл а в поверхностном слое воды, мкг/л |
9,8 |
7,9 |
5,1 |
7,9 |
8,3 |
7,0 |
|
Фотосинтез в поверхностном слое воды, мкг C/л·сут |
216,1 |
233,2 |
150,4 |
247,7 |
331,3 |
274,6 |
|
Р/В-коэффициент, сут–1 |
0,38 |
1,12 |
0,66 |
1,22 |
0,93 |
0,50 |
|
САЧ, мкг С/мкг Chl |
22 |
29 |
29 |
31 |
40 |
39 |
|
Первичная продукция (PP), мг С/м2·сут |
244,4 |
527,6 |
340,2 |
538,7 |
720,6 |
597,4 |
Концентрации хлорофилла как косвенного показателя биомассы фитопланктона, так же, как и сами величины биомассы, отражали мезотрофное состояние экосистемы (см. табл. 2). Наибольшая концентрация, приближающаяся к верхней границе мезотрофии, отмечена на ст. К_3 (9,8 мкг/л) и KF2 (8,3 мкг/л), минимальная – на ст. К_6 (5,1 мкг/л).
В целом концентрации хлорофилла а на ст. К_3 в вершинной части и ст. К50 в пелагиали центральной части Кондопожской губы в августе 2021 г. были значительно выше, чем в предшествующие 30 лет наблюдений [17].
Содержание хлорофилла а в биомассе фитопланктона было невелико и составляло 0,13–0,39 %, что связано с доминированием диатомей (см. табл. 1). Подобная доля хлорофилла а в биомассе диатомового планктона была установлена в Рыбинском водохранилище [18]. Тем не менее, связи между диатомовыми водорослями и содержанием хлорофилла в биомассе фитопланктона установить не удалось. Регрессионный анализ выявил достоверную зависимость содержания хлорофилла в биомассе только от доли зеленых водорослей в численности фитопланктона, коэффициент Спирмена составил 0,93 при р < 0,05, n = 6 (рис. 2).
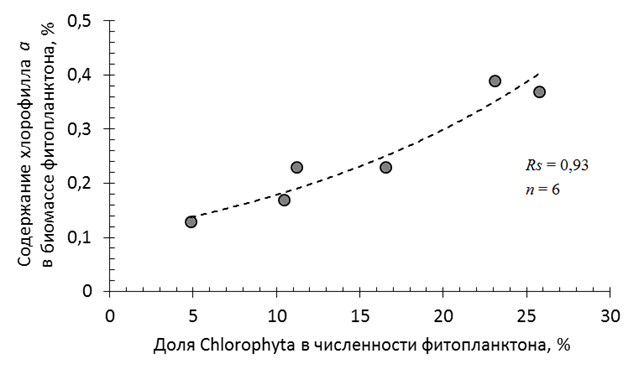
Рис. 2. Зависимость содержания хлорофилла а в биомассе фитопланктона от доли зеленых водорослей
в альгоценозах Кондопожской губы Онежского озера в августе 2021 г.
Fig. 2. Dependence of chlorophyll a content in phytoplankton biomass on the proportion of green algae
in algocenoses of the Kondopoga Bay of Lake Onego in August 2021
Такая связь закономерна, хотя принято считать, что содержание хлорофилла в биомассе планктона в большей степени зависит от биомассы зеленых водорослей, чем от их численности. Клетки этой группы фитопланктона в 4‒5 раз богаче хлорофиллом, чем, например, диатомовые или цианобактерии [18]. Отсутствие связи с долей зеленых в биомассе, вероятно, связано с тем, что небольшие размеры клеток этой группы определяют значительно меньший вклад в биомассу, чем в численность. Так, от 30 до 80 % клеток зеленых водорослей имели размер менее 100 (в том числе и менее 20) мкм. При этом их вклад в численность фитопланктона составлял 2‒20 %, а в его биомассу ‒ лишь 0,2‒2,6 % (см. табл. 1). Особенно это несоответствие проявляется на фоне в целом небольшого представительства зеленых водорослей в альгоценозах Кондопожской губы в период исследований.
Скорость фотосинтеза в поверхностном слое воды изученных участков Кондопожской губы не превышала 150‒330 мкг С/л·сут и находилась преимущественно в границах олиготрофных экосистем (см. табл. 3). Лишь на двух станциях вблизи форелевых садков она достигала нижней границы мезотрофного состояния (см. рис. 1, табл. 3). Наименьшая величина была отмечена на ст. К_6, наиболее удаленной от форелевых хозяйств и выпуска сточных вод, наибольшая – на ст. KF2 в районе форелевых садков. В целом в период исследований центральная глубоководная часть Кондопожской губы (ст. К50 и К_6) по величинам фотосинтеза сохраняла олиготрофное состояние (см. табл. 2), как это было показано предыдущими исследованиями [19, 20]. Лишь в расчете на м2 фотического слоя воды первичная продукция в пелагиали центрального района залива достигала мезотрофного уровня за счет в 2 раза более высокой прозрачности воды и, соответственно, более мощного фотического слоя по сравнению со ст. К_3 в вершинной части залива (см. табл. 2). На ст. К_3 даже интегральная первичная продукция характеризовала этот участок как олиготрофный, в то время как в 2000‒2010 гг. величины фотосинтеза достигали мезотрофного уровня [19, 20]. Наиболее высокие величины интегральной первичной продукции, как и в верхнем слое воды, были в районе форелевых садков на ст. KF2 – 721 мг С/м2·сут (см. табл. 3). На этой же станции в зимний период 2022 г. был обнаружен дефицит кислорода в нижних слоях воды до 6 % насыщения, концентрации фосфатов достигали 787 мкг/л [5], что представляет непосредственную угрозу вторичного эвтрофирования. В районе расположения форелевых садков первично-продукционные исследования в 2000‒2010 гг. не проводились, а в августе 2021 г. по величинам продукции фитопланктона этот участок залива был мезотрофным.
Величины P/B-коэффициентов (см. табл. 3) находились в пределах, свойственных для пресных водоемов умеренных широт, не испытывающих значительного антропогенного прессинга [10, 21, 22]. Как и фотосинтез, САЧ и P/B-коэффициенты на данном этапе функционирования экосистемы Кондопожской губы не отражали высокую продуктивность единицы хлорофилла или биомассы, хотя абсолютные значения этих показателей существенно возросли по сравнению с 2000‒2010 гг. [7]. На явное биогенное загрязнение могут указывать P/B-коэффициенты больше 2 сут–1 [21].
Распределение скорости фотосинтеза на изученной акватории (см. табл. 3) в целом соответствовало распределению численности микроводорослей в поверхностном слое воды: максимальные значения наблюдались на ст. KF2 и KF4, минимальное – на ст. К_6 (см. табл. 1). Это подтвердил регрессионный анализ, который показал значимую зависимость величин фотосинтеза от численности фитопланктона (рис. 3).
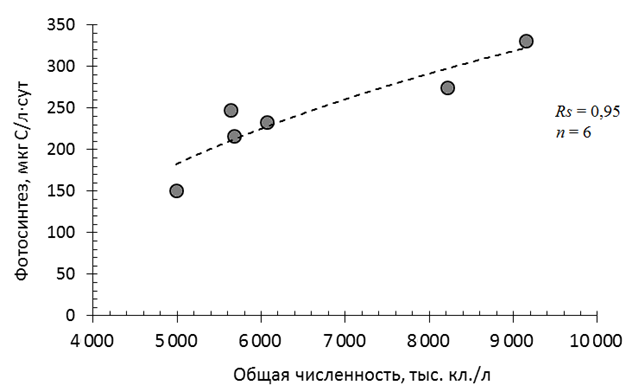
Рис. 3. Зависимость фотосинтеза от численности фитопланктона в Кондопожской губе Онежского озера в августе 2021 г.
Fig. 3. The dependence of photosynthesis on the number of phytoplankton in the Kondopoga Bay of Lake Onego in August 2021
Ранговый коэффициент корреляции Спирмена составил 0,95, n = 6, p < 0,05. В то же время связи фотосинтеза с биомассой фитопланктона и концентрацией хлорофилла а, который может считаться косвенным показателем биомассы, не было обнаружено. Основу альгоценозов в изученных участках Кондопожской губы составляют диатомовые, зеленые водоросли и цианобактерии. Количество золотистых водорослей не превышает 3,5 % в численности фитопланктона, остальных групп – менее 1 %. Статистический анализ выявил достоверную связь фотосинтеза только с численностью диатомовых водорослей для пяти станций, за исключением ст. К_3 (рис. 4, а).
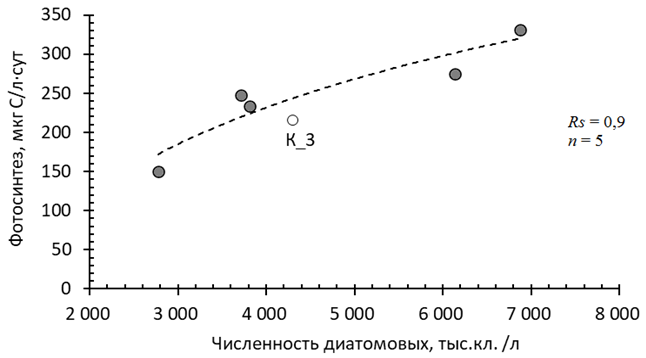
а
Рис. 4. Зависимость фотосинтеза от общей численности диатомового планктона (а)
в Кондопожской губе Онежского озера в августе 2021 г.
Fig. 4. The dependence of photosynthesis on the total number of diatom plankton (а)
in the Kondopoga Bay of Lake Onego in August 2021

б
Рис. 4 (окончание). Зависимость фотосинтеза от численности мелкоклеточных диатомей (б)
в Кондопожской губе Онежского озера в августе 2021 г.
Fig. 4 (ending). The dependence of photosynthesis on the
number of small-cell diatoms (б) in the Kondopoga Bay of Lake Onego in August 2021
Коэффициент Спирмена составил 0,9 при р < 0,05, n = 5. Выявленную зависимость можно объяснить тем, что при доминировании диатомовых в альгоценозах на всех изученных станциях (56–76 % в численности и 80–93 % в биомассе) (см. табл. 1) на ст. К50, К_6, KF1, KF2 и KF4 в этой группе преобладают небольшие клетки (V < 600 мкм). Эта размерная фракция представлена видами Asterionella formosa Hass., Fragilaria crotonensis Kitt., Aulacoseira subarctica (O. Müll.) Hawort., A. italica (Ehrenb.) Simonsen и A. italica var. curvata, которые составляли от 78 до 92 % численности всех диатомей (см. табл. 3). В целом вклад небольших диатомей в общую численность фитопланктона достигал 39‒69 % (см. табл. 1). В то же время в биомассу бόльший вклад вносят крупные диатомовые. Как известно, с уменьшением размера клетки увеличивается скорость оборота биомассы [23]. Регрессионный анализ подтвердил, что интенсивность фотосинтеза на ст. К50, К_6, KF1, KF2 и KF4 определяется количеством мелких клеток диатомовых водорослей, коэффициент Спирмена составил 0,97 при р < 0,05,
n = 5 (см. рис. 4, б).
Иная ситуация наблюдалась на ст. К_3, где доля клеток размером менее 600 мкм составляла около 24 % в численности диатомовых, а в общей численности фитопланктона – лишь 9 % (см. табл. 3). Учитывая, что доля наиболее продуктивных зеленых водорослей в общей численности фитопланктона ст. К_3, как и на других изученных станциях, тоже невелика (см. табл. 3), фотосинтез в этом участке губы определялся крупными представителями диатомей, которые вносят меньший вклад в численность, но большой ‒ в биомассу фитопланктона. Так, на ст. К_3 диатомеи размером больше 600 мкм составляли 75 % численности и 92 % биомассы диатомового комплекса и 57 и 86 % всего фитопланктонного сообщества соответственно. Из 17 видов крупных диатомей на ст. К_3 наибольший вклад и по численности, и по биомассе вносили Aulacoseira islandica (O. Müll.) Simonsen (V = 1 038 мкм) и большие формы F. crotonensis (V = 2 061 мкм). Такая структура альгоценоза объясняет невысокую скорость фотосинтеза на ст. К_3, тогда как ранее этот район всегда был наиболее продуктивным участком Кондопожской губы вследствие непосредственного влияния на него сточных вод ЦБК.
Возможно, что причиной небольшой численности мелкоклеточных диатомей на ст. К_3 могло быть выедание. Как правило, вода в этом участке залива содержит больше органического вещества и взвеси, чем на остальной акватории, из-за влияния на ее химический состав сточных вод, кроме того, хорошо прогревается вследствие небольшой глубины. Такие условия благоприятны для развития коловраток, крупные формы которых, например р. Asplanchna, способны питаться даже относительно крупными диатомовыми и динофитовыми водорослями [24–26].
Заключение
Таким образом, исследования фотосинтетической активности фитопланктона в период его «вспышки» в Кондопожской губе Онежского озера в августе 2021 г. выявили невысокие величины фотосинтеза, Р/В-коэффициентов и САЧ. Такое несоответствие свидетельствует о начальном этапе эвтрофирования центральной части Кондопожской губы, где расположены форелевые садки. При увеличении биогенной нагрузки в первую очередь происходят увеличение количественных показателей развития фитопланктона и структурная перестройка сообщества. Дефицит кислорода в зимний период обнаружен только в одном ограниченном глубоководном участке в районе форелевых садков на ст. KF2 [4] и пока не может быть источником вторичного биогенного загрязнения в целом для залива. Улучшение экологической ситуации в Кондопожской губе в настоящее время вполне возможно при снижении мощности товарного производства форели, использования высококачественного рыбного корма, перемещения садков и тому подобных мероприятий.
1. Озера Карелии: справ. Петрозаводск: Изд-во Ка-рельс. науч. центра РАН, 2013. 464 с.
2. Киуру Т., Виелма Й. и др. Экологический справочник для рыбоводной промышленности Северо-Запада России. Хельсинки: Nykypaino, 2013. 112 с.
3. Карта рыбных хозяйств // Ассоциация форелеводов Карелии. URL: http://kareliatrout.ru/karta-rybnyh-hozjajstv (дата обращения: 28.02.2024).
4. Свидетельство о гос. регистрации баз данных № 2021620975. Антропогенная нагрузка и биоиндикация состояния Онежского озера (Верхне-Свирского водохранилища) / И. А. Литвинова, Н. М. Калинкина, Е. В. Теканова, Е. М. Макарова, А. Н. Ефимова; 17.05.2021.
5. Галахина Н. Е., Зобков М. Б. Гидрохимические исследования в районе расположения форелевых хозяйств в Кондопожской губе Онежского озера в зимний период 2022 года // Тр. Карельс. науч. центра РАН. 2022. № 6. С. 76–87.
6. Теканова Е. В. Литвинова И. А. Деструкция органического вещества в Кондопожской губе Онежского озера при изменении антропогенной нагрузки // Водные ресурсы. 2022. Т. 49. № 6. С. 719–727.
7. Смирнова В. С., Теканова Е. В., Калинкина Н. М. Фитопланктон как индикатор состояния экосистемы Кондопожской губы Онежского озера в условиях садкового выращивания форели // Трансформация экосистем. 2024. Т. 7. № 1. С. 177‒195.
8. Кузнецов С. И., Дубинина Г. А. Методы изучения водных микроорганизмов. М.: Наука, 1989. 288 с.
9. Бульон В. В. Радиоуглеродный метод определения первичной продукции, его возможности и ограничения в сравнении с кислородным методом // Методические вопросы изучения первичной продукции планктона внутренних водоемов. СПб.: Гидрометеоиздат, 1993. С. 14‒20.
10. Бульон В. В. Первичная продукция планктона внутренних водоемов. Л.: Наука, 1983. 150 с.
11. SCOR-UNESCO Working Group № 17. Determination of photosynthetic pigments in sea water. Paris: UNESCO, 1966. 66 p.
12. Кузьмин Г. В. Фитопланктон // Методика изучения биогеоценозов внутренних водоемов. М.: Наука, 1975. C. 73–84.
13. Федоров В. Д. О методах изучения фитопланктона и его активности. М.: Наука, 1979. 166 с.
14. Tikkanen T. Kasviplanktonopas. Helsinki: Suomen Luonnonsuojelun Tuki Oy, 1986. 277 p.
15. Freshwater algae of North America. Ecology and Classification. San Diego: Elsiver Inc. Academic Press, 2015. 962 p.
16. Свидетельство о государственной регистрации баз данных № 2015620274. Планктон пелагиали Онежского озера / М. Т. Сярки, Е. В. Теканова, Т. А. Чекрыжева; 13.02.2015.
17. Теканова Е. В., Калинкина Н. М., Макарова Е. М., Смирнова В. С. Современное трофическое состояние и качество воды Онежского озера // Биология внутренних вод. 2023. № 6. С. 740‒746.
18. Елизарова В. А. Хлорофилл как показатель биомассы фитопланктона // Методические вопросы изучения первичной продукции планктона внутренних водоемов. СПб.: Гидрометеоиздат, 1993. С. 126–131.
19. Тимакова Т. М., Куликова Т. П., Литвинова И. А., Полякова Т. Н., Сярки М. Т., Теканова Е. В., Чекрыжева Т. А. Изменение биоценозов Кондопожской губы Онежского озера под влиянием сточных вод целлюлозно-бумажного комбината // Водные ресурсы. 2014. Т. 41. № 1. С. 74–82.
20. Теканова Е. В., Калинкина Н. М., Смирнова В. С. Реконструкция величин фотосинтеза в Онежском озере по концентрации хлорофилла а // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2023. № 1. С. 45‒54.
21. Михеева Т. М. О показателях удельной активности фитопланктона и некоторых причинах, их определяющих // Гидробиолог. журн. 1977. Т. 13. № 3. С. 11–16.
22. Трифонова И. С. Экология и сукцессия озерного фитопланктона. Л.: Наука, 1990. 184 с.
23. Гутельмахер Б. Л. Метаболизм планктона как единого целого. Л.: Наука, 1986. 155 с.
24. Монаков А. В. Питание пресноводных беспозвоночных. М.: Изд-во Россельхозакадемии, 1998. 320 с.
25. Лазарева В. И. Сезонный цикл развития и питание хищных коловраток рода Asplanchna в Рыбинском водохранилище // Биология внутренних вод. 2004. № 4. С. 59–68.
26. Стойко Т. Г., Сенкевич (Бурдова) В. А., Мазей Ю. А. Изменение численности и питание коловраток рода Asplanchna (Eurotatoria, Rotifera) в пруду (бассейн р. Сура) // Поволж. эколог. журн. 2016. № 3. С. 312‒319.

















