Россия
Африканский клариевый сом – перспективный объект индустриального рыбоводства. Рассматривается решение проблемы прижизненного получения половых продуктов самцов клариевого сома. Послеубойное извлечение семенников значительно ограничивает возможность селекционной работы с данным видом. Техника прижизненного получения спермы хирургическими методами, ввиду своей трудозатратности и рисков, не приобрела широкого распространения в рыбоводной практике. В целях улучшения возможностей селекционной работы с африканским клариевым сомом предлагается совершенствование техники хирургической операции по пути уменьшения трудозатрат и повышения выживаемости рыб в послеоперационном периоде. Представлена модифицированная техника проведения гонадэктомии у самцов африканского клариевого сома с использованием парасагиттального доступа, открываемого краниодорсально по отношению к поясу тазовых плавников. Техника позволяет сократить время хирургического вмешательства в среднем с 27,0 ± 0,6 мин при срединном доступе до 20,6 ± 1,2 мин при парасагиттальном доступе. Сперма, полученная с применением модифицированной техники, была хорошего качества, с незначительной примесью крови. Отдельно отмечается удобство работы хирурга при использовании парасагиттального доступа в связи с близким к идеальному углом оперативного доступа. Выживаемость рыб при применении модифицированной методики составляла 100 %. Достоверных различий в заживлении хирургических швов и состоянии рыб в послеоперационном периоде между группами, оперированными по классической и модифицированной методике, не отмечалось, среднее время заживления швов составляло 18–19 дней.
африканский клариевый сом, прижизненное получение спермы, искусственное воспроизводство, хирургическое вмешательство, парасагиттальный доступ, Clarias gariepinus, хирургический доступ
Введение
Одним из наиболее перспективных объектов тепловодного индустриального рыбоводства является африканский клариевый сом (Clarias gariepinus), обладающий высоким генетическим потенциалом роста и развития в условиях интенсивной технологии воспроизводства и выращивания рыбы [1, 2].
В индустриальной аквакультуре используется искусственное воспроизводство африканского клариевого сома в связи со сложными условиями естественного нереста. В настоящее время наиболее распространенным методом получения спермопродукции самцов африканского клариевого сома является посмертная гонадэктомия, что существенно влияет на возможности селекционной работы с данным видом [2, 3]. В современной литературе имеются незначительные данные по применению авторских методик прижизненной частичной гонадэктомии для многократного использования самцов сома обыкновенного (Silurus glanis) в разведении [1, 4–6]. Схожая методика частичного хирургического удаления гонады с целью получения спермы описана для африканского клариаса в нескольких российских и зарубежных исследованиях [7, 8]. Несмотря на успешность метода, авторы отмечают, что у рыб наблюдается период «переболевания» после хирургической операции. Дополнительным фактором, выступающим не в пользу хирургического вмешательства, является его трудозатратность по сравнению с послеубойным извлечением гонад.
Целью настоящей работы является оценка эффективности и безопасности модифицированного способа проведения гонадэктомии у самцов африканского клариевого сома в целях прижизненного получения спермы.
Материалы и методы
Исследования проведены в ФГБОУ ВО «Российский государственный аграрный университет – МСХА имени К. А. Тимирязева», в учебно-научной лаборатории аквакультуры, а также на кафедрах аквакультуры и пчеловодства и ветеринарной медицины в период март-апрель 2023 г.
Объектами исследования являлись половозрелые самцы африканского клариевого сома (Сlarias gariepinus) в возрасте 1,5 лет массой 2,08 ± 0,07 кг. Рыбы были поделены на 3 группы (контроль, опытная 1, опытная 2), по 5 рыб в каждой группе.
В предоперационном периоде рыбы содержались в 400-литровых аквариумах с принудительной аэрацией и водоочисткой. Температура воды в аквариумах поддерживалась в пределах 26–28 °С. Кормление осуществлялось комбикормом Le Gouessant Sturgeon Grower 1 раз в сутки по поедаемости.
За 2 суток до проведения операции поднимали температуру в аквариумах до 29 °С и прекращали кормление [7].
За 16 ч до проведения хирургического вмешательства проводили гормональную стимуляцию рыб, вводя им Фертагил в дозе 100 мкг/кг внутримышечно, отступив на 1 см вниз от основания спинного плавника и разделяя общий объем препарата поровну на 6 инъекций [9].
Рыб контрольной группы умертвляли путем погружения в глубокий наркоз в растворе MS-222 и декапитации, затем извлекали правый семенник.
Рыб 1-й и 2-й опытных групп оперировали. Операцию рыбам 1-й опытной группы проводили в соответствии с методикой, предложенной Г. И. Прониной и соавторами [10]. Во время операции удаляли правую гонаду.
Рыбам 2-й опытной группы проводили хирургическое вмешательство, используя парасагиттальный хирургический доступ, открывая его по анатомическим ориентирам, для этого нащупывали костный пояс тазовых плавников и открывали доступ, отступая 0,3–0,5 см дорсально и 0,5–1 см краниально, доступ продлевали краниально на
3–3,5 см. В остальном методика проведения оперативного вмешательства соответствовала таковой для 1-й опытной группы. Во время операции удаляли правую гонаду.
В качестве анестетика использовали гвоздичное масло в дозе 0,2 мл/л воды. Анестезию проводили непосредственно перед операцией в емкостях объемом 5 л по общепринятой методике [4].
Извлечение спермы из семенника проводили общепринятым способом [11].
Оценивали качество спермы по следующим показателям: органолептические свойства, концентрация спермиев в 1 мл спермы, время подвижности спермиев (50 % подвижности и наступление полной неподвижности), доля живых спермиев. Концентрация спермиев определялась с помощью спектрофотометра. Подвижность оценивали микроскопически, соединяя на предметном стекле каплю воды и каплю спермы для активации спермиев, временем начала отсчета считали момент соединения капель. Долю живых спермиев оценивали микроскопически в мазках, окрашенных 5 %-м водным раствором эозина [12].
Рыб в послеоперационном периоде рассаживали индивидуально в емкости объемом 100 л, объединенные в единую установку замкнутого водообеспечения, и устанавливали за ними наблюдение: в течение недели после операции – ежедневно 3 раза в день, затем на протяжении 2 недель – ежедневно 1 раз в день. Во время наблюдения оценивали скорость заживления швов, а также наступление неблагоприятных последствий в послеоперационном периоде.
Статистическую обработку проводили с применением t-критерия Стьюдента для нормального распределения с использованием программы Microsoft Office Excel. Достоверными считались различия при p < 0,05.
Результаты исследований
Непосредственно перед проведением хирургического вмешательства был проведен клинический осмотр рыб контрольной и обеих опытных групп, по результатам которого не было выявлено каких-либо отклонений в состоянии здоровья рыб, что позволяет заключить, что к моменту проведения хирургического вмешательства все рыбы были клинически здоровы. Данные о результатах хирургического вмешательства представлены в таблице.
Результаты проведения хирургического вмешательства по извлечению гонады
The results of surgical intervention to extract the gonad
|
Показатель |
Группа |
||
|
Контрольная |
Опытная 1 |
Опытная 2 |
|
|
Число особей, гол. |
5 |
||
|
Живая масса, г |
2 111 ± 78 |
2 101 ± 74 |
2 030 ± 52 |
|
Время проведения операции, с |
404 ± 15* |
1 618 ± 36 * |
1 235 ± 71* |
|
Масса удаленной гонады, г |
8,76 ± 0,53 |
9,04 ± 0,46 |
8,63 ± 0,40 |
|
Выжило к концу операции: |
|
|
|
|
гол. |
0 |
5 |
5 |
|
% |
0 |
100 |
100 |
|
Выжило в течение 2 мес после операции: |
|
|
|
|
гол. |
0 |
5 |
5 |
|
% |
0 |
100 |
100 |
|
Срок заживления кожного шва, сут |
– |
18 ± 1 |
19 ± 1 |
* Различия между группами достоверны при p < 0,05.
Достоверные различия в массе удаленной гонады между группами отсутствуют (см. табл.), что говорит об отсутствии влияния препарата для наркоза и иных переменных факторов на семенник. Качество спермы, полученной от рыб контрольной, 1 и 2 опытных групп, по исследованным показателям не имело достоверных различий. Во всех пробах содержалось незначительное количество крови, попадающей в сперму (рис.).
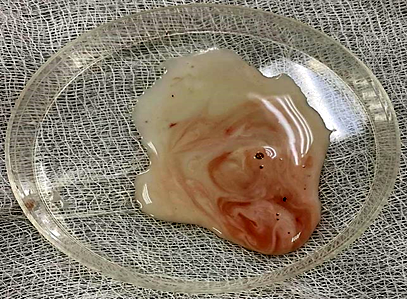
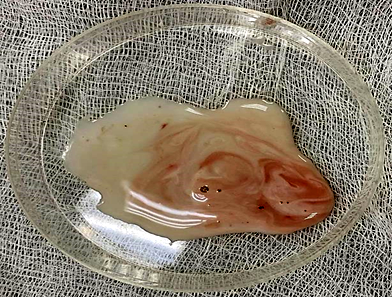
a б
Сперма, полученная от самцов африканского клариевого сома классическим методом измельчения семенника:
a – 1 опытная группа; б – 2 опытная группа
Sperm obtained from males of the African catfish by the classical method of crushing the testis:
a – 1 experimental group; б – 2 experimental group
Объем полученной из семенников спермы составлял от 10,3 до 13,2 мл с концентрацией спермиев в среднем (116,13 ± 3,61) · 106 мл–1. Доля жизнеспособных спермиев во всех пробах превышала 75 %, что говорит о хорошем качестве полученной спермопродукции.
Достоверные различия наблюдались во времени проведения вмешательства. Достоверно наиболее быстрым способом получения гонады являлся посмертный, достоверно наиболее долгим – извлечение гонады через срединный разрез брюха.
Уменьшение продолжительности вмешательства при использовании парасагиттального доступа в сравнении со срединным доступом объясняется приближением угла оперативного доступа, состоящего из угла наклона оси операционного действия и угла наклона оси наблюдения, к 90°. Применение парасагиттального доступа позволяло лучше визуализировать оперируемый орган, т. к. зона доступа оказывалась над ним. При организации доступа по срединной линии приходилось вначале отодвигать внутренние органы и лишь затем, при помощи рук, выводить в операционную рану семенник.
Достоверные различия в скорости заживления хирургических швов между 1 и 2 опытными группами отмечены не были. Воспалительный процесс при заживлении кожного шва проявлялся с умеренной силой, не переходя в гиперэргическое воспаление. Никаких побочных явлений, таких как нагноение шва, развитие перитонита и т. д., не отмечалось. Рыбы в течение срока восстановления после операции и дальнейшего заживления шва чувствовали себя удовлетворительно, начинали питаться на 2–3 день после хирургического вмешательства.
Таким образом, использование парасагиттального доступа позволяет сократить время хирургического вмешательства по извлечению гонады африканского клариевого сома с 27 до 20,5 мин без иных существенных различий, что благоприятно отражается на общей скорости работы и позволяет обработать большее количество рыб за смену. Наряду с безопасностью погружения рыб в наркоз с помощью гвоздичного масла на длительный срок, показанной в 1 опыте, это позволяет ставить прижизненное получение гонад «на поток».
Заключение
Таким образом, для получения спермы самцов клариевого сома для искусственного воспроизводства целесообразно применять технику гонадэктомии с открытием парасагиттального операционного доступа. Использование парасагиттального доступа позволяет сократить трудозатраты на проведение хирургического вмешательства и осуществлять гонадэктомию у 1 рыбы в среднем за 20,6 ± 1,2 мин.
1. Подушка С. Б. Использование хирургических методов в рыбоводстве // Состояние и перспективы развития пресноводной аквакультуры: докл. Междунар. науч.-практ. конф. (Москва, ВВЦ, 5–6 февраля 2013 г.). М.: Изд-во РГАУ МСХА им. К. А. Тимирязева, 2013. С. 393–396.
2. Kucharczyk D., Kucharczyk D. J., Nowosad J., Omirzhanova N. Optimization of artificial insemination outcomes of African catfish (Clarias gariepinus) with differing hatchery conditions // Animal reproduction science. 2019. V. 211. P. 106222.
3. Юшкова Ю. А. Биотехника воспроизводства и выращивание молоди клариевого сома в режиме поли-цикла в условиях установки с замкнутым водообеспечением: автореф. дис. … канд. с.-х. наук. Орел, 2009. 24 с.
4. Петрушин А. Б., Маслова Н. И., Власов В. А., Лабенец А. В., Петрушин В. А., Смолин В. В., Пронина Г. И., Дьяконов А. Н. Сборник методик по разведению и выращиванию обыкновенного (Silurus glanis L.) и клариевого (Clarias gariepinus) сомов: инструкт.-метод. изд. М.: Изд-во РГАУ-МСХА им. К. А. Тимирязева, 2012. 80 с.
5. Pronina G. I., Petrushin A. B. Techniques for in vivo extraction of gonads of male European catfish (Silurus glanis) for the artificial reproduction // Aquaculture, Aquarium, Conservation & Legislation - International Journal of the Bioflux Society. 2019. V. 12 (4). P. 1316–1322.
6. Siwicki A., Jeney Z. Surgical intervention in wels (Silurus glanis L.) during artificial propagation // Aquacultura Hungarica. 1985. V. 5. P. 55–58.
7. Романова Е. М., Любомирова В. Н., Романов В. В., Мухитова М. Е. Инновационные подходы к получе-нию половых продуктов африканского сома в бассейновой аквакультуре // Вестн. Ульяновск. гос. с.-х. акад. 2017. № 92. С. 1–6.
8. Diyaware M. Y., Haruna A. B., Abubakar K. A. De-termination of testes regeneration period for African cat-fish (Clarias anguillaris) after milt (semen) collection through ablation // Current Research Journal of Biological Sciences. 2010. V. 2 (6). P. 375–379.
9. Пантелеев А. А., Пронина Г. И., Седлецкая Е. С. Гормональная стимуляция самцов клариевого сома для прижизненного отбора спермы в целях искусственного воспроизводства // Рыбоводство и рыбное хозяйство. 2023. № 11. С. 756–764.
10. Пронина Г. И., Пантелеев А. А., Сусова Е. Е. Прижизненное получение и оценка спермы самцов клариевого сома для искусственного воспроизводства // Рыбоводство и рыбное хозяйство. 2021. № 11 (190). С. 32–41.
11. Власов В. А., Завьялов А. П., Есавкин Ю. И. Рекомендации по воспроизводству и выращиванию клариевого сома с использованием установок с замкнутым циклом водообеспечения. М.: Росинформагротех, 2010. 48 с.
12. Шатохина И. С., Кузнецова В. С. Исследование эякулята: учеб. пособие. М.: МОНИКИ, 2014. 20 с.
















