Russian Federation
The African clary catfish is a promising object of industrial fish farming. A solution to the problem of lifetime production of sexual products of male clary catfish is considered. Post-slaughter extraction of testes significantly limits the possibility of breeding work with this species. The technique of obtaining sperm in vivo by surgical methods, due to its labor costs and risks, has not become widespread in fish farming practice. In order to improve the possibilities of breeding work with African clary catfish, it is proposed to improve the technique of surgical surgery by reducing labor costs and increasing the survival rate of fish in the postoperative period. A modified technique for performing gonadectomy in males of the African clary catfish using a parasagittal access opened craniodorsally with respect to the pelvic fin belt is presented. The technique allows to reduce the time of surgical intervention from an average of 27.0 ± 0.6 minutes with median access to 20.6 ± 1.2 minutes with parasagittal access. The sperm obtained using the modified technique was of good quality, with a slight admixture of blood. The convenience of the surgeon's work when using parasagittal access is separately noted due to the close to ideal angle of operative access. The survival rate of fish using the modified technique was 100%. There were no significant differences in the healing of surgical sutures and the condition of fish in the postoperative period between the groups operated according to the classical and modified methods, the average time of suture healing was 18-19 days.
African catfish, in vivo sperm obtaining, artificial reproduction, surgical intervention, parasagittal access, Clarias gariepinus, surgical access
Введение
Одним из наиболее перспективных объектов тепловодного индустриального рыбоводства является африканский клариевый сом (Clarias gariepinus), обладающий высоким генетическим потенциалом роста и развития в условиях интенсивной технологии воспроизводства и выращивания рыбы [1, 2].
В индустриальной аквакультуре используется искусственное воспроизводство африканского клариевого сома в связи со сложными условиями естественного нереста. В настоящее время наиболее распространенным методом получения спермопродукции самцов африканского клариевого сома является посмертная гонадэктомия, что существенно влияет на возможности селекционной работы с данным видом [2, 3]. В современной литературе имеются незначительные данные по применению авторских методик прижизненной частичной гонадэктомии для многократного использования самцов сома обыкновенного (Silurus glanis) в разведении [1, 4–6]. Схожая методика частичного хирургического удаления гонады с целью получения спермы описана для африканского клариаса в нескольких российских и зарубежных исследованиях [7, 8]. Несмотря на успешность метода, авторы отмечают, что у рыб наблюдается период «переболевания» после хирургической операции. Дополнительным фактором, выступающим не в пользу хирургического вмешательства, является его трудозатратность по сравнению с послеубойным извлечением гонад.
Целью настоящей работы является оценка эффективности и безопасности модифицированного способа проведения гонадэктомии у самцов африканского клариевого сома в целях прижизненного получения спермы.
Материалы и методы
Исследования проведены в ФГБОУ ВО «Российский государственный аграрный университет – МСХА имени К. А. Тимирязева», в учебно-научной лаборатории аквакультуры, а также на кафедрах аквакультуры и пчеловодства и ветеринарной медицины в период март-апрель 2023 г.
Объектами исследования являлись половозрелые самцы африканского клариевого сома (Сlarias gariepinus) в возрасте 1,5 лет массой 2,08 ± 0,07 кг. Рыбы были поделены на 3 группы (контроль, опытная 1, опытная 2), по 5 рыб в каждой группе.
В предоперационном периоде рыбы содержались в 400-литровых аквариумах с принудительной аэрацией и водоочисткой. Температура воды в аквариумах поддерживалась в пределах 26–28 °С. Кормление осуществлялось комбикормом Le Gouessant Sturgeon Grower 1 раз в сутки по поедаемости.
За 2 суток до проведения операции поднимали температуру в аквариумах до 29 °С и прекращали кормление [7].
За 16 ч до проведения хирургического вмешательства проводили гормональную стимуляцию рыб, вводя им Фертагил в дозе 100 мкг/кг внутримышечно, отступив на 1 см вниз от основания спинного плавника и разделяя общий объем препарата поровну на 6 инъекций [9].
Рыб контрольной группы умертвляли путем погружения в глубокий наркоз в растворе MS-222 и декапитации, затем извлекали правый семенник.
Рыб 1-й и 2-й опытных групп оперировали. Операцию рыбам 1-й опытной группы проводили в соответствии с методикой, предложенной Г. И. Прониной и соавторами [10]. Во время операции удаляли правую гонаду.
Рыбам 2-й опытной группы проводили хирургическое вмешательство, используя парасагиттальный хирургический доступ, открывая его по анатомическим ориентирам, для этого нащупывали костный пояс тазовых плавников и открывали доступ, отступая 0,3–0,5 см дорсально и 0,5–1 см краниально, доступ продлевали краниально на
3–3,5 см. В остальном методика проведения оперативного вмешательства соответствовала таковой для 1-й опытной группы. Во время операции удаляли правую гонаду.
В качестве анестетика использовали гвоздичное масло в дозе 0,2 мл/л воды. Анестезию проводили непосредственно перед операцией в емкостях объемом 5 л по общепринятой методике [4].
Извлечение спермы из семенника проводили общепринятым способом [11].
Оценивали качество спермы по следующим показателям: органолептические свойства, концентрация спермиев в 1 мл спермы, время подвижности спермиев (50 % подвижности и наступление полной неподвижности), доля живых спермиев. Концентрация спермиев определялась с помощью спектрофотометра. Подвижность оценивали микроскопически, соединяя на предметном стекле каплю воды и каплю спермы для активации спермиев, временем начала отсчета считали момент соединения капель. Долю живых спермиев оценивали микроскопически в мазках, окрашенных 5 %-м водным раствором эозина [12].
Рыб в послеоперационном периоде рассаживали индивидуально в емкости объемом 100 л, объединенные в единую установку замкнутого водообеспечения, и устанавливали за ними наблюдение: в течение недели после операции – ежедневно 3 раза в день, затем на протяжении 2 недель – ежедневно 1 раз в день. Во время наблюдения оценивали скорость заживления швов, а также наступление неблагоприятных последствий в послеоперационном периоде.
Статистическую обработку проводили с применением t-критерия Стьюдента для нормального распределения с использованием программы Microsoft Office Excel. Достоверными считались различия при p < 0,05.
Результаты исследований
Непосредственно перед проведением хирургического вмешательства был проведен клинический осмотр рыб контрольной и обеих опытных групп, по результатам которого не было выявлено каких-либо отклонений в состоянии здоровья рыб, что позволяет заключить, что к моменту проведения хирургического вмешательства все рыбы были клинически здоровы. Данные о результатах хирургического вмешательства представлены в таблице.
Результаты проведения хирургического вмешательства по извлечению гонады
The results of surgical intervention to extract the gonad
|
Показатель |
Группа |
||
|
Контрольная |
Опытная 1 |
Опытная 2 |
|
|
Число особей, гол. |
5 |
||
|
Живая масса, г |
2 111 ± 78 |
2 101 ± 74 |
2 030 ± 52 |
|
Время проведения операции, с |
404 ± 15* |
1 618 ± 36 * |
1 235 ± 71* |
|
Масса удаленной гонады, г |
8,76 ± 0,53 |
9,04 ± 0,46 |
8,63 ± 0,40 |
|
Выжило к концу операции: |
|
|
|
|
гол. |
0 |
5 |
5 |
|
% |
0 |
100 |
100 |
|
Выжило в течение 2 мес после операции: |
|
|
|
|
гол. |
0 |
5 |
5 |
|
% |
0 |
100 |
100 |
|
Срок заживления кожного шва, сут |
– |
18 ± 1 |
19 ± 1 |
* Различия между группами достоверны при p < 0,05.
Достоверные различия в массе удаленной гонады между группами отсутствуют (см. табл.), что говорит об отсутствии влияния препарата для наркоза и иных переменных факторов на семенник. Качество спермы, полученной от рыб контрольной, 1 и 2 опытных групп, по исследованным показателям не имело достоверных различий. Во всех пробах содержалось незначительное количество крови, попадающей в сперму (рис.).
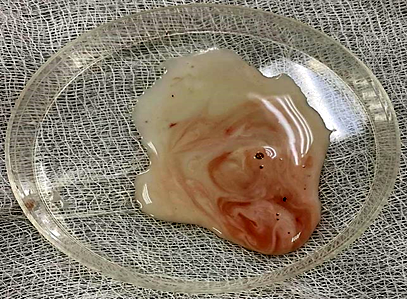
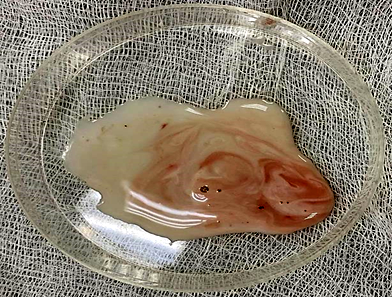
a б
Сперма, полученная от самцов африканского клариевого сома классическим методом измельчения семенника:
a – 1 опытная группа; б – 2 опытная группа
Sperm obtained from males of the African catfish by the classical method of crushing the testis:
a – 1 experimental group; б – 2 experimental group
Объем полученной из семенников спермы составлял от 10,3 до 13,2 мл с концентрацией спермиев в среднем (116,13 ± 3,61) · 106 мл–1. Доля жизнеспособных спермиев во всех пробах превышала 75 %, что говорит о хорошем качестве полученной спермопродукции.
Достоверные различия наблюдались во времени проведения вмешательства. Достоверно наиболее быстрым способом получения гонады являлся посмертный, достоверно наиболее долгим – извлечение гонады через срединный разрез брюха.
Уменьшение продолжительности вмешательства при использовании парасагиттального доступа в сравнении со срединным доступом объясняется приближением угла оперативного доступа, состоящего из угла наклона оси операционного действия и угла наклона оси наблюдения, к 90°. Применение парасагиттального доступа позволяло лучше визуализировать оперируемый орган, т. к. зона доступа оказывалась над ним. При организации доступа по срединной линии приходилось вначале отодвигать внутренние органы и лишь затем, при помощи рук, выводить в операционную рану семенник.
Достоверные различия в скорости заживления хирургических швов между 1 и 2 опытными группами отмечены не были. Воспалительный процесс при заживлении кожного шва проявлялся с умеренной силой, не переходя в гиперэргическое воспаление. Никаких побочных явлений, таких как нагноение шва, развитие перитонита и т. д., не отмечалось. Рыбы в течение срока восстановления после операции и дальнейшего заживления шва чувствовали себя удовлетворительно, начинали питаться на 2–3 день после хирургического вмешательства.
Таким образом, использование парасагиттального доступа позволяет сократить время хирургического вмешательства по извлечению гонады африканского клариевого сома с 27 до 20,5 мин без иных существенных различий, что благоприятно отражается на общей скорости работы и позволяет обработать большее количество рыб за смену. Наряду с безопасностью погружения рыб в наркоз с помощью гвоздичного масла на длительный срок, показанной в 1 опыте, это позволяет ставить прижизненное получение гонад «на поток».
Заключение
Таким образом, для получения спермы самцов клариевого сома для искусственного воспроизводства целесообразно применять технику гонадэктомии с открытием парасагиттального операционного доступа. Использование парасагиттального доступа позволяет сократить трудозатраты на проведение хирургического вмешательства и осуществлять гонадэктомию у 1 рыбы в среднем за 20,6 ± 1,2 мин.
1. Podushka S. B. Ispol'zovanie khirurgicheskikh metodov v rybovodstve [The use of surgical methods in fish farming]. Sostoianie i perspektivy razvitiia presnovodnoi akvakul'tury: doklady Mezhdunarodnoi nauchno-prakticheskoi konferentsii (Moskva, VVTs, 5–6 fevralia 2013 g.). Moscow, Izd-vo RGAU MSKhA im. K. A. Timiriazeva, 2013. P. 393-396.
2. Kucharczyk D., Kucharczyk D. J., Nowosad J., Omirzhanova N. Optimization of artificial insemination outcomes of African catfish (Clarias gariepinus) with differing hatchery conditions. Animal reproduction science, 2019, vol. 211, p. 106222.
3. Iushkova Iu. A. Biotekhnika vosproizvodstva i vyrashchivanie molodi klarievogo soma v rezhime politsikla v usloviiakh ustanovki s zamknutym vodoobespecheniem. Avtoreferat dissertatsii … kand. s.-kh. nauk [Biotechnics of reproduction and rearing of juvenile clary catfish in polycycle mode in an installation with closed water supply. Abstract of the dissertation ... candidate of Agricultural Sciences]. Orel, 2009. 24 p.
4. Petrushin A. B., Maslova N. I., Vlasov V. A., Labenets A. V., Petrushin V. A., Smolin V. V., Pronina G. I., D'iakonov A. N. Sbornik metodik po razvedeniiu i vyrashchivaniiu obyknovennogo (Silurus glanis L.) i klarievogo (Clarias gariepinus) somov: instruktivno-metodicheskoe izdanie [Collection of methods for breeding and growing common (Silurus glanis L.) and Clarias gariepinus (Clarias gariepinus) catfish: instructional and methodical publication]. Moscow, Izd-vo RGAU-MSKhA im. K. A. Timiriazeva, 2012. 80 p.
5. Pronina G. I., Petrushin A. B. Techniques for in vivo extraction of gonads of male European catfish (Silurus glanis) for the artificial reproduction. Aquaculture, Aquarium, Conservation & Legislation – International Journal of the Bioflux Society, 2019, vol. 12 (4), pp. 1316-1322.
6. Siwicki A., Jeney Z. Surgical intervention in wels (Silurus glanis L.) during artificial propagation. Aquacultura Hungarica, 1985, vol. 5, pp. 55-58.
7. Romanova E. M., Liubomirova V. N., Romanov V. V., Mukhitova M. E. Innovatsionnye podkhody k poluche-niiu polovykh produktov afrikanskogo soma v basseinovoi akvakul'ture [Innovative approaches to obtaining sexual products of African catfish in basin aquaculture]. Vestnik Ul'ianovskoi gosudarstvennoi sel'skokhoziaistvennoi akademii, 2017, no. 92, pp. 1-6.
8. Diyaware M. Y., Haruna A. B., Abubakar K. A. De-termination of testes regeneration period for African cat-fish (Clarias anguillaris) after milt (semen) collection through ablation. Current Research Journal of Biological Sciences, 2010, vol. 2 (6), pp. 375-379.
9. Panteleev A. A., Pronina G. I., Sedletskaia E. S. Gormonal'naia stimuliatsiia samtsov klarievogo soma dlia prizhiznennogo otbora spermy v tseliakh iskusstvennogo vosproizvodstva [Hormonal stimulation of male clary catfish for in vivo sperm selection for artificial reproduction]. Rybovodstvo i rybnoe khoziaistvo, 2023, no. 11, pp. 756-764.
10. Pronina G. I., Panteleev A. A., Susova E. E. Prizhiznennoe poluchenie i otsenka spermy samtsov klarievogo soma dlia iskusstvennogo vosproizvodstva [Lifetime production and evaluation of sperm from male clary catfish for artificial reproduction]. Rybovodstvo i rybnoe khoziaistvo, 2021, no. 11 (190), pp. 32-41.
11. Vlasov V. A., Zav'ialov A. P., Esavkin Iu. I. Rek-omendatsii po vosproizvodstvu i vyrashchivaniyu klarievogo soma s ispol'zovaniem ustanovok s zamknutym tsiklom vodoobespecheniia [Recommendations for the reproduction and cultivation of clarium catfish using closed water supply systems]. Moscow, Rosinformagrotekh Publ., 2010. 48 p.
12. Shatokhina I. S., Kuznetsova V. S. Issledovanie eiakuliata: uchebnoe posobie [Ejaculate research: a study guide]. Moscow, MONIKI Publ., 2014. 20 p.
















