Россия
Россия
Условия обитания гидробионтов в Волго-Каспийском морском судоходном канале определяются высоким уровнем комплексной многофакторной антропогенной нагрузки. Являясь звеном единой международной транспортной системы, канал служит инвазионным коридором расселения чужеродных организмов, включая паразитов. Изучена фауна многоклеточных паразитов Perca fluviatilis (Perciformes) на участке канала. Зарегистрировано 6 таксонов паразитических организмов. Нематода Eustrongylides excisus занимает доминирующее положение в фауне макропаразитов P. fluviatilis. Обнаружена чужеродная трематода Apophallus muehlingi, ассоциированная с моллюском-вселенцем Lithoglyphus naticoides, паразит имеет статус вида-содоминанта. Специфичный паразит, широко распространенный в популяциях окуневых рыб в дельте Волги, – Apophallus donicus – не зарегистрирован. Высокая степень инвазии окуня A. muehlingi в течение трехлетнего периода исследований свидетельствует об устойчивости паразитарной подсистемы «A. muehlingi – P. fluviatilis», ранее не характерной для данного вида хозяев в низовьях Волги. В настоящее время сложились более благоприятные условия для инвазии окуня A. muehlingi, чем A. donicus, на отдельных участках дельты Волги. Таким образом, обнаружены структурные изменения в паразито-хозяинных системах трематод р. Apophallus, которые проявляются в виде частичной перестройки видовой и гостальной структуры фауны макропаразитов P. fluviatils на исследованном участке реки. Подобная ситуация определяется причинами в большей степени антропогенного характера – изменениями условий обитания хозяев и паразитов, обусловленными совокупностью колебаний уровня Каспийского моря и сброса Волгоградской ГЭС, интенсивным судоходством (большой объем грузоперевозок) и высокой рыбопромысловой нагрузкой. Наиболее вероятным значимым дополнительным фактором изменений в характере заражения P. fluviatils трематодами р. Apophallus в настоящее время является снижение запасов популяций некоторых массовых видов карповых рыб – вторых промежуточных хозяев A. muehlingi, для которых паразит определен как специфичный.
Perca fluviatilis, биологические инвазии, фауна многоклеточных паразитов, Apophallus muehlingi, Apophallus donicus, Волго-Каспийский морской судоходный канал, дельта Волги
Введение
Дельта реки Волги – динамичный природный комплекс, состояние и гидрологический режим которого зависят от множества факторов: изменений климата, колебаний уровня Каспийского моря и сброса Волгоградской ГЭС. Экосистемы дельты испытывают комплексное многофакторное антропогенное воздействие, включающее коммунальное и промышленное водоснабжение, влияние нефтегазового комплекса, гидроэнергетику, развитие рыбного и сельского хозяйства, водного транспорта и высокую рыбопромысловую нагрузку [1]. Гидрографическая сеть дельты Волги является одной из самых разветвленных в мире. Главный рукав дельты – система Бахтемира, продолжением стока которого служит Волго-Каспийский морской судоходный канал (ВКМСК) – основной судоходный путь из Волги в Каспийское море. Канал является единственной глубоководной артерией, соединяющей Каспийское море с внутренними водными путями Волги и далее – с Азово-Черноморским, Балтийским и Северным морскими бассейнами, а также основным звеном Международного транспортного коридора «Север – Юг» в российском секторе Каспия [2]. Строительство и функционирование судоходных каналов, сброс судовых балластных вод, объединение водных путей в единую систему становятся причинами трансформации среды обитания организмов, приводящей к нарастанию проблемы биоинвазий. Инвазии чужеродных видов являются важным фактором, обуславливающим радикальные перестройки структуры водных и наземных экосистем и их функционирование [3].
Исследования дельты Волги представляют значительный интерес в паразитологическом аспекте. Динамика колебаний уровня Каспийского моря и вмешательство человека в ход естественных процессов приводят к существенным перестройкам биоценозов дельты. Подобные изменения прямо или косвенно отражаются на численности, составе, структуре
и экологических связях популяций хозяев и, как следствие, на фауне их паразитов [4]. Антропогенная нагрузка на экосистемы становится все более значимым фактором, определяющим распространение паразитических организмов. Система межбассейновых каналов и водохранилищ превратила Волгу в крупнейший транзитный водный путь, обусловивший расширение ареалов и проникновение гидробионтов и их паразитов из соседних бассейнов.
В настоящее время в бассейне Волги зарегистрировано 47 чужеродных видов паразитов рыб, в том числе этим инвазионным коридором воспользовалось 16–17 видов паразитов, расширивших ареал в дельте Волги [5]. Патогенные виды паразитов, имеющие эпизоотологическое значение, являются регуляторами численности рыб, могут представлять опасность для млекопитающих, угрозу здоровью человека. Чужеродные трематоды р. Apophallus отмечены в дельте Волги с конца 1970 – начала 1980-х гг.: Apophallus muehlingi (Jagerskiold, 1899) является возбудителем апофаллеза у карповых рыб, Apophallus donicus (Skrjabin & Lindtrop, 1919) = Rossicotrema donicum Skrjabin & Lindtrop, 1919 вызывает россикотремоз у молоди окуневых, инвазия данными видами может приводить к массовому заражению и гибели молоди рыб [6].
Целью работы явилось изучение степени инвазии массового промыслового вида – Perca fluviatilis Linnaeus, 1758 чужеродными трематодами р. Apophallus на участке ВКМСК. Задачи
исследования:
– определение количественного и качественного состава фауны многоклеточных паразитов P. fluviatilis;
– проведение сравнительного анализа оригинальных и литературных данных о зараженности окуня в дельте Волги.
Материал и методика исследования
Материал для работы собран на левобережном участке в течение 3 лет в одной точке акватории ВКМСК (в районе 12-й верхней жилки). Отловлено поплавочной и донной удочкой с одним крючком 65 экз. окуня (половозрелых, преимущественно одноразмерных, промысловая длина 183–226 мм):
в сентябре 2020 г. – 26 экз., 2021 г. – 19 экз., 2022 г. – 20 экз. Паразитологическое вскрытие рыб, фиксацию, обработку материала производили общепринятыми методами [7]. Обследованы покровы и внутренние органы, полость тела, жабры, плавники, глаза, мускулатура. Видовую идентификацию паразитов проводили при помощи бинокулярного микроскопа Biolar, оснащенного микрофотонасадкой Levenhuk C-Series 5M picsels [8]. Прижизненную окраску паразитов осуществляли раствором бледно-розового цвета нейтрального красного (0,03 мг C15H17ClN4 на 10 мл дистиллированной Н2О). Систематика паразитов приведена в соответствие с сайтом Fauna Europaea (2022). Вид Anisakis schupakovi Mosgovoy, 1951 [8] не идентифицируется по Fauna europeae, вероятно, вследствие разночтения в видовом и родовом определении р. Anisakis [9]. Для количественной характеристики зараженности рыб использовали общепринятые показатели: экстенсивность инвазии (ЭИ), %; индекс обилия (ИО), экз.; интенсивность инвазии (ИИ), экз. Также рассчитывали коэффициент Пирсона, коэффициент Серенсена общности видового состава фауны многоклеточных паразитов окуня.
Результаты и обсуждение
У P. fluviatilis обнаружено 6 таксонов паразитов (5 идентифицировано до вида), относящихся к 2 таксономическим группам: Trematoda – Diplostomum sp., Tylodelphys clavata (von Nordmann, 1832), Ichthyocotylurus variegatus (Creplin, 1825), A. muehlingi; Nematoda – Eustrongylides excisus Jagerskiold, 1909, Camallanus lacustris (Zoega, 1776) (табл. 1).
Таблица 1
Table 1
Видовой состав, локализация, параметры заражения P. fluviatilis многоклеточными паразитами
на участке Волго-Каспийского морского судоходного канала (2020–2022 гг.)
Species composition, localization, parameters of infection of P. fluviatilis with multicellular parasites
in the section of the Volga-Caspian Canal (2020-2022)
|
Вид паразита |
Локализация |
Параметры заражения рыб* |
||
|
2020 г. |
2021 г. |
2022 г. |
||
|
Diplostomum sp. mc |
Хрусталик |
23,08 ± 8,43 0,88 ± 1,88 (1–6) |
0 |
10,0 ± 6,7 0,35 ± 1,18 (2–5) |
|
T. clavata mc |
Стекловидное тело |
26,92 ± 8,87 13,46 ± 27,18 (8–127) |
21,05 ± 9,61 5,0 ± 11,47 (12–44) |
20,0 ± 8,94 3,05 ± 2,88 (8–26) |
Окончание табл. 1
Ending of table 1
|
Вид паразита |
Локализация |
Параметры заражения рыб* |
||
|
2020 г. |
2021 г. |
2022 г. |
||
|
I. variegatus mc |
Стенка |
11,54 ± 6,39 1,5 ± 5,34 (4–27) |
15,79 ± 8,59 1,16 ± 3,35 (4–14) |
15,0 ± 7,98 1,1 ± 2,88 (5–11) |
|
A. muehlingi mc |
Жаберные крышки, |
69,23 ± 9,23 15,96 ± 37,77 (2–192) |
73,68 ± 10,38 20,42 ± 36,33 (2–136) |
75,0 ± 9,68 19,5 ± 30,61 (4–116) |
|
E. excisus larvae |
Полость тела, мускулатура, стенка кишечника |
84,62 ± 7,22 15,85 ± 14,31 (1–44) |
84,21 ± 8,59 12,26 ± 12,81 (2–47) |
80,0 ± 8,94 10,35 ± 13,01 (3–51) |
|
C. lacustris |
Кишечник |
53,85 ± 9,97 1,19 ± 1,54 (1–6) |
36,84 ± 11,37 1,21 ± 2,04 (1–7) |
30,0 ± 10,25 0,9 ± 1,61 (2–6) |
* В числителе – ЭИ, %; в знаменателе – ИО, экз.; в скобках – ИИ, экз.
В фауне макропаразитов P. fluviatilis доминирует нематода E. excisus (см. табл. 1), широко распространенная у рыб в низовьях Волги [10, 11]. Содоминантом выступает трематода A. muehlingi (рис.), для которой отмечены высокая экстенсивность инвазии и максимальные, по сравнению
с другими видами, значения индекса обилия и интенсивности инвазии (см. табл. 1).
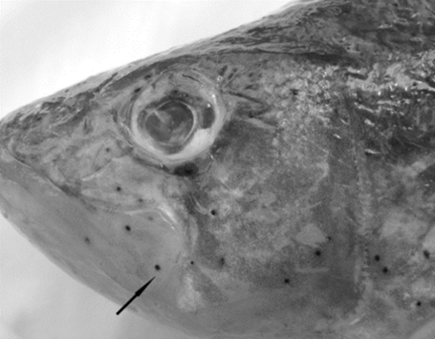
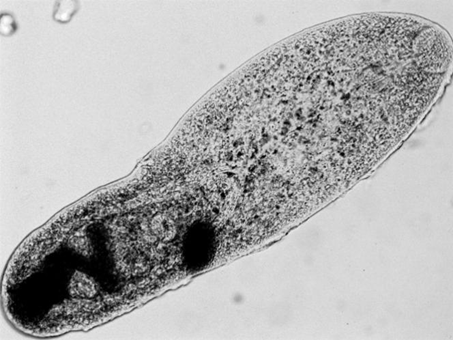
а б
A. muehlingi: а – метацеркарии на челюстях и жаберных крышках P. fluviatilis;
б – общий вид (L = 0,57 мм)
A. muehlingi: а – metacercaria on the jaws and opercle of P. fluviatilis;
б – general view (L = 0.57 mm)
Все обнаруженные у P. fluviatilis паразиты имеют сложный жизненный цикл. Для всех видов трематод окунь является дополнительным хозяином, окончательными хозяевами являются рыбоядные птицы [8]. Для нематоды E. excisus окунь служит дополнительным хозяином, облигатный окончательный хозяин – рыбоядные птицы, факультативный – каспийская нерпа [12]. В жизненном цикле нематоды C. lacustris окунь играет роль окончательного хозяина. Подавляющая часть обнаруженных видов паразитов (T. clavata, I. variegatus, A. muehlingi, E. excisus, возможно, Diplostomum sp.) являются возбудителями ихтиопаразитозов, в том числе зарегистрированы виды, способные заканчивать жизненный цикл у млекопитающих и/или человека: E. excisus, A. muehlingi [6, 9]. Сходство видового состава макропаразитов P. fluviatilis в разные годы для выборок, несколько различающихся по количеству особей, статистически достоверно по критерию Пирсона на высоком уровне значимости (r = 0,68, df = 1, p < 0,0001).
У окуня за 20-летний период времени, по литературным источникам (табл. 2), отмечено 13 таксонов многоклеточных паразитов (10 идентифицировано до вида): Monogenea – Ancyrocephalus percae Ergens, 1966; Trematoda – Diplostomum sp., T. clavata, Paracoenogonimus ovatus Katsurada, 1914, A. donicus, Clinostomum complanatum (Rudolphi, 1810); Nemato-
da – E. excisus, A. schupakovi, C. lacustris, Camallanus sp.; Acanthocephala – Corynosoma strumosum (Rudolphi, 1802), Echinorhynchus cinctulus Porta, 1905; Crustacea – Lernanthropsis sp.
Таблица 2
Table 2
Видовой состав многоклеточных паразитов P. fluviatilis и экстенсивность инвазии
Species composition of multicellular parasites P. fluviatilis and parasite prevalence
|
Видовой состав многоклеточных паразитов* |
ЭИ, % |
|
Литературные данные** (2000–2020 гг.) |
|
|
E. excisus larvae |
52–100 |
|
А. schupakovi larvae |
22–100 |
|
P. ovatus mc |
16,00–100,00 |
|
A. donicus mc |
1,45–95,00 |
|
Diplostomum sp. mc |
50 |
|
T. clavata mc |
50 |
|
C. lacustris |
50 |
|
E. cinctulus |
40 |
|
Camallanus sp. |
4–26 |
|
C. strumosum larvae |
0,61–2,50 |
|
A. percae |
+*** |
|
C. complanatum mc |
+ |
|
Lernanthropsis sp. |
+ |
|
Оригинальные данные (среднее значение за 2020–2022 гг.) |
|
|
E. excisus larvae |
82,94 |
|
A. muehlingi mc |
72,64 |
|
C. lacustris |
40,23 |
|
T. clavata mc |
22,66 |
|
Diplostomum sp. mc |
11,03 |
|
I. variegatus mc |
14,11 |
* Виды паразитов в столбцах расположены по степени доминирования; ** данные [10, 11, 13–20]; ***(+) – паразит обнаружен, данные о количественных характеристиках инвазии отсутствуют.
Максимальные значения ЭИ отмечены для E. excisus, А. schupakovi, P. ovatus, A. donicus.
Коэффициент общности видового состава Серенсена в 2020–2022 гг. составляет 90 %, а при сравнении оригинальных данных за 2020–2022 гг.
с литературными (2000–2020 гг.) – 47 %. Сходство состава паразитов P. fluviatilis обусловлено наличием 4 типичных паразитов окуня дельты Волги (Diplostomum sp., T. clavata, C. lacustris, E. excisus). Различия определяются дополнением состава паразитов на исследованном участке трематодами A. muehlingi и I. variegatus, а также отсутствием ряда таксонов: узкоспецифичного A. percae и традиционно приуроченного, считающегося специфичным окуню A. donicus, широкоспецифичных P. ovatus, C. complanatum, E. cinctulus, а также солоноватоводных/«морских» видов – C. strumosum, А. schupakovi, Lernanthropsis sp. (см. табл. 2).
Трематоды A. muehlingi и A. donicus распространены в средних широтах Палеарктики, от Западного побережья Атлантики до Приморья и Камчатки. Паразиты являются чужеродными для бассейна Волги, их распространение связано с проникновением в дельту по Волго-Донскому каналу из Азово-Черноморского бассейна первого промежуточного хозяина – моллюска Lithoglyphus naticoides (Pfeiffer, 1828) [6]. Успешной реализации жизненных циклов A. muehlingi и A. donicus в дельте Волги способствует изобилие мест обитания, высокая плотность
и разнообразие вторых промежуточных (рыбы многих семейств), резервуарных, окончательных (рыбоядные птицы, млекопитающие, человек) хозяев, в том числе хозяев-интродуцентов [4, 21]. Колонизация A. muehlingi и A. donicus территорий в дельте Волги произошла в исторически короткий период времени, поскольку темпы генезиса трематод оказались сходными, а стохастическая модель, описывающая его динамику, характерна для краткосрочных хроноэкологических процессов [22]. К началу 2000-х гг. A. muehlingi и A. donicus стали ведущими компонентами паразитоценозов дельты Волги и Северного Каспия [4]. Предполагалось, что пространственная и гостальная структура очагов апофаллеза и россикотремоза сформированы, далее возможны только количественные изменения зараженности [22]. Однако более поздние исследования зараженности грызунов в дельте Волги свидетельствуют
о продолжающемся расширении круга окончательных хозяев этих паразитов [21].
В ранге вторых промежуточных хозяев массовое заражение А. muehlingi было отмечено у 16 видов карповых рыб и единичные случаи инвазии 3 видов окуневых, а A. donicus массово инвазировал 4 вида окуневых и единично карповых [4]. Трематода A. muehlingi считается специфичным паразитом карповых рыб, A. donicus традиционно приурочен
к окуневым рыбам [4, 14, 20].
У P. fluviatilis в дельте Волги в 1977–1999 гг. были отмечены оба вида р. Apophallus – доминирующий в его трематодофауне A. donicus и единично встречающийся A. muehlingi [4, 6]. В 2000–2020 гг., по литературным данным [10, 11, 13–20], A. donicus сохранил высокую (до ~ 95 %) ЭИ окуня, A. muehlingi у него не зарегистрирован (см. табл. 2). По нашим данным, зараженность окуня A. muehlingi высока, наблюдается тенденция к увеличению степени инвазии в межгодовом аспекте, вид занимает положение субдоминанта в фауне многоклеточных паразитов P. fluviatils (см. табл. 1, 2). При этом A. donicus, типичный для P. fluviatilis в низовьях Волги, нами не обнаружен. Таким образом, в настоящее время отмечены значительные качественные и количественные изменения на уровне вторых промежуточных хозяев трематод р. Apophallus.
В дельте Волги P. fluviatilis входит в состав массовых жилых видов, составляющих ядро ихтиофауны. Вид является промысловым, состояние популяции окуня стабильно, наблюдается рост численности и промыслового запаса [23]. В то же время численность молоди полупроходных и речных рыб – воблы и леща, поколения которых характеризуются как низкоурожайные, снижается [24], причем снижение урожайности воблы отмечается в течение последних 5 лет [25]. По лещу и группе «прочих пресноводных» наблюдалось снижение вылова [25]. Таким образом, для популяций некоторых массовых видов карповых рыб, являющихся вторыми промежуточными хозяевами A. muehlingi, в дельте Волги отмечена депрессивная ситуация. На это косвенно указывают полученные паразитологические данные по зараженности P. fluviatilis специфичной и неспецифичной трематодами р. Apophallus. Паразиты окуня использованы в работе как своеобразные биологические метки (маркеры), отражающие особенности экологии рыб в изменяющихся условиях среды (в частности, под влиянием высокой антропогенной нагрузки) [26, 27].
Заключение
На локальном участке ВКМСК в результате исследования выявлена высокая степень инвазии P. fluviatils специфичным паразитом карповых рыб – чужеродной трематодой A. muehlingi. Вид имеет статус субдоминанта в фауне макропаразитов окуня. Специфичный паразит окуневых рыб – A. donicus – у P. fluviatils на данном участке дельты Волги не обнаружен. Паразитарные подсистемы с участием трематод р. Apophallus формируются и функционируют в условиях нестабильного гидрологического режима, зависящего от колебаний уровня Каспийского моря и сброса Волгоградской ГЭС, высокого уровня антропогенной нагрузки. К наиболее вероятным причинам изменений в характере заражения P. fluviatils паразитами в настоящее время можно отнести дополнительный фактор – снижение численности некоторых видов карповых рыб, служащих вторыми промежуточными хозяевами A. muehlingi, на фоне стабильного роста численности популяции окуня. Преобразование структуры ихтиоценоза привело к устойчивому функционированию паразитарной подсистемы, образованной специфичным паразитом карповых рыб A. muehlingi и окунем. Значимое положение в ихтиоценозе и экологическая пластичность P. fluviatilis позволили использовать его паразитов – чужеродных трематод р. Apophallus – в качестве биомаркера изменений, начинающихся в экосистеме водоема.
1. Бреховских В. Ф., Островская Е. В. и др. Загрязняющие вещества в водах Волжско-Каспийского бассейна. Астрахань: Издатель Сорокин Роман Васильевич, 2017. 408 с.
2. Бухарицин П. И. Волго-Каспийский морской судоходный канал – от старых принципов к новым идеям // Гидротехника. 2018. Т. 1 (50). С. 76–80.
3. Алимов А. Ф., Богуцкая Н. Г., Орлова М. И. Биологические инвазии в водных и наземных экосистемах: моногр. M.: Т-во науч. изд. KMK, 2004. 436 с.
4. Иванов В. М. Мониторинг, структурные изменения и экологические особенности трематодофауны позвоночных животных дельты Волги и Северного Каспия (фауна, систематика, биология, экология, патогенное значение): дис. … д-ра биол. наук. М., 2003. 323 с.
5. Zhokhov A. E., Pugacheva M. N., Molodozhnikova N. M., Berechikidze I. A. Аlien parasite species of the fish in the Volga river basin: a review of data on the species number and distribution // Russian Journal of Biological Invasions. 2019. V. 10. N. 2. P. 136–152.
6. Бисерова Л. И. Трематоды Apophallus muehlingi и Rossicotrema donicum – паразиты рыб дельты Волги: особенности экологии и ихтиопаразитозы, ими вызываемые: дис. … канд. биол. наук. М., 2005. 168 с.
7. Быховская-Павловская И. Е. Паразиты рыб. Руководство по изучению. Л.: Наука, 1985. 121 с.
8. Определитель паразитов пресноводных рыб фауны СССР. Л.: Наука, 1987. Вып. 149. Т. 3. Паразитические многоклеточные. 583 с.
9. Гаевская А. В. Анизакидные нематоды и заболевания, вызываемые ими у животных и человека. Севастополь: ЭКОСИ-Гидрофизика, 2005. 223 с.
10. Чепурная А. Г., Конеева Г. Я. Оценка паразитологической ситуации в разнотипных водоемах дельты Волги // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2006. № 3 (32). С. 78–82.
11. Конькова А. В., Володина В. В., Воронина Е. А., Терпугова Н. Ю. Эпидемиологическое значение паразитов рыб Волго-Каспийского рыбохозяйственного подрайона (Астраханская область) // Гигиена и санитария. 2020. Т. 99, №. 5. С. 448–454.
12. Володина В. В., Грушко М. П. Инвазионные заболевания каспийского тюленя // Актуальные вопросы ветеринарной биологии. 2012. № 2 (14). С. 25–29.
13. Чепурная А. Г., Конькова А. В. Эпизоотологический мониторинг промысловых рыб дельты Волги // Сб. науч. тр. ГосНИОРХ. СПб.: Изд-во Всерос. науч.-исследоват. ин-та рыб. хоз-ва и океанографии, 2009. Вып. 338. Проблемы ихтиопатологии в начале XXI века (к 80-летию создания лаборатории болезней рыб ФГНУ «ГосНИОРХ»). С. 210–213.
14. Чепурная А. Г. Фауна паразитов рыб в разнотипных водоемах Нижнего Поволжья // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2010. № 1. С. 62–65.
15. Володина В. В., Проскурина В. В., Солохина Т. А., Воронина Е. А., Конькова А. В. Рыбы Волго-Каспийского региона – переносчики возбудителей антропозоонозов // Гигиена и санитария. 2016. Т. 95 (6). С. 517–520.
16. Ларцева Л. В., Володина В. В. Зараженность промысловых видов рыб Волго-Каспийского бассейна личинками гельминтов, опасных для здоровья человека // Тр. Центра паразитологии. М.: Т-во науч. изд. КМК, 2016. T. XLIX: Фауна и экология паразитов. С. 59–60.
17. Терпугова Н. Ю., Конькова А. В., Володина В. В., Воронина Е. А. К вопросу о паразитах окуневых рыб дельты Волги // Современные проблемы паразитологии и экологии. Чтения, посвящ. памяти С. С. Шульмана: сб. тр. Всерос. науч. конф. с междунар. участием. Тольятти: Полиар, 2018. С. 285–292.
18. Конькова А. В., Солохина Т. А., Терпугова Н. Ю. Паразиты молоди рыб дельты реки Волга // Паразитология. 2019. Т. 53, №. 6. С. 483–505.
19. Степаненко Е. А., Каниева Н. А., Волкова И. В., Попова К. С. Сравнительная характеристика паразитарной чистоты окуня обыкновенного (Perca fluviatilis L.) из естественных водоемов разного типа Астраханской области // Современные проблемы и перспективы развития рыбохозяйственного комплекса: материалы VII Науч.-практ. конф. молодых ученых с междунар. участием. Астрахань, 2019. С. 449–455.
20. Попова К. С., Каниева Н. А., Степаненко Е. А. Паразитофауна рыб семейства Percidae в водоемах Астраханской области // Экология и природопользование: материалы Междунар. науч.-практ. конф. Назрань: ООО «КЕП», 2020. С. 147–151.
21. Ivanov V. M., Semenova N. N., Kalmykov A. P., Fedorovich V. V., Parshina O. Y. Structural changes of helminthofauna in rodents caused by introduction and settlement of animals in the Volga Delta // Arid Ecosystems. 2011. V. 1. N. 4. P. 246–250.
22. Судариков В. Е., Фрезе В. И., Иванов В. М., Семенова Н. Н., Ломакин В. В. Закономерности генезиса инвазии трематод в дельте реки Волги и Северном Каспии // Сибир. зоолог. конф., посвящ. 60-летию Ин-та систематики и экологии животных СО РАН: тез. докл. Новосибирск, 2004. С. 405–406.
23. Ткач В. Н., Никифоров С. Ю. Промысел полу-проходных, речных рыб, видовой состав уловов в юж-ном рыбохозяйственном районе Волжско-Каспийского рыбохозяйственного бассейна в ретроспективе и совре-менный период // Вестн. рыбохозяйств. науки. 2019. Т. 6. №. 2 (22). С. 16–26.
24. Доклад об экологической ситуации в Астраханской области в 2019 году. Астрахань, 2020. 218 с.
25. Доклад об экологической ситуации в Астраханской области в 2022 году. Астрахань, 2023. 304 с.
26. Halmetoja A., Valtonen E. T., Koskenniemi E. Perch (Perca fluviatilis L.) parasites reflect ecosystem conditions: a comparison of a natural lake and two acidic reservoirs in Finland // International Journal for Parasitology. 2000. V. 30. N. 14. P. 1437–1444.
27. Valtonen E. T., Holmes J. C., Aronen J., Rautalahti I. Parasite communities as indicators of recovery from pollution: parasites of roach (Rutilus rutilus) and perch (Perca fuviatilis) in central Finland // Parasitology. 2003. V. 126. P. 43–52.
















