Россия
Исследована возможность частичной замены рыбной муки на муку из люцерны в кормах для ав-стралийского красноклешневого рака (Cherax quadricarinatus). Раков содержали в аквариумах объемом 150 л при температуре 24–26,5 °С. Контрольную группу кормили гранулированным кормом, предназначенным для осетровых рыб. В экспериментальных кормах рыбная мука была частично заменена на муку из люцерны. В один из вариантов корма был добавлен ферментный препарат – натузим. Длительность эксперимента составила 45 суток. Кормление проводили вручную 2 раза в сутки, в утренние и вечерние часы. Корм вносили порционно, следя за поедаемостью. Норма кормления составляла 2–4 % от массы тела. Проанализированы морфометрические, линейно-весовые и биохимические показатели Cherax quadricarinatus, гемоцитарная формула. Установлено, что рост раков на кормах с высоким и низким содержанием животного протеина происходил почти одинаково, что говорит о хорошей перспективе использования муки из люцерны в кормах с целью их удешевления за счет снижения количества рыбной муки. Для лучшего усвоения растительных компонентов корма рекомендовано добавление в корма комплексного ферментного препарата натузим. Отмечено положительное влияние кормов с добавлением муки из люцерны на биохимические показатели и гемоцитарную формулу австралийского красноклешневого рака. Экспериментальные корма обеспечили достаточное содержание в гемолимфе общего белка, липидов, глюкозы, фосфора и кальция. Обнаружено снижение содержания мочевины.
австралийский красноклешневый рак, мука из люцерны, гемолимфа, холестерин, триглицериды, натузим
Введение
Австралийский красноклешневый рак (Cherax quadricarinatus) является представителем отряда десятиногих ракообразных, одним из преимуществ выращивания которого является быстрый набор товарной массы [1]. В последнее время значительно возросло количество хозяйств, занимающихся товарным выращиванием австралийского рака, при этом рецепты и промышленное производство комбикормов для этого вида ракообразных в Российской Федерации отсутствуют [2, 3]. Предприятиям приходится использовать коммерческие корма, предназначенные для других гидробионтов, например осетровых или лососевых. Однако это не является экономически оправданным. Австралийский рак является всеядным видом, что позволяет включать в состав кормов при его товарном выращивании широкий спектр ингредиентов животного и растительного происхождения [4, 5]. В процессе развития аквакультуры тропических ракообразных, включая австралийского красноклешневого рака, выполнены многочисленные исследования эффективного состава искусственных кормов [6–8]. Особое внимание было уделено кормлению в условиях замкнутого водоснабжения (УЗВ), т. к. в этом случае раки лишены возможности пополнить свой рацион за счет использования естественной кормовой базы [3]. Рекомендовано корма с 25 %-м содержанием протеина использовать для выращивания австралийского красноклешневого рака в прудах с естественной кормовой базой, а рецепты кормов с содержанием белка 35 % и более – для выращивания в УЗВ [8]. Для культивирования австралийского красноклешневого рака необходимо использовать тонущие гранулы, содержащие 30–45 % протеина, 5–8 % жира, 20–40 % углеводов, 1–2 % хитина и витаминно-минеральный премикс [9]. Проведенные ранее исследования о возможности замены рыбной муки различными растительными источниками белка и липидов показали, что для австралийского красноклешневого рака подходят диеты, содержащие недорогие растительные ингредиенты, без ущерба для выживания и роста [9]. По некоторым данным, замена до 50 % белка рыбной муки соевой в рационе дает лучший рост при минимальных затратах [6]. Зеленый корм – это отличный источник легкодоступных питательных веществ [10], особенно в питании ракообразных, т. к. 70 % их рациона составляет именно растительная пища. В муке из люцерны содержится до 25 % легкопереваримых азотистых веществ со всем спектром незаменимых аминокислот, а также каротин, витамины D, Е и В, большое количество калия и кальция. Цель работы – изучение перспектив использования муки из люцерны в составе кормов для австралийского красноклешневого рака.
Материалы и методы исследования
Исследования проводились в научно-испытательной лаборатории ихтиопатологических исследований и комплексной апробации препаратов Астраханского государственного университета им. В. Н. Татищева в летне-осенний период 2022 г. Объектом исследования являлся австралийский красноклешневый рак средней массой 36,5 г, в количестве 31 экземпляр, завезенный с крестьянско-фермерского хозяйства, расположенного в п. Кировский Камызякского района Астраханской области. Раков содержали в аквариумах объемом 150 л, оснащенных системой мониторинга состояния гидробионтов. Температуру воды в аквариумах поддерживали в пределах 24–26,5 °С.
Раков делили на 3 группы: контроль; раки, получавшие экспериментальный вариант корма № 1; раки, получавшие экспериментальный вариант кор-ма № 2. Контрольную группу австралийских раков кормили гранулированным кормом, предназначенным для осетровых рыб. В состав корма входили следующие компоненты: мука рыбная, кровяная, мясная, мясокостная, пшеничный зародыш, глютен, экструдаты зерновых и шротов, минералы, витамины, рыбий жир, биофлавоноиды, антиоксиданты, растительное масло, фитаза.
На основании литературных данных о пищевых потребностях, питательной ценности и использовании различных компонентов в составе комбикормов для австралийского рака были разработаны две рецептуры экспериментальных кормов. Состав кормов подбирали из тех соображений, чтобы максимально удешевить корм, т. к. готовые коммерческие корма имеют достаточно высокую стоимость и их использование при промышленном выращивании раков не имеет экономической перспективы и целесообразно только для кормления ракообразных в аквариумной культуре [11]. В состав рецептур входили компоненты животного и растительного происхождения в разном процентном соотношении: рыбная мука, рыбий жир, пшеничная мука, мука из люцерны, кукурузный глютен, вареная морковь, кальций, премикс. В вариант корма № 1 дополнительно был добавлен комплексный ферментный препарат натузим из расчета 350 мг на 1 кг корма. Содержание основных питательных веществ контрольного и экспериментальных вариантов кормов представлены в табл. 1.
Таблица 1
Table 1
Химический состав комбикормов для австралийского красноклешневого рака
Chemical composition of feed for Australian red claw crayfish
|
Корм |
Содержание, % |
||||||
|
Сырой |
Сырой жир |
БЭВ |
Сырая зола |
Клетчатка |
Влага |
Валовая энергия, МДж/кг |
|
|
Контроль |
42,0 |
12,0 |
25,0 |
9,0 |
2,8 |
9,0 |
19,0 |
|
Вариант 1 |
36,0 |
6,9 |
42,09 |
6,1 |
7,8 |
3,61 |
17,1 |
|
Вариант 2 |
35,1 |
6,6 |
41,2 |
6,08 |
7,7 |
3,61 |
17,0 |
Технологическая схема приготовления экспериментальных партий кормов включала в себя следующие этапы: подготовка компонентов, их измельчение, производство гранул методом влажного прессования, высушивание в сушилке, нанесение жира методом вакуумного напыления. Готовые гранулы размером 4–4,5 мм после вакуумного нанесения на них жира представляли собой полностью готовый продукт, который и скармливали ракам. Анализ состава комбикормов проводили по схеме, разработанной при проведении зоотехнических и биохимических анализов кормов для ракообразных.
Кормление проводили вручную 2 раза в сутки в утренние и вечерние часы. Корм вносили порционно, следя за поедаемостью. Норма кормления составляла 2–4 % от массы тела. Эффективность кормления определяли по основным рыбоводно-биологическим показателям, выживаемости и среднесуточному приросту. Продолжительность эксперимента составила 45 суток. Контроль за темпом роста ракообразных проводили 1 раз в неделю, длину измеряли в начале и в конце эксперимента. При изучении морфобиологических показателей раков был выполнен ряд промеров при помощи штангенциркуля с точностью до 1 мм. Измеряли общую длину, длину цефалоторакса со стороны спины, длину абдомена, длину тельсона, длину рострума с вентральной стороны, диаметр глаза, размер первой пары грудных конечностей. Контрольные взвешивания производили с помощью электронных весов фирмы ГОСМЕТР ВЛТЭ-1100П-В. Эффективность проведенной работы по выращиванию раков определяли на основе анализа изменений массы, длины тела, их абсолютного и среднесуточного прироста, выживаемости. В начале и в конце эксперимента были проанализированы биохимические показатели и гемоцитарная формула гемолимфы. Отбор гемолимфы производился прижизненно с помощью шприца из вентрального синуса. В качестве антикоагулянта использовали 5 %-й раствор цитрата натрия (1 : 4). Перед проведением биохимического анализа гемолимфу центрифугировали 15 мин при 4 000 об/мин. Мазки гемолимфы изготавливали сразу после ее отбора, затем просушивали на воздухе и окрашивали эозином и метиленовым синим по Май – Грюнвальду. Затем мазки подвергали микроскопическому анализу (Olympus CX 43, Япония; камера ADF live 4K, Китай) для дифференцированного подсчета гемоцитов [12]. Биохимический анализ гемолимфы проводили на автоматическом биохимическом анализаторе (Сhem well 2902 v+, США) и спектрофотометре («Эковью УФ-1200», Россия) с использованием готовых наборов реагентов («Агат», «Ольвекс диагностикум», Россия). Анализировали следующие показатели: содержание общего белка, альбумина, холестерина, триглицеридов, глюкозы, фосфора, кальция, мочевины, активность АСТ и АЛТ. Полученные данные были подвергнуты статистической обработке на предмет достоверности различий (при p < 0,05). При нормальном распределении данных использовался параметрический критерий Стьюдента, при распределении, отличном от нормального – непараметрический критерий Манна – Уитни. Цитологические и биохимические данные представлены как среднее значение плюс-минус стандартная ошибка среднего (Х ± Sx).
Результаты и обсуждение
При выращивании ракообразных важно учитывать абиотические факторы и проводить контроль состояния параметров водной среды. Для австралийского красноклешневого рака оптимальные температурные показатели находятся в интервале 25–28 °С. Температура воды в аквариумах в период проведения эксперимента составляла 24–26,5 °С, рН – 7,2–7,7, содержание растворенного в воде кислорода – 5,0–7,3. Содержание в воде нитритов, нитратов, аммонийного азота и свободного аммиака не превышало технологической нормы [3] (табл. 2).
Таблица 2
Table 2
Параметры качества воды при выращивании австралийского красноклешневого рака
в аквариумах аквариальной системы мониторинга состояния гидробионтов
Water quality parameters for growing Australian red claw crayfish
in aquariums of the aquarium system of monitoring the state of hydrobionts
|
Параметр |
Диапазон колебаний |
Технологическая норма |
Кратковременно |
|
рН |
7,2–7,7 |
6,8–7,2 |
6,8–8,5 |
|
Содержание растворенного в воде кислорода, мг/л |
5,0–7,3 |
5,0 |
4,0 |
|
Нитриты, мг N/л |
0–0,1 |
до 0,1–0,2 |
до 1,0 |
|
Нитраты, мг N/л |
22,7–54,8 |
до 60 |
100 |
|
Аммонийный азот, мг N/л |
0,01–0,02 |
2–4 |
до 10 |
|
Аммиак свободный, мг N/л |
до 0,0013 |
до 0,05 |
до 0,1 |
Исследование воды в аквариумах за время проведения эксперимента по выращиванию австралийского красноклешневого рака не выявило колебаний основных показателей. Средние значения не превышали ПДК, что говорит об отсутствии негативного влияния на исследованные объекты. Морфометрические показатели молоди раков в контрольном и экспериментальных вариантах имели схожую динамику. Прирост длины происходил во всех группах и составил 0,48 см в контроле, 0,6 и 0,49 см в 1-м и 2-м вариантах соответственно, что говорит о хорошем качестве задаваемых кормов. Морфометрические показатели раков представлены в табл. 3.
Таблица 3
Table 3
Морфометрические показатели экспериментального выращивания австралийского
красноклешневого рака, см
Morphometric parameters of the experimental rearing of Australian
red claw crayfish, cm
|
Показатель |
Результаты |
|||||
|
Контроль |
Вариант 1 |
Вариант 2 |
||||
|
Начало |
Конец |
Начало |
Конец |
Начало |
Конец |
|
|
Общая длина |
12,2 ± 2,2 |
12,68 ± 1,09 |
11,3 ± 1,3 |
11,9 ± 1,28 |
11,3 ± 0,5 |
11,79 ± 0,9 |
|
Длина |
5,4 ± 0,9 |
6,0 ± 0,27 |
5,5 ± 0,6 |
6,2 ± 0,61 |
5,5 ± 0,32 |
5,6 ± 0,56 |
|
Длина |
6,85 ± 1,4 |
7,34 ± 0,89 |
5,83 ± 0,8 |
6,32 ± 0,8 |
5,78 ± 0,25 |
6,19 ± 0,45 |
|
Длина |
1,75 ± 0,4 |
2,02 ± 0,18 |
1,79 ± 0,29 |
2,02 ± 0,29 |
1,8 ± 0,27 |
2,0 ± 0,24 |
|
Длина рострума |
1,12 ± 0,5 |
1,46 ± 0,41 |
1,16 ± 0,25 |
1,47 ± 0,24 |
1,0 ± 0,11 |
1,1 ± 0,12 |
|
Диаметр глаза |
0,47 ± 0,08 |
0,47 ± 0,08 |
0,49 ± 0,04 |
0,49 ± 0,04 |
0,49 ± 0,04 |
0,49 ± 0,04 |
|
Первая пара грудных |
6,83 ± 1,2 |
7,3 ± 0,23 |
6,93 ± 0,84 |
7,43 ± 0,82 |
6,5 ± 0,84 |
6,72 ± 0,85 |
На протяжении всего эксперимента условия, определяемые схемой проводимого исследования, сохранялись на одном уровне. Результаты эксперимента можно оценить, если сравнить исследованные показатели в начале эксперимента с конечными результатами, полученными по завершении эксперимента [13]. Результаты экспериментального выращивания австралийского красноклешневого рака представлены в табл. 4.
Таблица 4
Table 4
Результаты экспериментального выращивания
австралийского красноклешневого рака
Results of experimental rearing
of Australian red claw crayfish
|
Показатель |
Результаты |
|||
|
Контроль |
Вариант 1 |
Вариант 2 |
||
|
Период выращивания, сут |
45 |
|||
|
Масса начальная, г |
36,5 ± 13,4 |
36,7 ± 11,8 |
36,4 ± 12,9 |
|
|
Масса конечная, г |
47,7 ± 13,8 |
47,84 ± 12,6 |
46,7 ± 12,9 |
|
|
Абсолютный прирост массы, г |
11,2 |
11,14 |
10,3 |
|
|
Среднесуточный прирост массы, г/сут |
0,25 |
0,23 |
||
|
Среднесуточная скорость роста, % |
0,59 |
0,6 |
0,55 |
|
|
Коэффициент массонакопления, % |
0,02 |
|||
|
Длина начальная, см |
12,2 ± 2,2 |
11,3 ± 1,3 |
11,3 ± 0,5 |
|
|
Длина конечная, см |
12,68 ± 1,09 |
11,9 ± 1,28 |
11,79 ± 0,9 |
|
|
Прирост длины, см |
0,48 |
0,6 |
0,49 |
|
|
Среднесуточный прирост длины, % |
0,01 |
0,013 |
0,01 |
|
|
Исходное количество молоди раков |
12 |
13 |
||
|
Количество молоди раков в конце эксперимента, шт. |
10 |
11 |
10 |
|
|
Выживаемость, % |
83 |
92 |
77 |
|
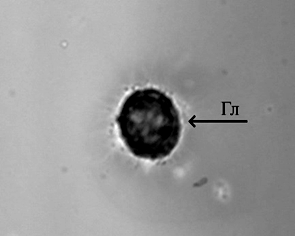
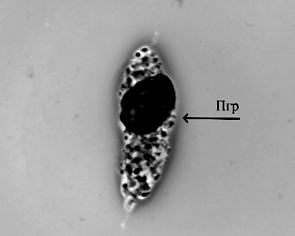
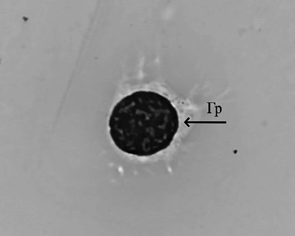
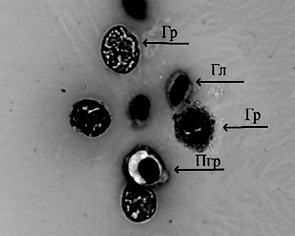
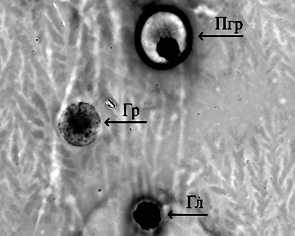
Рост молоди австралийского рака происходил равномерно. Наилучшие показатели были отмечены в группе, получавшей вариант корма № 1, где провели частичную замену рыбной муки на муку из люцерны, с добавлением фермента натузима. В варианте 2 также была произведена замена части рыбной муки на муку из люцерны, однако в данном варианте корма отсутствовал комплексный ферментный препарат, что, вероятно, и отразилось на эффективности переваривания растительной пищи и скорости роста. Однако различия по массе в контрольном и экспериментальных вариантах не были статистически значимы, что говорит о положительных перспективах замены части рыбной муки на муку из люцерны с целью удешевления задаваемых кормов. Самый высокий процент выживаемости раков в ходе эксперимента был отмечен в варианте 1 и составил 92 %. Следует отметить, что основной отход приходился на начало эксперимента и не был связан с кормлением. Отход происходил в период адаптации молоди к новым условиям выращивания (возможно, сказалась транспортировка, изменение гидрохимических показателей, привыкание к искусственным кормам, т. к. на хозяйстве, откуда были привезены раки, использовалась только естественная кормовая база). Рацион питания играет важную роль в физиологическом состоянии раков [14]. Объективным методом контроля физиологического состояния ракообразных является оценка гемоцитарной формулы и биохимических показателей гемолимфы [15]. В табл. 5 отображены данные цитологических и биохимических исследований гемолимфы австралийского красноклешневого рака, проведенных в начале и в конце эксперимента при разных режимах кормления. Ракообразные имеют 3 морфологически различных типа гемоцитов: гиалиноциты, полугранулоциты и гранулоциты (рис.).
Таблица 5
Table 5
Биохимические показатели и гемоцитарная формула гемолимфы
австралийского красноклешневого рака
Biochemical parameters and hemocyte formula of hemolymph
of Australian red claw crayfish
|
Показатели гемолимфы |
Начало |
Конец эксперимента |
|||||
|
Контроль |
1 вариант |
2 вариант |
|||||
|
Гемоцитарная формула |
|||||||
|
Гиалиноциты, % |
12,25 ± 1,31 |
7,67 ± 3,28 |
7,00 ± 0,82 |
15,00 ± 4,04 |
|||
|
Гранулоциты, % |
67,75 ± 3,20 |
69,67 ± 6,23 |
74,50 ± 4,33 |
61,00 ± 2,08 |
|||
|
Полугранулоциты, % |
20,00 ± 3,76 |
22,67 ± 5,81 |
18,50 ± 3,75 |
27,33 ± 5,61 |
|||
|
Биохимические показатели гемолимфы |
|||||||
|
Общий белок, г/л |
48,54 ± 10,84 |
60,16 ± 5,69 |
81,35 ± 12,94 |
114,84 ± 4,74 |
|||
|
Альбумин, г/л |
19,32 ± 6,36 |
14,26 ± 1,66 |
20,06 ± 2,06 |
24,34 ± 0,38 |
|||
|
Холестерин, ммоль/л |
0,72 ± 0,11 |
0,57 ± 0,03 |
0,95 ± 0,02 |
1,05 ± 0,04 |
|||
|
Триглицериды, ммоль/л |
1,18 ± 0,16 |
1,02 ± 0,06 |
0,79 ± 0,13 |
0,95 ± 0,12 |
|||
|
Глюкоза, ммоль/л |
1,03 ± 0,23 |
0,39 ± 0,04 |
0,58 ± 0,05 |
0,71 ± 0,09 |
|||
|
АСТ, ед./л |
32,70 ± 9,86 |
26,80 ± 2,18 |
37,20 ± 5,72 |
34,73 ± 4,46 |
|||
|
АЛТ, ед./л |
20,98 ± 5,43 |
23,30 ± 3,91 |
39,28 ± 5,30 |
37,43 ± 3,38 |
|||
|
Фосфор, ммоль/л |
0,85 ± 0,17 |
0,77 ± 0,06 |
1,04 ± 0,20 |
1,37 ± 0,28 |
|||
|
Кальций, ммоль/л |
7,07 ± 0,13 |
4,90 ± 0,82 |
5,73 ± 0,37 |
5,69 ± 0,36 |
|||
|
Мочевина, ммоль/л |
17,66 ± 3,93 |
12,47 ± 4,16 |
9,35 ± 1,99 |
9,70 ± 3,67 |
|||
|
|
|
|
|
а
|
б |
в |
|
|
|
|
|
г |
д |
е |
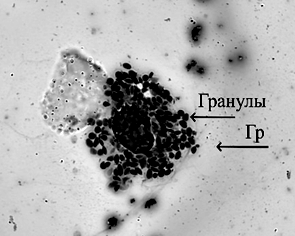
Гемоциты гемолимфы австралийского красноклешневого рака:
а – гиалиноцит (Гл); б – полугранулоцит (Пгр); в – гранулоцит (Гр); г – разрушенный гранулоцит, гранулы;
д, е – гиалиноциты, полугранулоциты, гранулоциты (ув. 1 000)
Hemocytes of the hemolymph of Australian red claw crayfish:
а – hyalinocyte (Гл); б – semigranulocyte (Пгр); в – granulocyte (Гр); г – destroyed granulocyte, granules;
д, е – hyalinocytes, semi-granulocytes, granulocytes (magnification 1 000)
Циркулирующие гемоциты ракообразных играют важную роль в формировании и осуществлении иммунной защиты организма. Гиалиноциты участвуют в фагоцитозе, гранулоциты – в хранении и выпуске системы профенолоксидазы и цитотоксичности, полугранулоциты – во всем вышеперечисленном [16]. Ранее у здоровых особей Cherax quadricarinatus, содержащихся в оптимальных условиях (24–26 °C) в проточных аквариумах при питании мидиями, было определено количество гиалиноцитов – 19 %, полугранулоцитов – 35 %, гранулоцитов – 46 % [17]. У всех исследованных нами особей было сохранено подобное соотношение, т. е. наиболее многочисленными были гранулоциты, наименее – гиалиноциты, и пограничный уровень у полугранулоцитов. Наиболее близкими к данному соотношению оказались особи в конце эксперимента, которых кормили 2-м вариантом корма (см. табл. 5). Линька, размножение, состояние питания, инфекция, реакция на стресс, гипоксия и изменение солености являются факторами, влияющими на относительные пропорции и общее количество белков гемолимфы. При недостатке питания уровень общего белка снижается [18]. Количество белка в гемолимфе у изученных особей сильно варьировало в зависимости от режима питания – от 30,07 до 123,05 г/л. Таким образом, наиболее достаточными в плане содержания белка оказались варианты питания 1 и 2, когда уровень белка в гемолимфе превышал в 1,7–2,4 раза уровень у контрольных особей, и в начале эксперимента (p < 0,05) (см. табл. 5). Процент альбумина от количества общего белка наиболее высоким (39 %) оказался у исследованных особей в начале эксперимента. У контрольных и экспериментальных экземпляров этот показатель колебался от 20 до 24 %. Ранее было определено, что у здоровых пресноводных раков отряда Decapoda, к которым относится и Cherax quadricarinatus, количество альбумина может составлять 17–24 % от общего белка [19], т. е. наиболее близкими к данному процентному соотношению оказались контрольные особи и особи в конце эксперимента, которых кормили 1-м и 2-м вариантами корма.
Уровень показателей липидного обмена раков – холестерина и триглицеридов – в гемолимфе зависят также от режима питания, условий обитания, снижаясь при их неблагоприятном характере (голод, низкая температура воды, гипоксия и пр.). У здоровых Cherax quadricarinatus, содержащихся в оптимальных температурных условиях, количество холестерина в гемолимфе достигало 0,75 мг/мл, триглицеридов – 0,35 мг/мл [20]. Суммарно наиболее благоприятным в отношении этих показателей оказались особи, которых кормили 2-м вариантом корма, с максимальным уровнем холестерина и относительно высоким показателем триглицеридов в гемолимфе (p < 0,05). Также достаточный уровень этих биохимических компонентов был и у особей, которых кормили 1-м вариантом корма (p < 0,05). У животных в начале эксперимента и у контрольной группы в его конце наблюдалось некоторое снижение уровня холестерина (p < 0,05) (см. табл. 5). Глюкоза, помимо выполнения функции важного источника энергии в организме ракообразных, также является показателем вторичной реакции на стресс. Наиболее высокий уровень глюкозы был отмечен у особей в начале эксперимента, что может быть следствием стрессового воздействия транспортировки их из прудов, где они содержались до начала эксперимента. У контрольных особей наблюдался некоторый недостаток этого энергоемкого биохимического показателя углеводного обмена (p < 0,05). Так, у здоровых пресноводных раков отряда Decapoda количество глюкозы в гемолимфе могло варьировать от 0,68 до 3,46 ммоль/л [19]. Благополучными по содержанию глюкозы можно считать особей в вариантах 1 и 2. Аминотрансферазы играют ключевую роль в обмене веществ, объединяя в единое целое белковый, углеводный, жировой обмен у животных. У животных отклонения в значениях активности АЛТ и АСТ могут свидетельствовать о повреждении гепатоцитов и внутренних органов в целом. Ранее были определены референсные значения уровня активности ферментов АСТ и АЛТ у здоровых представителей пресноводных раков отряда Decapoda, которые составили 50–170 ед./л [21], т. е. наиболее близкими к этим нормам были особи, которых кормили 1-м и 2-м вариантами корма и у которых уровень активности этих ферментов был близок к 40 ед./л (см. табл. 5). Кальций и фосфор очень важны для жизнедеятельности ракообразных. Кальций у Cherax quadricarinatus откладывается в период между линьками в гастролитах, состоящих из аморфного карбоната кальция, переплетенных с α-хитин-белковыми микрофибриллами, и транспортируется обратно в кутикулу во время постлиньки. Молекулы фосфопротеина необходимы при регуляции образования и стабилизации аморфного карбоната кальция, и их фосфорно-аминокислотные фрагменты являются ключевыми компонентами в этом процессе [22]. Несмотря на то, что максимальный уровень кальция отмечался у раков в начале эксперимента, количество фосфора у этих особей, как и у контрольных, было значительно ниже, чем у экспериментальных (p < 0,05) (см. табл. 5), т. е. по микроэлементному соотношению суммарно наиболее благоприятными вариантами кормления были 1-й и 2-й варианты корма. Наименее обогащенным в отношении фосфора и кальция был контрольный режим кормления (см. табл. 5). У здоровых пресноводных десятиногих раков уровень кальция может составлять 8,9–9,7 ммоль/л, фосфора 0,96–1,29 ммоль/л [19]. Нами были обнаружено достоверное снижение (p < 0,05) содержания мочевины в гемолимфе у особей, получавших корм в вариантах 1 и 2, как по сравнению с особями, исследованными в начале эксперимента (в 1,9 раз), так и с контрольными (в 1,3 раза) (см. табл. 5). Вероятно, это является положительным эффектом режима кормления, т. к. у пресноводных десятиногих ракообразных азотистые продукты обмена выделяются в основном в виде аммиака и аминокислот, но образуется и некоторое совсем небольшое количество мочевины и мочевой кислоты. Ранее было показано, что уровень мочевины в гемолимфе ракообразных может увеличиваться при неблагоприятных условиях содержания в условиях аквакультуры [23]. Таким образом, изученные количественные показатели соотношения гемоцитов и биохимические показатели гемолимфы особей австралийского красноклешневого рака свидетельствуют о том, что наиболее благополучное физиологическое состояние было характерно для раков, получавших экспериментальные варианты кормов.
Заключение
В ходе проведенного эксперимента была установлена возможность частичной замены рыбной муки на белок растительного происхождения, а именно на муку из люцерны, при приготовлении кормов для выращивания в искусственных условиях австралийского красноклешневого рака. Снижение количества животного белка в корме не оказало существенного влияния на основные рыбоводно-биологические показатели раков, что говорит о возможности удешевления стоимости кормов за счет уменьшения норм введения рыбной муки. Рост раков на кормах с высоким и низким содержанием животного протеина происходил почти одинаково, однако для лучшего усвоения растительных компонентов рекомендовано добавление в корма комплексного ферментного препарата, например натузима.
Также отмечено положительное влияние экспериментальных кормов и на биохимические показатели ракообразных. Количество белка в гемолимфе у изученных особей Cherax quadricarinatus сильно варьировало в зависимости от режима питания – от 30,07 до 123,05 г/л. Таким образом, наиболее достаточными в плане содержания белка оказались режимы питания 1 и 2 экспериментальным кормом, когда уровень белка в гемолимфе превышал в 1,7–2,4 раза уровень у контрольных особей и в начале эксперимента.
1. Анкешева Б. М., Тангатарова Р. Р., Пятикопова О. В. Формирование ремонтно-маточного стада австралийского красноклешневого рака (Сherax quadricarinatus) в индустриальной аквакультуре // Изв. ТИНРО. Т. 201. Вып. 4. С. 948-959.
2. Лагуткина Л. Ю., Мартьянов А. С., Степанов Р. В., Шейхгасанов К. Г. Оптимизация технологии кормления австралийских раков с помощью рецептур экспериментальных кормов // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2016. № 1. С. 77-87.
3. Борисов Р. Р., Ковачева Н. П., Артемов Р. В., Ни-конова И. Н., Арнаутов М. В., Артемов А. В., Гершунская В. В. Оценка эффекта применения комбикормов с различным уровнем белка для молоди австралийского красноклешневого рака в условиях УЗВ // Тр. ВНИРО. 2022. Т. 187. С. 128-137.
4. D’Abramo L., Robinson E. H. Nutrition of crayfish // Reviews in Aquatic Sciences. V. 1. P. 711-728.
5. Jones C. M. The biology and aquaculture potential of the tropical freshwater crayfish Cherax quadricarinatus. Queensland Department of Primary Industries Information Series, 1990. 109 р.
6. Gutierrez M. L., Rodriguez E. M. Effect of protein source on growth of early juvenile redclaw crayfish Cherax quadricarinatus (Decapoda, Parastacidae) // Freshwater Crayfish. 2010. V. 17. P. 23-29.
7. Thompson K. R., Muzinic L. A., Engler L. S., Morton S.-R., Webster C. D. Effects of feeding practical diets containing various protein levels on growth, survival, body composition, and processing traits of Australian red claw crayfish (Cherax quadricarinatus) and on pond water quality // Aquaculture Research. 2004. V. 35. N. 7. P. 659-668.
8. Thompson K. R., Metts L. S., Muzinic L. A., Dasgupta S., Webster C. D. Effects of feeding practical diets containing different protein levels, with or without fish meal, on growth, survival, body composition and processing traits of male and female Australian red claw crayfish (Cherax quadricarinatus) grown in ponds // Aquaculture Nutrition. 2006. V. 12. N. 3. P. 227-238.
9. Saoud I., Yta A., Ghanawi J. A review of nutritional biology and dietary requirements of redclaw crayfish Cherax quadricarinatus (von Martens 1868) // Aquaculture Nutrition. 2012. V. 18. P. 349-368.
10. Костомахин Н. А., Иванов А. И. Травяная мука - белковый и витаминный корм // Корма. 2013. № 6. С. 71-73.
11. Гобелков П. В. Темп роста самцов австралийского красноклешневого рака (Сherax quadricarinatus) в условиях индустриальной аквакультуры при использовании кормов различного состава // Биологическое разнообразие: изучение, сохранение, восстановление, рациональное использование: материалы II Междунар. науч.-практ. конф. (Керчь (27-30 мая 2020 г.)). Симферополь: ООО «Издательство Типография «Ариал», 2020. С. 283-287.
12. Bauchau A., Ratcliffe N., Rowley A. Crustaceans. Invertebrate blood cells. N. Y.: Academic Press, 1980. Р. 385-420.
13. Шокашева Д. И. Рост молоди австралийского рака Cherax quadricarinatus в индустриальных условиях в зависимости от температуры среды // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2018. № 2. С. 98-103.
14. Rodríguez-González H., García-Ulloa M., Hernández-Llamas A., Villarreal H. Effect of dietary protein level on spawning and egg quality of redclaw crayfish Cherax quadricarinatus // Aquaculture. 2006. V. 257. N. 1. Р. 412-419.
15. Корягина Н. Ю. Физиолого-биохимическая характеристика речных раков при выращивании в искусственных условия: автореф. дис. ... канд. биол. наук. М.: Изд-во РГАУ МСХА им. К. А. Тимирязева, 2010. 21 с.
16. Johansson M., Keyser P., Sritunyalucksana K., Söderhäll K. Crustacean haemocytes and haematopoiesis // Aquaculture. 2000. V. 191. N. 1. Р. 45-52.
17. Duan H., Jin S., Zhang Y., Li F., Xiang J. Granulo-cytes of the red claw crayfish Cherax quadricarinatus can endocytose beads, E. coli and WSSV, but in different ways // Developmental & Comparative immunology. 2014. V. 46. N. 2. Р. 186-193.
18. Lorenzon S., Martinis M., Ferrero E. Ecological rel-evance of hemolymph total protein concentration in seven unrelated crustacean species from different habitats meas-ured predictively by a density-salinity refractometer // Journal of marine biology. 2011. V. 2011. Р. 1-7.
19. Пронина Г. И., Корягина Н. Ю., Ревякин А. О. Сравнительная оценка речных раков разных видов по биохимическим и гематологическим показателям // Изв. ОГАУ. 2009. N. 24-1. С. 186-188.
20. Wu D., Liu Z., Yu P., Huang Y., Cai M., Zhang M. Cold stress regulates lipid metabolism via AMPK signalling in Cherax quadricarinatus // Journal of thermal biology. 2020. V. 92. Аrticle 102693.
21. Пронина Г. И., Корягина Н. Ю. Референсные значения физиолого-иммунологических показателей гидробионтов разных видов // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2015. № 4. С. 103-108.
22. Ghanawi J., Saoud P. Molting, reproductive biology, and hatchery management of redclaw crayfish Cherax quadricarinatus (von Martens 1868) // Aquaculture. 2012. V. 358-359. Р. 183-195.
23. Zimmer A., Jorge M., Wood C., Martins C., Bianchini A. Тhe effects of acute copper and ammonia challenges on ammonia and urea excretion by the Вlue crab Callinectes sapidus // Archives of environmental contamination and toxicology. 2017. V. 72 (3). Р. 461-470.