Russian Federation
The article is devoted to the analysis of the toxicity of the water fraction of oil formed in solutions of 13 and 35 g/l, using the biotesting method. From the solution of dehydrated oil from the Korchagin deposit at a concentration of 50 ml per liter of medium based on 13 and 35 g/l aqueous solutions of NaCl, the aqueous phase was selected one and two days after the addition of oil. The fluorimetric method was determined the content of hydrocarbons, which was 0.53 mg/l after 24 hours incubation and 1.07 mg/l after 48 hours incubation in the 13 g/l solution and 2.29 and 0.78 mg/l in the 35 g/l solution accordingly. The test object was the Artemia salina crustacean at the nauplii stage (2 days after hatching). The nauplii were counted 24 and 48 hours after being placed in a medium containing hydrocarbons. It was found that the output of nauplii from cysts is higher in an incubation medium with a mineralization of 35 g/l – 60 individuals per 10 ml of medium against 27 at 13 g/l, but the survival rate after 24 and 48 hours of the experiment (3 and 4 days after the exit from cysts) is lower by 43%. The biotesting data were well consistent with the results of chemical analysis. Higher concentrations of hydrocarbons in the incubation medium correspond to the highest mortality of test objects, and the toxic effect is higher the longer the nauplii are exposed to the toxicants. A. salina sensitivity to hydrocarbon concentrations in water and its tolerance to mineralization of 13 g/l make it a promising test object for testing the waters of the Northern Caspian Sea in the event of oil pollution.
Artemia salina, nauplii, biotesting, oil pollution, salinity, hydrocarbon content in water
Введение
Одной из наиболее острых проблем Каспийского моря является проблема нефтяного загрязнения. Разработка нефтяных месторождений, транспортировка нефти, аварийные ситуации на буровых платформах привели к нарушению экологического равновесия в экосистемах Северного Каспия, загрязнению вод, дна и побережья углеводородами. Причем именно в Северном Каспии риск загрязнения максимален из-за мелководья и высоких пластовых давлений [1]. Попадая в природную среду, углеводороды меняют ее физические и химические параметры: запах, вкус, окраску, поверхностное натяжение, вязкость, содержание кислорода, в результате чего среда приобретает токсические свойства, представляя угрозу для человека и для биоты в целом [2]. Углеводороды, растворенные в воде, разрушают жабры (при этом нарушаются водно-солевой обмен и процессы дыхания), воздействуют на нервно-мышечную систему, снижают чувствительность организмов к химически опасным веществам. При воздействии нефти и нефтепродуктов хотя бы на одного из представителей цепи питания в водоеме может привести к деградации и гибели всего биоценоза водоема [3]. Сложный состав нефти и нефтепродуктов, их реакционная способность по отношению друг к другу и компонентам водной среды, делают химический мониторинг необходимым, но недостаточным. В данных условиях биоиндикация загрязнения воды по физиологическим реакциям организмов – комплексный показатель, учитывающий не только токсичность определенных поллютантов, но и возможные синергические эффекты их взаимодействия. Целью статьи являлся анализ токсичности водной фракции нефти, образующейся в растворах с различной минерализацией, методом биотестирования.
Материалы и методы
Для анализа токсичности был приготовлен раствор обезвоженной нефти из месторождения им. Корчагина в концентрации 50 мкл на литр среды.
В качестве среды были использованы 13 и 35 г/л водные растворы NaCl. Водную фракцию углеводородов получали с помощью делительной воронки через 1 и 2е сут после добавления нефти. В отобранных растворах флуориметрическим методом было определено содержание углеводродов [4].
В качестве тест-объекта использовали рачка Artemia salina в стадии науплиев. Сухие цисты артемий в концентрации 1 мг/мл помещали в подготовленную культивационную среду (13 и 35 г/л) и ставили на свет для выклева. Через 48 ч инкубации при 25 °С производили подсчет рачков под бинокулярной лупой в камере Богорова и помещали аликвоту инкубационной среды в среду с углеводородами. Критерием токсичности исследуемых растворов выступала выживаемость науплиев, анализируемая через 24 и 48 ч после начала эксперимента.
Результаты и обсуждение
Анализ содержаний углеводородов в водной среде под нефтяной пленкой представлен в таблице.
Количество углеводородов в водной фракции раствора нефти, мг/л
The amount of hydrocarbons in the aqueous fraction of the oil solution, mg/l
|
Среда с содержанием NaCl |
Время инкубации |
|
|
1 сутки |
2 суток |
|
|
13 г/л |
0,53 |
1,07 |
|
35 г/л |
2,29 |
0,78 |
В растворе, содержавшем 13 г/л солей, количество углеводородов нарастало в течение эксперимента, на 2-е сут их содержание выросло вдвое по сравнению с первыми замерами. В растворе соленостью 35 г/л максимальное количество углеводородов было обнаружено через 24 ч после добавления нефти к раствору, в то время как к концу эксперимента выделение гидрофобной фазы на поверхности раствора привело к снижению количества растворенных углеводородов. В литературе отмечено, что образование эмульсионных растворов при растворении нефти в воде – многофакторный процесс, на который оказывают влияние общая минерализация растворов, определяющих межфазное натяжение [5] и скорость всплытия частицы нефти в водной среде [6], а также ряд других факторов, таких как концентрации отдельных солей, состав нефти, температура. Снижение концентрации углеводородов в водном растворе под нефтяной пленкой может быть результатом установления равновесия в эмульсионной системе «нефть – вода», в результате которого часть поступивших первоначально в воду веществ вернулись
в гидрофобную фазу. Артемия относится к эвригалинным видам и переносит достаточно высокие колебания солености. Между тем в инкубационной среде с 35 г/л на 2-е сут инкубации количество науплиев было в 2 раза выше (65 рачков на 1 мл), чем в среде, минерализация которой составляла всего 13 г/л (30 рачков на
1 мл). После добавления аликвоты с науплиями концентрация рачков в экспериментальных емкостях составила 27 особей на 10 мл для 13 г/л и 60 особей на 10 мл для 35 г/л. Выживаемость науплиев при минерализации 13 г/л в контрольных пробах составила 96 и 93 % через 1 и 2-е сут эксперимента соответственно (рис. 1).
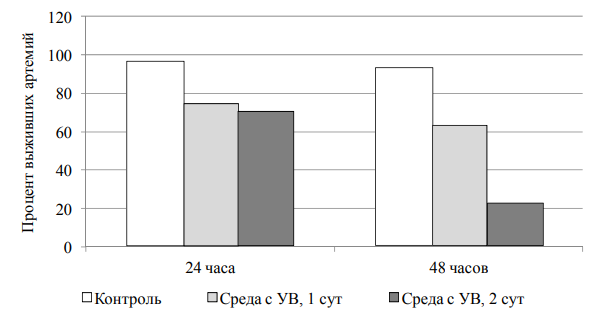
Рис. 1. Процент выживших науплиев в растворах с минерализацией в 13 г/л
Fig. 1. Percentage of surviving nauplii in solutions with a mineralization of 13 g/l
В среде на основе суточной экстракции углеводородов содержание рачков через 24 ч инкубации оказалось на 26 % ниже исходного, а на 2-е сут эксперимента концентрация тест-объектов снизилась до 63 % от первоначального количества, внесенного в инкубационную емкость.
В среде, контактировавшей c нефтью в течение 2-е сут и содержащей согласно анализу в 2 раза больше углеводородов, к концу 2-х сут инкубации выжило 70 % от исходного количества науплиев, к концу периода наблюдения их осталось только 22 %.
Данные биотестирования хорошо согласуются с результатами химического анализа. Наибольшей гибели тест-объектов соответствуют более высокие концентрации углеводородов в инкубационной среде, при этом токсический эффект тем выше, чем дольше длится контакт науплиев с токсикантами.
В контрольной пробе, содержащей раствор соли 35 г/л, выживаемость артемии через 24 ч эксперимента составила 53 %, а через 48 ч – 50 % от исходного (рис. 2).
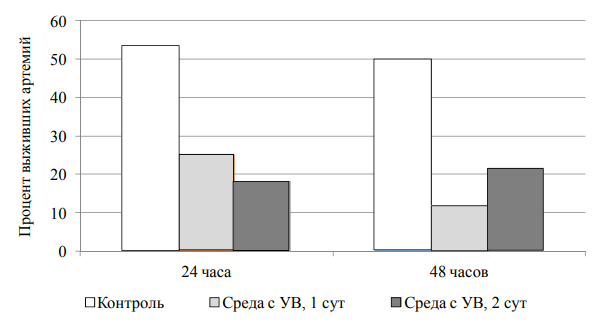
Рис. 2. Процент выживших науплиев в растворах с минерализацией в 35 г/л
Fig. 2. Percentage of surviving nauplii in solutions with a mineralization of 35 g/l
Наличие суточной экстракции нефтяного раствора (2,29 мг/л) в инкубационной среде привело к гибели 75 % тест-объектов уже через 24 ч после контакта рачков с токсикантом, а ко 2-м сут эксперимента их содержание снизилось до 12 %. Водный экстракт нефти, образовавшийся после выстаивания в течение 2-х сут и вследствие процесса расслоения, содержащий на 76 % меньше углеводородов, чем в случае суточной экстракции, приводил к резкому сокращению количества тест-объектов уже через 24 ч инкубации (до 18 % от исходного, помещенного в пробу). Процент выживших науплиев к концу эксперимента (48 ч инкубации) в этой пробе практически не изменился, находясь в пределах ошибки измерения. Так же как и в случае с тестированием соляных растворов 13 г/л, для 35 г/л наибольший процент гибели тест-объектов был выявлен в среде, содержащей наиболее высокие концентрации углеводородов по данным химического анализа, но только на 2-е сут инкубации.
Заключение
Таким образом, во влиянии солености водной среды на токсичность нефти для водных организмов можно выделить два аспекта.
1. Соленость участвует в процессе установления физико-химического равновесия в системе «нефть – вода», результатом которого будет определяться количество углеводородов, переходящих в водную фазу.
2. Минерализация, как участник установления водно-солевого баланса организма, может облегчать или же препятствовать проникновению токсикантов в его внутреннюю среду.
Поскольку оба эти процесса нелинейны, данные биотестирования согласуются с результатами химического анализа содержания углеводородов в экспериментальных растворах, но не обнаруживают кратности увеличения смертности тест-объектов при кратном возрастании углеводородов в инкубационной среде. Если этого не обнаруживается даже в контролируемых условиях эксперимента, то в реальных условиях аварийных ситуаций ущерб кормовой базе морских экосистем может оказаться больше прогнозируемого расчетными методами.
Тем не менее следует отметить, что чувствительность к углеводородам и выживаемость A. salina в растворах с минерализацией 13 г/л позволяют использовать этот тест-объект для определения токсичности морских вод Северного Каспия при его нефтяном загрязнении.
1. Ibragimli G. A., Rakcheeva-Aktoprak I. F. Neftyanoe zagryaznenie Severnogo Kaspiya, ego vliyanie na morskie e'kosistemy' i metody' bor'by' s nim [Oil pollution of the Northern Caspian, its impact on marine ecosystems and methods of combating it]. Molodoj ucheny'j, 2023, vol. 461, no. 14 (461), pp. 77-86. Available at: https://moluch.ru/archive/461/101396 (accessed: 01.10.2025).
2. Vyatchina O. F., Zhdanova O. F., Stom D. I. Ispol'zovanie drozhzhej Saccharomyces cerevisiae dlya biotestirovaniya neftezagryaznenij [Using Saccharomyces cerevisiae yeast for bioassay of oil spills]. Izvestiya Irkutskogo gosudarstvennogo universiteta, 2008, vol. 1, no. 1, pp. 14-17.
3. Kartamy'sheva E. S., Ivanchenko D. S. Posledstviya doby'chi nefti i gaza na Kaspijskom more [Consequences of oil and gas production in the Caspian Sea]. Molodoj ucheny'j, 2017, no. 25 (159), pp. 113-117.
4. MUK 4.1.1262-03. Metodicheskie ukazaniya po metodam kontrolya. 4.1. Metody' kontrolya. Ximicheskie faktory'. Izmerenie massovoj koncentracii nefteproduktov fluorimetricheskim metodom v probax pit’evoj vody' i vody' poverxnostny'x i podzemny'x istochnikov vodopol'zovaniya [MUK 4.1.1262-03. Guidelines for control methods. 4.1. Control methods. Chemical factors. Measurement of mass concentration of petroleum products by the fluorimetric method in samples of drinking water and water from surface and underground water sources]. Available at: https://docs.cntd.ru/document/1200034289 (accessed: 01.10.2025).
5. Turnaeva E. A., Sidorovskaya E. A., Adaxovskij D. S., Kikireva E. V. i dr. Xarakteristiki e'mul'sij i ix znachenie pri prognoze e'ffektivnosti neftevy'tesnyayushhix kompozicij na osnove poverxnostno-aktivny'x veshhestv [Characteristics of emulsions and their importance in predicting the effective-ness of oil-displacing compositions based on surfactants]. Izvestiya vy'sshix uchebny'x zavedenij. Neft' i gaz, 2021, no. 3 (147), pp. 91-107.
6. Denislamov I. Z., Gafarov Sh. A., Chemezov D. P., Ixsanov D. R. Rezhimy' e'kspluatacii vertikal'ny'x rezervuarov dlya doochistki stochnoj vody' sistemy' podderzhaniya plastovogo davleniya [Operating modes of vertical tanks for post-treatment of wastewater from the reservoir pressure maintenance system]. Problemy' sbora, podgotovki i transporta nefti i nefteproduktov. 2022, no. 3, pp. 35-47. http://doihttps://doi.org/10.17122/ntj-oil-2022-3-35-47.










