Оренбург, Россия
Россия
Россия
Россия
Карп (Cyprinus carpio) – один из самых популярных пресноводных видов рыб, выращиваемых в условиях аквакультуры. Однако существует ряд проблем, связанных с разведением гидробионтов, в том числе с высокой стоимостью корма и ростом количества заболеваний. В качестве предполагаемого решения проблем предлагается дополнительное включение в рацион гидробионтов кормовых добавок. Рассматривается элементный статус карпа при использовании в рационе биологически активных кормовых добавок. В качестве объекта исследования использовали годовиков карпа. Основной учетный период составил 42 суток, в течение которого рыбам дополнительно в корм вводили ванилин (25 мг/кг корма), пробиотик (1 г/кг корма), ультрадисперсные частицы диоксида кремния (УДЧ SiO2, 200 мг/кг корма), микроэлементы Zn (20 мг/кг корма), I (0,6 мг/кг корма), Cr (2 мг/кг корма), Co (2 мг/кг корма) и их комплексы. Было выявлено влияние кормовых препаратов на концентрацию химических элементов в мышечной ткани карпа. Отмечено, что включение ванилина в рацион карпа способствовало повышению концентрации макро- и микроэлементов: Ca (Р 0,05), Na (Р 0,01), Fe (Р 0,05), Ni (Р 0,05), Mo (Р 0,05) относительно контроля. Пробиотики воздействовали на содержание таких элементов, как Ca (Р 0,05), Na (Р 0,05), Se (Р 0,05) и I (Р 0,05), при снижении концентрации Cr (Р 0,05). Совместное использование ванилина и пробиотика привело к повышению содержания Na (Р 0,01) и к снижению Cr (Р 0,01). Комплекс, состоящий из ванилина + УДЧ SiO2 + пробиотика, способствовал повышению концентрации K (Р 0,05) и Na (Р 0,01) при снижении B (Р 0,05), Se (Р 0,05) и Mo (Р 0,05). Дополнительное применение в рационе карпа ванилина + УДЧ SiO2 + микроэлементов (Zn, I, Cr, Co) отразилось на повышении уровня K (Р 0,05) и Na (Р 0,01), при этом B (Р 0,01) и Se (Р 0,05) снижались по сравнению с контрольными значениями. После использования биологически активных кормовых добавок концентрация ряда токсических элементов в тканях карпа снижалась до 94,3 % (Р 0,001) по сравнению с контрольными значениями. Таким образом, дополнительное применение кормовых препаратов в рационе рыб связано с улучшением элементного статуса при общем росте содержания макро- и микроэлементов и снижении концентрации токсических элементов. Наибольшее положительное отличие было зафиксировано в группе, где рыбам дополнительно вводили в рацион ванилин.
аквакультура, карп, кормление, элементный статус, ванилин, пробиотик, ультрадисперсные частицы, микроэлементы
Введение
В настоящее время аквакультура – самая быстрорастущая отрасль пищевой промышленности, где производство варьируется от небольших частных прудов до крупномасштабных заводов. Аквакультура занимается выращиванием как рыб, так и других гидробионтов (моллюсков, ракообразных и пр.). Производство позволяет обеспечивать население высококачественными белками, липидами, углеводами, витаминами и микроэлементами [1, 2]. В аквакультуре при выращивании рыб необходимо использовать сбалансированные корма для поддержания оптимального роста и эффективности производства. Для этого необходимо, чтобы в корма входили высококачественные компоненты, витамины и минералы [3], при этом в составе комбикорма должен учитываться принцип биодоступности компонентов и их взаимодействия друг с другом [4].
Применение биологически активных кормовых добавок в рационах сельскохозяйственных животных позволяет повысить эффективность кормления, улучшить выживаемость и уменьшить число заболеваний. Ряд кормовых препаратов, например ультрадисперсные частицы (УДЧ), могут связывать и удалять токсины или патогенные микроорганизмы [5]. Ультрадисперсные частицы имеют высокое соотношение площади поверхности к объему, за счет чего вещества химически могут быть гораздо более активными, что повышает их биодоступность, улучшая усвоение и метаболизм [6]. Наиболее изученными и широко применяемыми добавками в аквакультуре являются пробиотики, которые при включении в корм способствуют повышению устойчивости к болезням, улучшают состояние здоровья, показатели роста, усвоение корма и микробный баланс организма-хозяина. Наиболее часто используются молочнокислые бактерии (Lactobacillus), являющиеся частью естественной микробиоты кишечника и оказывающие положительное действие на пищеварительную систему. Кроме того, пробиотики воздействуют на выработку ингибирующих веществ, способных подавлять рост патогенной микрофлоры [7].
Исследование ингибиторов кворум сенсинга бактерий направлено на выявление ряда препаратов, способных благоприятно отразиться на физиологическом состоянии организма за счет влияния на экспрессию генов патогенных микроорганизмов. К веществам анти-кворума относятся и пробиотики, и ультрадисперсные частицы, и ряд других кормовых добавок, например ванилин. Он способен оказывать противомикробное действие и подавлять рост Vibrio harveyi и Vibrio anguillarum, а также проникать в мембрану и разрушать ее из-за ароматической структуры [8, 9].
Рыбы в основном получают микроэлементы из рациона и воды, при этом добавки с микроэлементами в рационе рыб необходимы. Они могут выступать в качестве катализаторов в ферментных и эндокринных системах. Большая часть белков нуждаются в ко-факторе, содержащем микроэлемент. Также микроэлементы принимают участие в метаболических процессах – переваривании белков, выработке энергии, делении клеток – и в антиоксидантной активности. Дополнительное включение микроэлементов в рацион рыб влияет на улучшение физиологического состояния организма, повышение прироста и уменьшение числа заболеваний за счет стимулирования иммунного ответа [10].
В связи с этим исследования по применению различных кормовых добавок и их комплексов являются актуальными. При этом необходимо полное изучение влияния препаратов на организм рыб, в том числе на рост, гематологические параметры и на состояние мышечной ткани гидробионтов. Выявление концентрации химических элементов в тканях рыб отражает способность гидробионтов биоаккумулировать те или иные элементы и передавать их по пищевой цепочке.
Цель исследований – изучить элементный статус карпа (Cyprinus carpio) в связи с использованием в рационе биологически активных кормовых добавок.
Материалы и методы
Эксперимент проведен в летний период 2024 г. в Оренбургском государственном университете на кафедре биотехнологии животного сырья и аквакультуры на модели карпа (97 ± 2 г, n = 9). Учетный период составил 42 суток. Рыб содержали в условиях аквариумного стенда, оснащенного системой фильтрации и насыщения воды кислородом. Температура воды поддерживалась в диапазоне 25 ± 2 °С.
Кормление рыб осуществлялось 4 раза в светлое время суток через равные промежутки времени. Норма кормления составила от 2 до 5 % от массы тела. Расчет проводили еженедельно после взвешивания рыб. Биологически активные кормовые добавки были нанесены на комбикорм путем напыления.
Исследования по изучению влияния биологически активных кормовых добавок представлены на схеме (рис. 1).
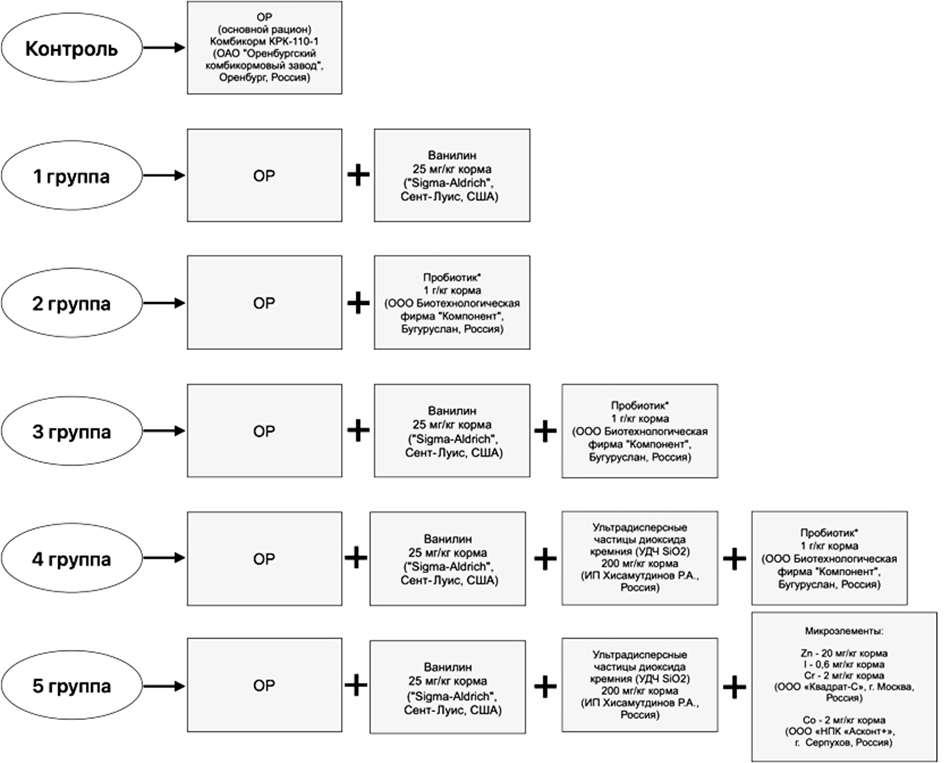
Рис. 1. Схема эксперимента: «*» – пробиотик на основе штаммов Enterococcus faecium (2 · 1010 КОЕ),
Lactobacillus plantarum (1 · 105 КОЕ), Lactobacillus buchneri (1 · 105 КОЕ),
Propionibacterium freudenreichii subsp. Shermanii (2 · 108 КОЕ), Bifidobacterium bifidum (1 · 109 КОЕ)
Fig. 1. Experimental scheme: “*” is a probiotic based on Enterococcus faecium strains (2 · 1010 CFU),
Lactobacillus plantarum (1 · 105 CFU), Lactobacillus buchneri (1 · 105 CFU),
Propionibacterium freudenreichii subsp. Shermanii (2 · 108 CFU), Bifidobacterium bifidum (1 · 109 CFU)
Мышечная ткань была отобрана с применением стерильных инструментов в последний день исследования. Дальнейший анализ был проведен в лаборатории АНО «Центр биотической медицины», г. Москва (лицензия МДКЗ 18097/9556). Результаты представлены по 31 показателю.
Опытные группы сравнивались с контрольной группой с помощью пакета программ Microsoft Office (Microsoft, США) и программы Statistica 10.0 (Stat Soft Inc., США).
Результаты и обсуждение
Изучение химического пула макро- и микроэлементов мышечной ткани является важным фактором при оценке пищевой ценности рыб. При этом должно оцениваться содержание не только макро- и эссенциальных микроэлементов, но также и условно-эссенциальных и в особенности токсических элементов. В первую очередь, их концентрация в тканях гидробионтов зависит от окружающей среды и физиологического состояния рыб [11]. Изменение элементного состава тканей может привести как к улучшению иммунитета, прироста и снижению ряда заболеваний, так и к негативным последствиям для организма [12]. Установлено, что введение в рацион карпа биологически активных кормовых добавок и их комплексов отразилось на элементном статусе подопытных рыб (рис. 2).
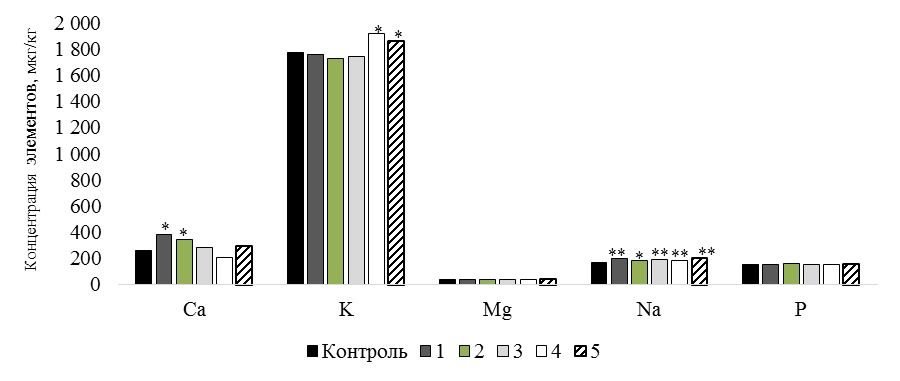
Рис. 2. Концентрация макроэлементов в тканях карпа, мкг/кг:
различия с контролем при *P ≤ 0,05; **P ≤ 0,01
Fig. 2. Concentration of macronutrients in carp tissues, mcg/kg:
differences with the control in *P ≤ 0.05; **P ≤ 0.01
Натрий, кальций и калий являются жизненно важными макроэлементами. При изучении концентрации макроэлементов (см. рис. 2) установлено, что содержание Na во всех группах увеличивалось. Так, в 5 группе зафиксировано наибольшее повышение (на 19,4 % (Р £ 0,01)) по сравнению с контролем. В других группах концентрация Na повышалась от 8,2 % (Р £ 0,05) до 15,3 % (Р £ 0,01). Натрий регулирует количество воды во внеклеточном пространстве посредством осмотических гомеостатических процессов и совместно с K регулирует общее количество воды в организме. Кроме того, K вносит значительный вклад во внутриклеточную осмолярность и играет важную роль в деятельности нервной системы [13]. Повышение концентрации K было зафиксировано в 4 группе на 8,5 % (Р £ 0,05) и в 5 группе – на 5,2 % (Р £ 0,05).
Кроме того, в 1 и 2 группах отмечалось увеличение концентрации Ca по сравнению с контролем на 46,9 % (Р £ 0,05) и 33,3 % (Р £ 0,05) соответственно. Кальций является ко-фактором для многих ферментов и выступает посредником в сигнальных реакциях мышц и нервов, передает импульсы и оказывает влияние при делении клеток и свертывании крови [13].
Эссенциальные и условно-эссенциальные микроэлементы (рис. 3) показали следующие результаты. Согласно предыдущим исследованиям [14], включение некоторых микроэлементов в кормление рыб способствует повышению количества данных элементов в мышцах рыб. Включение в рацион 5 группы микроэлементов Zn, I, Cr и Co в нашем исследовании не привело к изменениям в концентрации данных показателей. При этом установлено, что использование в рационе пробиотика и комплекса ванилин + пробиотик привело к снижению содержания хрома на 32,7 % (Р £ 0,05) и 69,4 % (Р £ 0,01) соответственно, а уровень йода во 2 группе повышался на 84,8 % (Р £ 0,05). До 80 % йода попадает в организм рыб с водой, однако его биодоступность изменяется под влиянием рациона [11]. Если о влиянии I на организм рыб известно много, то воздействие Cr на рыб изучено неполностью. Раннее сообщалось, что хром оказывает антиоксидантное действие и влияет на липидный обмен, но его недостаток или отсутствие в рационе могут не приводить к негативным последствиям для
организма [15].
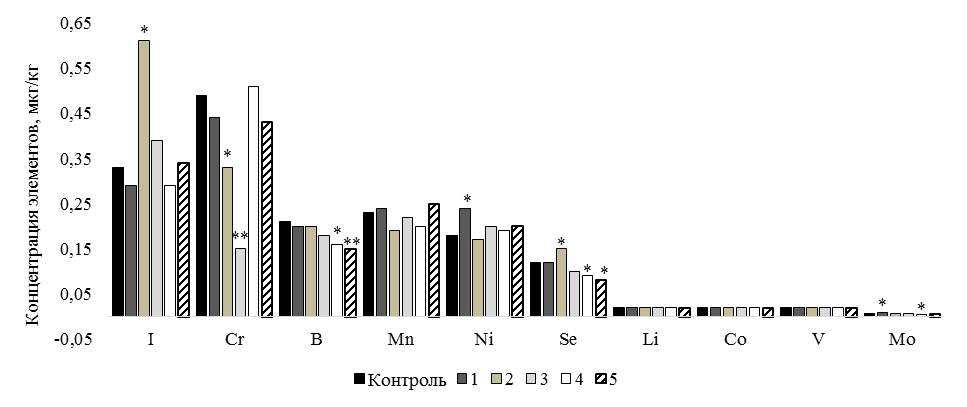
а
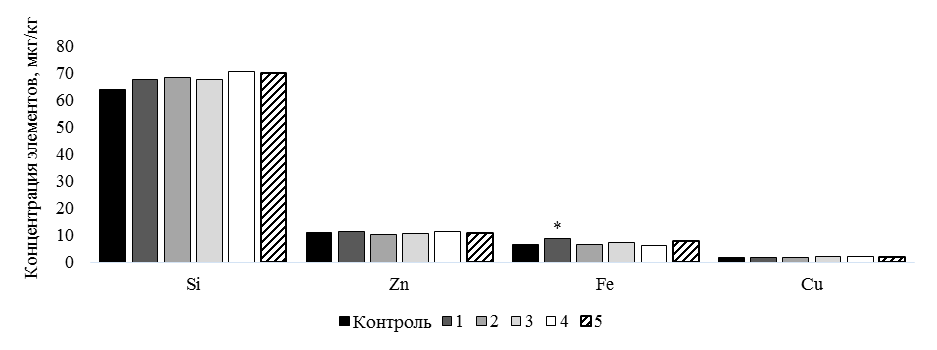
б
Рис. 3. Концентрация эссенциальных и условно-эссенциальных микроэлементов в тканях карпа, мкг/кг:
различия с контролем при * P ≤ 0,05; ** P ≤ 0,01: а – I, Cr, B, Mn, Ni, Se, Li, Co, V, Mo; б – Si, Zn, Fe, Cu
Fig. 3. Concentration of essential and conditionally essential trace elements in carp tissues, mcg/kg:
differences with the control in * P ≤ 0.05; ** P ≤ 0.01: а – I, Сr, B, Mn, Ni, Se, Li, Co, V, Mo; б – Si, Zn, Fe, Cu
Кроме того, в 5 группе было зафиксировано снижение B – на 28,6 % (Р £ 0,01) и Se – на 33,3 % (Р £ 0,05). Похожий эффект выявлен и в 4 группе, в которой отмечалось снижение B – на 23,8 % (Р £ 0,05), Se – на 25 % (Р £ 0,05) и Mo – на 28,6 % (Р £ 0,05). Только во 2 группе концентрация Se повышалась на 25 % (Р £ 0,05). Основным путем поглощения Se является желудочно-кишечный тракт. Селен связывается с белками в плазме и транспортируется в ткани, причем в мышечной ткани содержится наибольшая часть запасов этого элемента в организме. Биологические функции B четко не определены [16, 17].
Отличительные результаты были получены в 1 группе, в рацион которой дополнительно включали ванилин. Концентрация Fe, Ni и Mo повышалась на 29,7 % (Р £ 0,05), 33,3 % (Р £ 0,05) и 28,6 % (Р £ 0,05) соответственно. Железо – значимый компонент, который задействован в биохимических процессах организма. В частности, Fe участвует в передаче электронов, контролирует активность генов, помогает транспортировать кислород и регулирует рост и деление клеток. Его повышение отмечают при увеличении массы рыб, что отражает биоаккумуляцию и биоусиление действия элемента [18, 19]. Считается, что желудочно-кишечный тракт – это основной орган, где происходит усвоение железа. В желудке железо высвобождается из пищи благодаря кислой среде [16]. Можно предположить, что ванилин способен усилить этот процесс и повысить концентрацию Fe в мышечной ткани рыб.
Несмотря на то, что Cu является метаболическим антагонистом Fe, в нашем исследовании не было отмечено достоверного различия между концентрацией Cu в опытных группах и контроле. В последних литературных источниках [11] указывалось на сбалансированность содержания этих элементов в тканях гидробионтов и на отсутствие антагонистического эффекта между элементами.
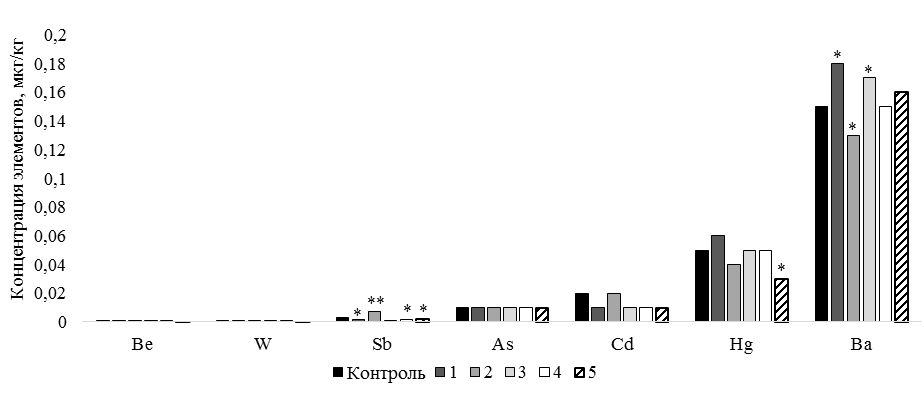
Содержание токсических элементов в организме рыб зависит от их концентрации в окружающей среде и биодоступности, а также от вида, стадии развития, физиологического состояния и условий кормления рыб [20]. Интоксикация организма тяжелыми металлами может проявляться различными физиологическими, биохимическими, клеточными и молекулярными изменениями [21]. Включение биологически активных кормовых добавок в рацион карпа отразилось на уровне токсических элементов в мышечной ткани (рис. 4).
а
б
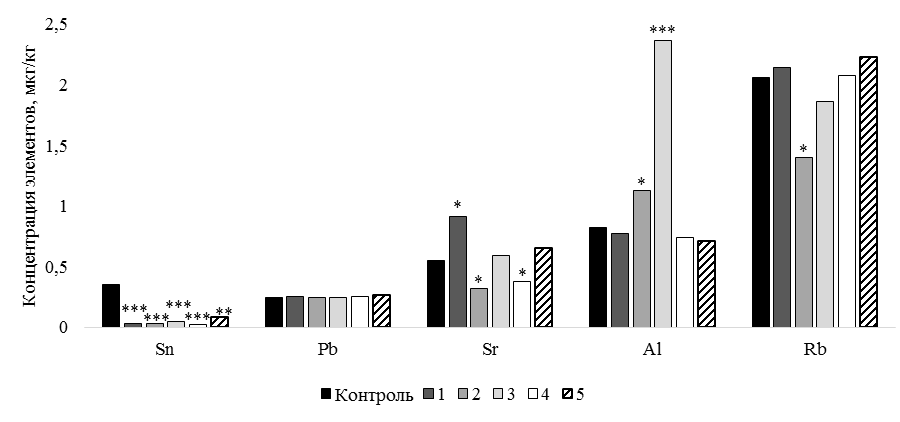
Рис. 4. Концентрация токсических и малоизученных элементов в тканях карпа, мкг/кг:
различия с контролем при * P ≤ 0,05; ** P ≤ 0,01; *** P ≤ 0,001;
а – Be, W, Sb, As, Cd, Hg, Ba; б – Sn, Pb, Sr, Al, Rb
Fig. 4. Concentration of toxic and poorly studied elements in carp tissues, mcg/kg:
differences with control at * P ≤ 0.05; ** P ≤ 0.01; *** P ≤ 0.001;
а – Be, W, Sb, As, Cd, Hg, Ba; б – Sn, Pb, Sr, Al, Rb
Дополнительное использование кормовых добавок в рационах рыб способствовало снижению ряда токсических элементов в мышечных тканях [22].
В настоящем исследовании было расширено число показателей токсических элементов, при этом явные изменения были отмечены во 2 и 3 группах. В то же время в 4 и 5 группах отмечалось исключительно снижение концентрации токсических элементов.
Наиболее опасными тяжелыми металлами являются Pb, Hg, Cd и As, содержание которых в мышечной ткани приводит к аккумуляции металлов и их передаче по пищевой цепочке [23]. Нами выявлено, что концентрация Pb, Cd и As в опытных группах и контроле не имела достоверных различий. Содержание Hg имело достоверные отличия только в 5 группе, где уровень Hg снижался на 40 % (Р £ 0,05) относительно контроля.
В нашем исследовании самая высокая концентрация токсических элементов была в 3 группе, где зафиксировали наибольшее повышение Al – в 2,9 раза (Р £ 0,001) по отношению к контролю. Повышение Al вызывает стресс и отражается на метаболических изменениях в мышечной ткани рыб, чтобы справиться с уменьшением газообмена при дыхании и сохранить двигательную активность [24]. Также повышение было отмечено для уровня Ba, который был на 13,3 % (Р £ 0,05) выше контроля. Концентрация Al повышалась и во 2 группе (на 37,8 % (Р £ 0,05)), в то же время снижался уровень Ba (Р £ 0,05) и увеличивался уровень Sb (Р £ 0,05). В других опытных группах концентрация Sb сократилась до 66,7 % (Р £ 0,01). Высокие концентрации Sb могут привести к окислительному стрессу и снижению функций организма у рыб, однако для негативных последствий концентрация Sb в тканях рыб должна быть значительно выше, чем была в наших исследованиях [25]. При этом относительно мало известно об уровне Sn и Sr [26]. Во всех опытных группах установлено снижение концентрации Sn от 77,1 % (Р £ 0,01) до 94,3 % (Р £ 0,001). Вместе с тем в 1 группе повышался уровень Sr – до 65,6 % (Р £ 0,05) по отношению к контролю, однако содержание Sr во 2 и 4 группах снижалось до 41,8 % (Р £ 0,05). Следует отметить, что стронций является важным элементом для формирования чешуи у рыб [26].
Заключение
По итогам проведенного исследования можно сделать вывод, что представленные в рационе карпа биологически активные кормовые добавки не оказали негативного воздействия на элементный статус. Мышечная ткань рыб пригодна для употребления в пищу и не представляет опасности для здоровья человека. Более того, наиболее токсичные элементы (Pb, Cd, As, Hg) были обнаружены в незначительном количестве. В то же время содержание макроэлементов, эссенциальных и условно-эссенциальных элементов повышалось в опытных группах, в том числе отмечено увеличение концентрации Ca, K, Na, I, Fe.
Наиболее отличительные результаты были получены в 1 группе, которая дополнительно с основным рационом получала ванилин. Так, ванилин способствовал повышению концентрации жизненно необходимых элементов – Ca, K, Fe, Ni, в то же время снижая содержание Sb и Sn.
1. Fiorella K. J., Okronipa H., Baker K., Heilpern S. Contemporary aquaculture: implications for human nutrition // Current Opinion In Biotechnology. 2021. V. 70. P. 83–90.
2. Dawood M. A. O., Alagawany M., Sewilam H. The Role of Zinc Microelement in Aquaculture: a Review // Biological Trace Element Research. V. 200 (8). P. 3841–3853.
3. Ning L., Tan Y., Wang W. X., Wu S., Chen F., Zhang H., Pan Q. Optimum selenium requirement of juve-nile Nile tilapia, Oreochromis niloticus // Aquaculture Nutrition. 2021. V. 26. Iss. 2. P. 528–535.
4. Prabhu P. A. J., Silva M. S., Kröeckel S., Holme M.-H., Ørnsrud R., Amlund H., Lock E.-J., Waagbø R. Effect of levels and sources of dietary manganese on growth and mineral composition of post-smolt Atlantic salmon fed low fish meal, plant-based ingredient diets // Aquaculture. 2019. V. 512. P. 734287.
5. Sekhon B. S. Nanotechnology in agri-food produc-tion: an overview // Nanotechnology Sciences and Applications. 2014. V. 7. P. 31–53.
6. Silva V. F., Mouriño J. L. P., Martins M. L., Car-valho P. L. P. F., Rodrigues E. D., Gatlin 3rd D. M., Griffin M. J., Older C. E., Yamamoto F. Y. Dietary supplementation of mineral nanoparticles for channel catfish (Ictalurus punctatus) // Fish Physiology and Biochemistry. 2024. V. 50 (6). P. 2225–2236. DOI:https://doi.org/10.1007/s10695-024-01378-7.
7. Ratvaj M., Maruščáková I. C., Popelka P., Fečkani-nová A., Koščová J., Chomová N., Mareš J., Malý O., Žitňan R., Faldyna M., Mudroňová D. Feeding-Regime-Dependent Intestinal Response of Rainbow Trout after Administration of a Novel Probiotic Feed // Animals (Basel). 2023. V. 13 (12). P. 1892.
8. Ibrahim D., Kishawy A. T. Y., Khater S. I., Khalifa E., Ismail T. M., Mohammed H. A., Elnahriry S. S., Tolba H. A., Sherief W. R. I. A., Farag M. F. M., Abd El-Hamid M. I. Interactive effects of dietary quercetin nanoparticles on growth, flesh antioxidant capacity and transcription of cytokines and Aeromonas hydrophila quorum sensing orchestrating genes in Nile tilapia (Oreochromis niloticus) // Fish & Shellfish Immunology. 2021. V. 119. P. 478–489.
9. Rossi B., Esteban M. A., García-Beltran J. M., Gio-vagnoni G., Cuesta A., Piva A., Grilli E. Antimicrobial Power of Organic Acids and Nature-Identical Compounds against Two Vibrio spp.: An In Vitro Study // Microorgan-isms. 2021. V. 9 (5). P. 966.
10. Mohan K., Ravichandran S., Muralisankar T., Uthayakumar V., Chandirasekar R., Seedevi P., Abirami R. G., Rajan D. K. Application of marine-derived polysaccharides as immunostimulants in aquaculture: A review of current knowledge and further perspectives // Fish & Shellfish Immunology. 2019. V. 86. P. 1177–1193.
11. Pinto F. R., Duarte A. M., Silva F., Barroso S., Mendes S., Pinto E., Almeida A., Sequeira V., Vieira A. R., Gordo L. S., Gil M. M. Annual variations in the mineral element content of five fish species from the Portuguese coast // Food Research International. 2022. V. 158. P. 111482.
12. López-Berenguer G., Peñalver J., Martínez-López E. A critical review about neurotoxic effects in marine mammals of mercury and other trace elements // Chemosphere. 2020. V. 246. P. 125688.
13. Zoroddu M. A., Aaseth J., Crisponi G., Medici S., Peana M., Nurchi V. M. The essential metals for humans: a brief overview // Journal of Inorganic Biochemistry. 2019. V. 195. P. 120–129.
14. Аринжанова М. С., Мирошникова Е. П., Аринжанов А. Е., Килякова Ю. В. Биологическое действие ультрадисперсных частиц SiO2, пробиотического препарата Бифидобиом и комплекса микроэлементов на организм карпа // Животноводство и кормопроизводство. 2023. Т. 106. № 1. С. 48–66.
15. Vincent J. B. New Evidence against Chromium as an Essential Trace Element // The Journal of nutrition. 2017. V. 147. Iss. 12. P. 2212–2219.
16. Lall S. P., Kaushik S. J. Nutrition and Metabolism of Minerals in Fish // Animals. 2021. V. 11. Iss. 9. P. 2711.
17. Wischhusen P., Parailloux M., Geraert P.-A., Briens M., Bueno M., Mounicou S., Bouyssiere B., Prabhu P. A. J., Kaushik S. J., Fauconneau B., Fontagné-Dicharry S. Effect of dietary selenium in rainbow trout (Oncorhynchus mykiss) broodstock on antioxidant status, its parental transfer and oxidative status in the progeny // Aquaculture. 2019. V. 507. P. 126–138.
18. Lozano-Bilbao E., Jurado-Ruzafa A., Lozano G., Jiménez S., Hardisson A., Rubio C., Weller D. G., Paz S., Gutiérrez A. J. Development stage and season influence in the metal content of small pelagic fish in the North-West Africa // Chemosphere. 2020. V. 261. P. 127692.
19. Duarte A. M., Silva F., Mendes S., Pinto F. R., Barroso S., Silva E., Neves A., Sequeira V., Magalhães M. F., Rebelo R., Assis C., Vieira A. R., Gordo L. S., Gil M. M. Seasonal study of the nutritional composition of unexploited and low commercial value fish species from the Portuguese coast // Food Science & Nutrition. 2022. V. 10. Iss. 10. P. 3368–3379.
20. Varol M., Sünbül M. R. Macroelements and toxic trace elements in muscle and liver of fish species from the largest three reservoirs in Turkey and human risk assessment based on the worst-case scenarios // Environmental Research. 2020. V. 184. P. 109298.
21. Phoonaploy U., Tengjaroenkul B., Neeratanaphan L. Effects of electronic waste on cytogenetic and physiological changes in snakehead fish (Channa striata) // Environmental Monitoring and Assessment. 2019. V. 191. P. 363.
22. Мингазова М. С., Мирошникова Е. П., Аринжанов А. Е., Килякова Ю. В. Концентрация химических элементов в мышечной ткани карпа при включении в рацион биологически активных веществ // Животноводство и кормопроизводство. 2023. Т. 106. № 4. С. 18–29.
23. Shahjahan M., Taslima K., Rahman M. S., Al-Emran M., Alam S. I., Faggio C. Effects of heavy metals on fish physiology – A review // Chemosphere. 2022. V. 300. P. 134519.
24. Napolitano G., Capriello T., Venditti P., Fasciolo G., La Pietra A., Trifuoggi M., Giarra A., Agnisola C., Ferrandino I. Aluminum induces a stress response in zebrafish gills by influencing metabolic parameters, morphology, and redox homeostasis // Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 2023. V. 271. P. 109633.
25. Zou H.-T., Xu K., Yang A., Hu X., Niu A., Li Q. Antimony accumulation in zebrafish (Danio rerio) and its effect on genotoxicity, histopathology, and ultrastructure // Aquatic Toxicology. 2022. V. 252. P. 106297.
26. Kumar N., Bhushan S., Gupta S. K., Kumar P., Chandan N. K., Singh D. K., Kumar P. Metal determination and biochemical status of marine fishes facilitate the biomonitoring of marine pollution // Marine Pollution Bulletin. 2021. V. 170. P. 112682.
















