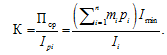Россия
При садковом выращивании осетровых рыб, особенно ценных в настоящее время, большое внимание следует уделять состоянию их здоровья. Наряду с другими патологическими проявлениями различной природы потенциальную опасность для данных объектов аквакультуры может представлять такое заболевание, как нефрокальциноз почек. Указанная патология зафиксирована у молоди стерляди (возраст 0+ лет), у неполовозрелых особей русского осетра (возраст 2 года), у которых были проведены клинические и патологоанатомические обследования, в том числе отобраны кусочки почек на гистологический анализ, пробы крови для проведения гематологических и биохимических исследований. Появление нефрокальци-натов в почках осетровых рыб было подтверждено с помощью гистологических методов: на микропрепаратах почек русского осетра и стерляди обнаружены соответствующие патологические трансформации. Морфофизиологические изменения состояния почек исследованных осетровых рыб можно оценить как не угрожающие жизни, средней и малой тяжести. Так, 60 % обследованных особей русского осетра не имели выявленных патогистологических изменений органа, среди стерляди таких особей было 80 %. При анализе гематологических и биохимических показателей крови найдены отклонения некоторых показателей. Так, у стерляди отмечен низкий уровень гемоглобина, у всех рыб насчитывалось недостаточное количество эритроцитов в крови; у русского осетра определен высокий уровень патологически измененных эритроцитов, повышено количество сывороточного белка, найдены отклонения в соотношении его фракций, высокий уровень мочевой кислоты, низкие показатели содержания в крови триглицеридов, β-липопротеидов, активности АЛТ и АСТ. Косвенно эти изменения физиологического состояния осетровых рыб при нефрокальцинозе свидетельствуют о том, что данное заболевание, вероятнее всего, возникло вследствие влияния на рыб комплекса факторов, среди которых главными могут быть нарушения гидрохимического режима и сбалансированности кормления.
русский осетр, стерлядь, нефрокальциноз, гематологические показатели, биохимические показатели крови
Введение
Истощение природных ресурсов осетровых рыб диктует необходимость активного развития осетроводства, имеющего два направления: искусственное воспроизводство и товарное осетроводство. Активное развитие товарного осетроводства способствует насыщению потребительского рынка ценной деликатесной рыбной продукцией [1]. На юге России широкое распространение садковый метод выращивания осетровых рыб получил в связи с тем, что природно-климатические условия позволяют использовать оптимальные температуры воды в течение 180–200 дней в году. К тому же сам регион имеет значительный объем водных ресурсов (ильмени, ерики), где могут быть установлены садки и организовано осетровое рыбоводное хозяйство [2]. На успех садкового осетроводства влияет физиологическое состояние и здоровье рыб, которое зависит от многих факторов, таких как гидрологические и гидрохимические условия содержания, качество кормов, отсутствие стрессовой ситуации и др. [2, 3].
К основным заболеваниям, отмеченным при заводском воспроизводстве и товарном выращивании осетровых рыб, можно отнести инфекционные (вирусные и бактериальные), инвазионные (триходиниоз, полиподиоз, диплостомоз и т. п.), а также незаразные – незаразный бранхионекроз, газопузырьковое заболевание, патологии внутренних органов (печени, почек), алиментарные заболевания [4].
Среди патологий почек выделяется такое заболевание, как нефрокальциноз. Данное заболевание у осетровых рыб возникает при устойчивом повышенном содержании в воде кальция, углекислоты. Оно также может быть вызвано кормлением несбалансированными по минеральным веществам искусственными кормами с недостатком или переизбытком минеральных веществ, дефицитом магния, избытком селена. Токсической причиной этого заболевания может быть действие сульфамеразина [5]. Важно предупредить появление у выращиваемых объектов атипичных образований почек, при развитии патологического процесса – вовремя обнаружить симптомы нефрокальциноза, чтобы своевременно улучшить условия выращивания, перейти на сбалансированные искусственные комбикорма.
Таким образом, цель научной работы – исследовать морфофункциональные особенности почек осетровых рыб, выращиваемых в условиях садковой аквакультуры при наличии у них подтвержденного нефрокальциноза, проследить изменения их гематологических и биохимических параметров крови.
Материалы и методы исследования
На садковом рыбоводном комплексе «Крестьянско-фермерское хозяйство Полякова Юлия Сергеевна» (Астраханская обл.), расположенном на рукаве Хурдун (нижняя зона дельты р. Волги), в районе с. Икряное (координаты 46° 06′ 03″– 46° 00′ 03″ с. ш., 47° 44′ 36″– 47° 32′ 56″ в. д.) летом 2022 г. было изучено 10 особей русского осетра (масса 752,00 ± 2,91 г, абсолютная длина 40,10 ± 0,46 см, возраст 2 года), осенью 2022 г. – 10 особей стерляди (масса 10,36 ± ± 2,16 г, абсолютная длина 13,63 ± 1,28 см, возраст 0+). У всех обследованных рыб был выявлен нефрокальциноз почек. Клиническое и патологоанатомическое обследования проведены в соответствии с общепринятыми методиками [6, 7].
От особей русского осетра и стерляди с обнаруженными включениями в почках взяты образцы крови из хвостовой вены для проведения гематологических и биохимических исследований. В образцах цельной крови изучено количество гемоглобина, эритроцитов (подсчет в камере Горяева) и СОЭ (на СОЭ-метре Панченкова ПР-3). Приготовленные мазки крови фиксированы в растворе этилового спирта (96º) и окрашены по Романовскому – Гимзе. С помощью микроскопа Olympus CX43 (Япония) были определены лейкоцитарная формула и степень патологии эритроцитов [7, 8].
В сыворотке крови русского осетра общепринятыми фотометрическими методами (спектрофотометр Эковью УФ-1200 (Россия); биохимический анализатор Сhemwell 2902 V+, (США)) определяли количество неорганического фосфора, кальция, общего белка, альбуминов, β-липопротеидов, холестерина, триглицеридов, глюкозы, мочевой кислоты и активность ферментов щелочной фосфатазы, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ). Были применены стандартные методики с использованием готовых наборов реагентов («Агат», «Ольвексдиагностикум», «Абрис+» (Россия)).
Для оценки патогистологических изменений были приготовлены микропрепараты почек. Биологический материал зафиксирован 10 %-м нейтральным формалином, залит в парафин, окрашен гематоксилин-эозином, а также по методу Маллори. Гистологические исследования выполнены по общепринятым методикам [9, 10]. Для оценки изменений в почках осетровых рыб использована четырехбалльная шкала (0−3), описанная в работах [11, 12] и модифицированная А. А. Лукиным с соавторами [13]. При выполнении данной работы было проведено 60 гематологических анализов, на мазках крови просмотрено 20 000 эритроцитов и 4 000 лейкоцитов, проведено 120 биохимических анализов сыворотки крови, проведен микроскопический гистологический анализ 20 препаратов почек.
Статистическую обработку данных проводили в программе MS Excel 2013. Данные представлены в виде средних значений и стандартных ошибок средних значений (Х + Sx).
Результаты и обсуждение
Нефрокальциноз описывается как отложения минеральных солей в почечных канальцах и собирательных трубочках. Однако макроскопическая визуальная оценка не является точным инструментом, поскольку небольшие отложения почти не видны невооруженным глазом [14]. Поэтому в настоящее время микроскопический гистологический метод считается стандартом оценки тяжести заболевания и прогрессирования патологического состояния у рыб. Классическая картина нефрокальцинозных изменений включает базофильные минеральные отложения, которые могут прогрессировать, включая расширение канальцев и собирательных трубочек, дегенерацию эпителия пораженных трубчатых структур, а также застой мочи, вызывающий дилатацию и фиброз в вышележащих структурах почек. Нарушение канальцевых структур, в том числе фиброз и воспаление, могут вызвать обширные тканевые реакции, вплоть до некроза [15].
Помимо выделительной системы, почка рыб также состоит из кроветворной, иммунной и эндокринной тканей, каждая из которых может быть повреждена при развитии нефрокальциноза. Соответственно, данное заболевание может вызывать изменения общего физиологического состояния, которые должны будут отразить морфофизиологические, гематологические и биохимические показатели крови рыб.
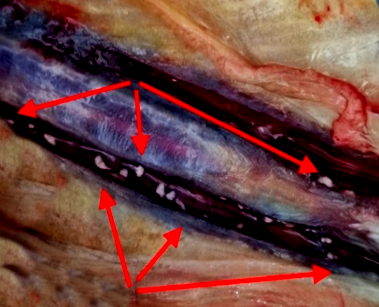
В целом результаты клинического и патологоанатомического обследования особей русского осетра и стерляди свидетельствовали о том, что морфофизиологическое состояние обследованных особей в ходе выращивания было удовлетворительным. Расположение органов рыб оставалось анатомически правильным, степень развития – соразмерна возрастной группе. Практически все обследованные органы не имели видимых физиологических нарушений, отклонений и аномалий, за исключением почек, в которых были отмечены белые включения – нефрокальцинаты (рис., а, б).
|
|
|
|
а
|
б
|
|
|
|
|
в |
г |
|
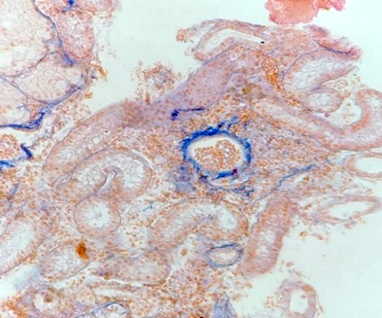
Нефрокальцинаты особей русского осетра (а, в, г) и стерляди (б), отобранных на садковом хозяйстве
Nephrocalcinates of individuals of Russian sturgeon (a, в, г) and sterlet (б) selected on a cage farm Astrakhan region, 2022: а, б – arrows indicate white inclusions – nephrocalcinates; в – hematoxylin-eosin stain, enh. 400; г – Mallory stain, enh. 400 |
|
Особи стерляди на момент исследования не достигли оптимальной массы своей возрастной группы согласно биотехническим нормативам [16]. При гистологическом анализе строения почек исследованных особей осетровых рыб обнаружены некоторые патоморфологические трансформации (рис., в, г): чаще всего в почечных тельцах регистрировались гиперцеллюлярность, небольшие кровоизлияния, мелкие скопления гемосидерина (рис., в), разрастания соединительной ткани вокруг почечных телец (рис., г). Мочевые пространства в почечных тельцах были сужены. Отмечена вариабельность диаметра почечных телец. Главные дегенеративные изменения проявлялись в отслоении от базальных мембран клеток эпителия извитых канальцев. У небольшой части канальцев в просветах содержались белковые массы.
Согласно 4-балльной оценке состояния органов почки обследованных осетровых рыб имели небольшую степень тяжести проявления патологических изменений. Так, 60 % особей русского осетра не имели визуально выявляемых патогистологических изменений почек, среди стерляди таких особей было 80 % (табл. 1).
Таблица 1
Table 1
Встречаемость патогистологических изменений почек и органов русского осетра
и стерляди с нефрокальцинатами в почках, содержащихся
на садковом хозяйстве Астраханской области, 2022 г.
The occurrence of pathohistological changes in the kidneys and organs of Russian sturgeon
and sterlet with nephrocalcinates in the kidneys contained on the cage farm of the Astrakhan region, 2022
|
Вид рыбы |
Встречаемость патогистологических изменений тканей и органов рыб, % рыб |
|||
|
0 баллов |
1 балл |
2 балла |
3 балла |
|
|
Визуально |
Повреждения |
Повреждения |
Признаки тяжелого повреждения, |
|
|
Русский осетр |
60 |
30 |
10 |
– |
|
Стерлядь |
80 |
10 |
10 |
– |
Средний уровень гемоглобина у изученных особей русского осетра составил 60,17 г/л, что соответствует референсным значениям, полученным для русского осетра при искусственном выращивании (44–88 г/л) [17]. У особей стерляди этот показатель оказался ниже границ референсных значений – 31,88 г/л. Общее количество эритроцитов
в крови было недостаточным как у русского осетра, так и у стерляди (табл. 2).
Таблица 2
Table 2
Гематологические показатели особей русского осетра и стерляди с нефрокальцинатами в почках,
содержащихся на садковом хозяйстве Астраханской области, 2022 г.
Hematological parameters of individuals of Russian sturgeon and sterlet with nephrocalcinates in the kidneys
contained in the cage farm of the Astrakhan region, 2022
|
Показатель |
Референсное значение (русский осетр / стерлядь)* |
Русский осетр |
Стерлядь |
|
Гематологические |
|||
|
Гемоглобин, г/л |
46,0–97,0 / 48,0–75,0 |
60,17 ± 5,42 |
31,88 ± 4,69 |
|
Количество эритроцитов, млн/мкл |
0,5–0,7 / 0,68–1,50 |
0,21 ± 0,05 |
0,32 ± 0,04 |
|
СОЭ, мм/ч |
менее 4 |
4,33 ± 1,33 |
1,00 ± 0,00 |
|
Эритробласты, % |
0,5 / 0 |
0,10 ± 0,06 |
0,20 ± 0,04 |
|
Нормобласты, % |
4,5–11 / 12–24 |
0,03 ± 0,03 |
2,70 ± 0,02 |
|
Зрелые эритроциты |
83,0–87,0 / 80,0–83,0 |
99,99 ± 0,01 |
97,69 ± 0,01 |
|
Эритроциты с патологией, % |
|||
|
Смещение ядер (к периферии), % |
Суммарно менее 5 % |
3,93 ± 0,18 |
0 |
|
Ядра тени, % |
2,07 ± 0,75 |
2,28 ± 0,48 |
|
|
Амитоз (шистоцит), % |
0,40 ± 0,17 |
0,05 ± 0,01 |
|
|
Пойкилоцитоз, % |
0,37 ± 0,09 |
0 |
|
|
Лизисные клетки, % |
0,03 ± 0,03 |
0 |
|
|
Анизоцитоз (микро), % |
0,43 ± 0,15 |
0 |
|
|
Пикноз, % |
0,27 ± 0,22 |
0 |
|
|
Вакуолизация цитоплазмы |
0 |
0,38 ± 0,26 |
|
|
Кариорексис |
0 |
0,08 ± 0,05 |
|
|
Инвагинация ядра |
0 |
0,03 ± 0,01 |
|
|
Гипохромазия |
0 |
0,10 ± 0,03 |
|
|
Лейкоцитарная формула |
|||
|
Молодые лейкоциты |
2,0–6,5 / 1,0–5,0 |
2,33 ± 1,20 |
0 |
|
Зрелые лимфоциты, % |
61,3–90,0 / 82,0–89,0 |
75,33 ± 3,71 |
82,9 ± 3,6 |
|
Эозинофилы, % |
7,4–22,1 / 0–11,0 |
6,33 ± 1,45 |
1,20 ± 0,70 |
|
Нейтрофилы, % |
1,0–7,0 / 3,0–9,0 |
16,00 ± 5,51 |
16,2 ± 3,7 |
* По данным [17–19].
Практически все эритроциты были представлены зрелыми формами. Следует отметить, что наличие патологичных включений в почках может нарушить их гемопоэтическую функцию и приводить к снижению количества эритроцитов. Известно, что у осетровых рыб в ткани мезонефроса формируется 44–46 % эритроцитов [20]. Подобное снижение количества эритроцитов было отмечено у радужной форели, пораженной нефрокальцинозом [21]. Средний уровень СОЭ у всех рыб соответствовал физиологической норме [18]. Общий уровень патологически измененных эритроцитов у изученных особей русского осетра составил 7,50 % от общего их числа, что выше нормы, а у стерляди – 2,92 % (см. табл. 2). Наиболее часто среди изменений эритроцитов у осетра встречались ядерные (эритроцитарные) тени (2,07 ± 0,75 %) и патологичное смещение ядер (3,93 ± 0,18 %), у стерляди в основном ядерные тени (2,28 ± 0,48 %). Морфологические изменения эритроцитов обычно связывают с неблагоприятным действием водной среды, активацией темпа эритропоэза, наличием патологического процесса в организме рыбы [22].
Среди клеток в лейкоцитарной формуле доминировали зрелые лейкоциты как у особей русского осетра (75,33 %), так и у стерляди (82,9 %); далее по численности следовали нейтрофилы; доля эозинофилов составила 6,33 % у осетра и 1,20 % у стерляди (см. табл. 2). В мазках периферической крови русского осетра и стерляди базофилов и моноцитов не было обнаружено. Соотношение грануло- и агранулоцитов в периферической крови практически соответствовало физиологической норме для осетровых рыб [18, 19].
У особей русского осетра была проведена оценка биохимических показателей крови. Полученные данные приведены в табл. 3.
Таблица 3
Table 3
Биохимические показатели сыворотки крови особей русского осетра с нефрокальцинатами в почках, содержащихся на садковом хозяйстве Астраханской области, 2022 г.
Biochemical parameters of blood serum of individuals of Russian sturgeon with nephrocalcinates in the kidneys contained in a cage farm in the Astrakhan region, 2022
|
Показатель |
Референсное значение* |
Значение (M ± m) |
|
Неорганический фосфор, ммоль/л |
2,16–4,07 |
3,60 ± 0,45 |
|
Кальций, ммоль/л |
1,72–4,81 |
2,98 ± 0,31 |
|
Общий белок, г/л |
20,0–25,0 |
38,37 ± 3,32 |
|
Альбумин, г/л |
14,0–18,0 |
24,71 ± 3,06 |
|
β-липопротеиды, г/л |
0,3–6,0 |
0,12 ± 0,01 |
|
Холестерин, г/л |
0,07–4,64 |
1,01 ± 0,15 |
|
Триглицериды, ммоль/л |
4,27–10,43 |
1,78 ± 0,31 |
|
Глюкоза, ммоль/л |
1,0–5,09 |
1,22 ± 0,52 |
|
Мочевая кислота, мкмоль/л |
3,57–38,66 |
173,62 ± 8,50 |
|
Щелочная фосфатаза, ед./л |
100,0–190,0 |
97,23 ± 9,27 |
|
АСТ, ед./л |
230,0–270,0 |
129,97 ± 5,87 |
|
АЛТ, ед./л |
40,0–80,0 |
36,40 ± 2,80 |
* По данным [17, 19].
Количество сывороточного белка у исследованных особей русского осетра составило 38,37 г/л. Уровень альбумина в крови составил 63 % от общего белка; обычно у осетровых их долю определяют в 25–35 % [23].
У животных, в том числе и у рыб, почки играют важную роль в метаболизме и реабсорбции аминокислот. Почечная дисфункция неблагоприятно изменяет концентрацию аминокислот в крови, способствуя распаду мышечных белков, также этот орган играет важную роль в белковом обмене [24]. Несколько повышенный уровень белка у исследованных особей, возможно, был следствием распада мышечного белка и, соответственно, увеличения его концентрации. Нарушение нормального функционирования почек могло привести к изменению соотношения белковых фракций.
Определенный уровень кальция (2,98 ммоль/л) соответствовал референсным значениям. Уровень фосфора (3,60 ммоль/л) находился у верхней границы нормы. У радужной форели, пораженной нефрокальцинозом, также наблюдался нормальный уровень этих показателей [21]. Метаболизм кальция и фосфора у рыб обычно происходит согласованно, причем растворимость этих веществ зависит от pH, что означает повышенную растворимость в кислой среде и осаждение солей фосфата кальция в щелочных условиях [25]. Можно предположить, что при достаточном уровне кальция и фосфора в организме русского осетра отложение минералов в почках может быть следствием повышения pH среды из-за нарушения гидрохимического режима. Еще одним последствием явилась метаболическая компенсация возникшего ацидоза, в связи с чем рыба могла снизить пищевую активность. Косвенно об этом свидетельствует концентрация мочевой кислоты (173,62 мкмоль/л) – азотсодержащего вещества, присутствующего в крови рыб, которая была значительно выше, чем ранее она в норме определялась в крови русского осетра [17]. На примере карпа было показано, что при недостатке корма уровень мочевой кислоты может повышаться [26]. К тому же
и уровень триглицеридов в крови изученных особей составил 1,78 ммоль/л, тогда как у русского осетра он может составлять в среднем 6,58 (4,27–10,43) ммоль/л [17]. Этот показатель у рыб снижается при недостаточном питании [27]. Уровень β-липопротеидов также был достаточно низким.
Активность щелочной фосфатазы соответствовала референсным значениям, определенным для русского осетра, а вот уровень активности АЛТ,
и особенно АСТ, был несколько ниже этих значений (см. табл. 3) [17, 19]. Аминотрансферазы, к которым относятся АСТ и АЛТ, очень важные ферменты метаболизма белков. Эти ферменты участвуют в реакциях трансаминирования, которые способствуют образованию необходимых для синтеза белка аминокислот, а также переходу части их в кетокислоты. За счет этих реакций при участии аминотрансфераз осуществляется взаимосвязь между обменом белков и углеводов [28]. Ранее подобное достоверное снижение активности АЛТ и АСТ при нефрокальцинозе, по сравнению со здоровыми рыбами, было зафиксировано у тиляпии [29], что является еще одним свидетельством нарушения белкового обмена
у рыб при наличии нефрокальциноза.
Заключение
Таким образом, при наличии визуально отмечаемых белых включений – нефрокальцинатов – и регистрации нефрокальциноза, подтвержденного гистологическим методом, у особей русского осетра и стерляди, выращиваемых в условиях садкового хозяйства Астраханской области, можно отметить, что повреждения почек были легкими по степени тяжести, не угрожающими рыбам гибелью. Однако ряд гематологических и биохимических показателей крови выходили за пределы нормы. Комплексная оценка отклонений этих показателей позволила предположить наличие воздействия на осетровых рыб неудовлетворительных гидрохимических условий их содержания. Как следствие этого, – возникновение нефрокальциноза, в том числе нарушение обмена веществ, особенно белкового. Гематологические и биохимические показатели крови оказались очень чувствительными при изменениях морфологии почек из-за симптомов нефрокальциноза. Полностью регулировать гидрохимические условия при выращивании осетровых рыб в садках на открытых водоемах пока не представляется возможным, соответственно, особое внимание в качестве меры предотвращения возникновения нефрокальциноза следует уделять полноценному сбалансированному кормлению осетровых рыб.
На основе полученных данных можно сделать заключение о выявлении нарушений обменных процессов у рыб при выращивании в садковых хозяйствах. Для более подробного изучения механизмов данной патологии у рыб научно-исследовательские работы данного направления необходимо продолжать. С целью предупреждения развития патологий у рыб – объектов аквакультуры, в том числе в садковых комплексах, расположенных на открытых водоемах, и для нормализации функционирования почек русского осетра и стерляди при обнаружении нефрокальцинатов необходима оптимизация условий выращивания и подбор сбалансированных кормов.
1. Абросимова Н. А., Васильева Л. М. Состояние и перспективы развития осетроводства на юге России // Вопр. рыб. хоз-ва Беларуси. 2016. № 32. С. 35–146.
2. Васильева Л. М., Горкина О. В., Лозовская М. В., Щербатова Т. Г. Лечебно-профилактические мероприятия при выращивании осетровых в садках // Естественные науки. 2012. № 2 (39). С. 154–159.
3. Пономарев С. В., Баканева Ю. М., Федоровых Ю. В. Аквакультура: учеб. СПб.: Лань, 2017. 440 с.
4. Казарникова А. В., Шестаковская Е. В. Основные заболевания осетровых рыб в аквакультуре. М.: Изд-во ВНИРО, 2005. 104 с.
5. Меркулов Я. Г., Марков И. А. Здоровый осетр. Атлас-справочник ихтиопатолога. Краснодар: Изд-во Агентства прикладного осетроводства, 2019. 110 с.
6. Мусселиус В. А., Головина Н. А. и др. Лабораторный практикум по болезням рыб: учеб. пособие. М.: Лег. и пищ. пром-ть, 1983. 296 с.
7. Методические указания по проведению гематологического обследования рыб: сб. инструкций по борьбе с болезнями рыб. М.: Отдел маркетинга АМБ-агро, 1999. Ч. 2. С. 69–97.
8. Иванова Н. Т. Атлас клеток крови. М: Лег. и пищ. пром-сть, 1983. 79 с.
9. Волкова О. В., Елецкий Ю. К. Основы гистологии с гистологической техникой. М.: Медицина, 1982. 304 с.
10. Микодина Е. В., Седова М. А., Чмилевский Д. А., Микулин А. Е., Пьянова С. В., Полуэктова О. Г. Гистология для ихтиологов: опыт и советы. М.: Изд-во ВНИРО, 2009. 112 с.
11. Аршаница Н. М., Лесников Л. А. Патолого-морфологический анализ состояния рыб в полевых и экспериментальных исследованиях // Методы ихтиотоксикологических исследований. Л.: ГосНИОРХ НПО Промрыбвод, 1987. С. 7−9.
12. Лесников Л. А., Чинарева И. Д. Патогистологический анализ состояния рыб при полевых и экспериментальных токсикологических исследованиях // 1-й Всесоюз. симп. по методам ихтиотоксиколог. исслед.: тез. докл. Л.: ГосНИОРХ НПО Промрыбвод, 1987. С. 81−82.
13. Лукин А. А., Даувальтер В. А., Новоселов А. П. Экосистема Печоры в современных условиях. Апатиты: Изд-во Кольс. науч. центра РАН, 2000. 192 с.
14. Klykken C., Reed A. K., Dalum A. S., Olsen R. E., Moe M. K., Attramadal K. J. K., Boissonnot L. Physiological changes observed in farmed Atlantic salmon (Salmo salar L.) with nephrocalcinosis // Aquaculture. 2022. V. 554. Р. 738104.
15. Fivelstad S., Hosfeld C. D., Medhus R. A., Olsen A. B., Kvamme K. Growth and nephrocalcinosis for Atlantic salmon (Salmo salar L.) post-smolt exposed to elevated carbon dioxide partial pressures // Aquaculture. 2018. V. 482. Р. 83–89.
16. Васильева Л. М., Яковлева А. П. и др. Технологии и нормативы по товарному осетроводству в VI рыбоводной зоне. М: Изд-во ВНИРО, 2006. 100 с.
17. Cassel S. E., Yanong R. P. E., Pouder D. B., Rodri-guez C., Mylniczenko N., Thompson P. M., Stilwell N. K., Heym K. J., Harmon T., Stacy N. I. Reference intervals for blood analytes of adult aquarium-housed russian sturgeon Acipenser gueldenstaedtii // Journal of aquatic animal health. 2021. V. 33 (1). Р. 33–43.
18. Головина Н. А., Романова Н. Н. Лабораторный практикум по физиологии животных. СПб.: Лань, 2019. 136 с.
19. Пронина Г. И., Корягина Н. Ю. Референсные значения физиолого-иммунологических показателей гидробионтов разных видов // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2015. № 4. С. 103–108.
20. Грушко М. П., Светашева Д. Р. Сравнительная морфофизиологическая характеристика органов крове-творения осетровых рыб и земноводных на стадии развития // Тр. ВНИРО. 2017. Т. 167. С. 12–23.
21. Minarova H., Palikova M., Kopp R., Maly O., Mares J., Mikulikova I., Papezikova I., Piacek V., Pojezdal L., Pikula J. Nephrocalcinosis in farmed salmonids: diagnostic challenges associated with low performance and sporadic mortality // Frontiers in veterinary science. 2023. V. 10. Р. 1121296.
22. Давыдов О. Н., Темниханов Ю. Д., Куровская Л. Я. Патология крови рыб. Киев: ИНКОС, 2006. 206 с.
23. Asadi F., Hallajian A., Asadian P., Shahriari A., Pourkabir M. Serum lipid, free fatty acid, and proteins in juvenile sturgeons: Acipenser persicus and Acipenser stellatus // Comp. Clin. Pathol. 2009. V. 18. Р. 287–289.
24. Li X., Zheng S., Wu G. Amino Acid Metabolism in the Kidneys: Nutritional and Physiological Significance // Amino Acids in Nutrition and Health. Advances in Experi-mental Medicine and Biology. 2020. V. 1265. Р. 71–95.
25. Perry S. F., Gilmour K. M. Acid-base balance and CO2 excretion in fish: unanswered questions and emerging models // Respiratory Physiology & Neurobiology. 2006. V. 154. Р. 199–215.
26. Пронина Г. И. Физиолого-иммунологическая оценка культивируемых гидробионтов: карпа, сома обыкновенного, речных раков: автореф. дис. ... д-ра биол. наук. М.: Изд-во РГАУ МСХА им. К. А. Тимирязева, 2012. 39 с.
27. Маслова Н. И., Петрушин А. Б., Пронина Г. И., Ревякин А. О. Особенности изменения биохимического состава крови пойкилотермных биомоделей при недостаточном питании // Биомедицина. 2011. № 3. С. 37–39.
28. Фролов Ю. П., Серых М. М. и др. Биохимия и молекулярная биология: учеб. пособие для вузов / под ред. Ю. П. Фролова. Самара: Изд-во «Самарский университет», 2004. 501 с.
29. Chen C-Y., Wooster G. A., Getchell R. G., Bowser P. R., Timmons M. B. Blood chemistry of healthy, nephrocalcinosis-affected and ozone-treated tilapia in a recirculation system, with application of discriminant analysis // Aquaculture. 2003. V. 218 (1). Р. 89–102.