Россия
Современные реалии, в частности необходимость расширения импортозамещения, способствуют развитию новых или альтернативных путей в обеспечении продовольственной безопасности Российской Федерации. В этой связи рассматривается целесообразность применения аквапонических систем для выращивания гидробионтов и различных видов микрозелени. Результаты мониторинга гидрохимического режима свидетельствуют о снижении концентрации аммиак-аммония, нитритов, нитратов относительно содержания этих же форм азота в рыбоводных емкостях без применения аквапоники в 1,9; 2,2 и 1,6 раза соответственно, что благотворно отразилось на размерно-весовых показателях выращиваемых рыб. Средняя масса экземпляров тиляпии нильской, культивируемой в условиях аквапонической системы, а также абсолютная скорость роста особей превысили аналогичные показатели контрольной группы в 1,5 и 1,7 раза соответственно. Рыбы, входящие в экспериментальную группу, также характеризовались и большей длиной тела относительно экземпляров контрольной совокупности. Продолжительность вегетационного периода микрозелени в зависимости от культуры варьировала от 13 до 25 суток. Наибольшей зеленой массой, количеством листьев, высотой, развитостью корневой системы и более коротким относительно других опытных образцов растений (руколы и кресс-салата) циклом выращивания характеризовались различные виды и гибридные формы базилика. Результаты проведенных исследований свидетельствуют о высокой адаптации данной культуры к существованию в условиях аквапоники, поэтому ее необходимо рассматривать как одну из ключевых для данного типа выращивания. Полученные результаты позволяют рекомендовать применение совместного культивирования микрозелени и гидробионтов в качестве ресурса повышения экономической эффективности деятельности индустриальных систем аквакультурных хозяйств.
аквапоника, тиляпия нильская, микрозелень, формы азота, средняя масса и длина, абсолютный прирост, вегетационный период, урожайность
Введение
Развитие современного общества сопряжено с возрастающей антропогенной нагрузкой на различные составляющие биосферы, что неминуемо приводит к ухудшению экологической ситуации в целом. Уже сейчас остро стоят проблемы нехватки водных ресурсов и деградации земель. Сложившиеся условия диктуют необходимость поиска, разработки и применения новейших инновационных технологий, одной из которых является аквапоника – перспективное направление сельскохозяйственной индустрии [1]. На сегодняшний день это единственный производственный процесс, способный обеспечить продовольственную сферу экологически чистой продукцией, создание которой исключает негативные последствия для окружающей среды [2, 3]. Помимо очевидной положительной роли аквапоники в сохранении природных ресурсов, немаловажное значение эта форма хозяйственной деятельности имеет в повышении экономической эффективности аквакультуры как отрасли. В частности, в качестве дополнительного резерва, способствующего увеличению доходности предприятий и обеспечению их стабильности на рынке, следует рассматривать востребованные потребителем растительные культуры [4]. Экспериментальные исследования свидетельствуют о целесообразности и экономической эффективности применения метода аквапоники для выращивания объектов с коротким вегетационным периодом (45–60 дней), что позволяет получить в течение года до 25–30 урожаев [5, 6]. К категории подобных культур относится микрозелень (Microgreens), обладающая рядом неоспоримых преимуществ и хозяйственно полезных признаков. Интерес к этому виду ресурсных растений активно поддерживается общественностью, многие приравнивают их к суперфудам и считают намного более полезной альтернативой традиционной листовой зелени. В частности, концентрация некоторых витаминов (С, Е и К) и каротиноидов (β-каротин, лютеин и зеаксантин) в двадцати пяти разновидностях микрозелени в сравнении с традиционной растительной продукцией, собранной на стадии коммерческой спелости, оказалась в 10 раз выше (в зависимости от сорта растения и исследуемого вещества) [7–10]. Микрозелень также богата клетчаткой, одной из функций которой является выведение токсинов из организма [11]. Хлорофилл молодых побегов препятствует изменению молекул ДНК, поэтому может рассматриваться в качестве онкопротектора. Он также способствует очищению печени, блокирует радионуклиды, является действенным способом борьбы с малокровием, повышая синтез пигментов крови, нормализует микробиоту кишечника [12]. По мнению ряда ученых, включение ростков в рацион питания позволяет обогатить его ферментами, антиоксидантами и полисахаридами (клетчатка и пектины) и пр. [13], что способствует нормализации обмена веществ, повышению иммунитета, эффективному пищеварению, замедлению процессов старения организма [14].
Современные реалии существования общества диктуют приверженность к правильному питанию как одному из ключевых составляющих здорового образа жизни населения, поэтому разработка и совершенствование технологии совместного выращивания объектов аквакультуры и сельскохозяйственных растений (микрогрина) в условиях аквапонных систем является в настоящее время крайне актуальной задачей.
Цель исследований – анализ результатов совместного культивирования тиляпии нильской (Oreochromis niloticus) и различных видов микрогрина, выявление на основе проведенных экспериментов наиболее продуктивного типа взаимодействия.
Материалы и методы исследований
Объектами исследования являлись молодь тиляпии нильской (Oreochromis niloticus) начальной массой 1,68 г и различные виды микрозелени. Кормление рыб осуществлялось комбикормами, произведенными компанией Dibaq Diproteg с применением автоматических кормушек JEBAO WSQ-1. Суточный рацион составлял в начале выращивания 20 %, постепенно снижаясь до 1,3 % от биомассы рыб при кратности кормления 2 раза в день. Размерно-весовые характеристики, а также абсолютная скорость роста (абсолютный прирост) тиляпии определялись согласно рекомендациям И. Ф. Правдина [15]. Температура, содержание растворенного в воде кислорода, активная реакция среды оценивались при помощи многофункционального портативного прибора ЭКСПЕРТ-001. Концентрация нитритов, нитратов и аммонийного азота определялась тестами JBL ProAquaTest CombiSet Plus. В качестве аэратора использовались поршневые компрессоры Hailea Electrical Magnetic AC ACO-308. Водообмен обеспечивался с помощью погружных насосов Tetra EX 1500 Plus.
Для данной аквапонной установки применялась LED фито панель «Вега» на базе светодиодов SMD5630/5730 (красные, длиной волны 630–660 нм и синие, длиной волны 430–460 нм). Яркость освещения составляла 6 600 лк, продолжительность светового дня – 12 ч. В качестве культивируемых растений были выбраны имеющая небольшой период созревания микрозелень базилик микс сортов Зеленый ароматный, Ред Рубин, Арарат, Коричневый, Бутербродный лист, Гвоздичный; рукола культурная (Индау) сорт Сакраменто селекционно-семеноводческой фирмы ГАВРИШ; кресс-салат сорт Курлед агрофирмы Johnsons Seeds. Проращивание семян, выращивание рассады отдельно (вне системы) не производились, семена сразу помещались в субстрат. Урожайность оценивали по полученной в конце выращивания зеленой массе растений, количеству листьев, высоте, развитости корневой системы. Статистическую обработку результатов проводили с использованием программы Microsoft Excel 2019.
Результаты и обсуждение
Как известно, одним из важнейших условий, определяющих успех рыбоводного процесса, является благоприятный гидрохимический режим, в частности содержание связанных форм азота, не выходящее за пределы установленных нормативных значений. Превышение концентрации нитритов способствует развитию гемической и гистотоксической гипоксии, вызывающей у гидробионтов тяжелейшие сдвиги в метаболизме, подавление систем антиоксидантной защиты организма с последующими деструктивными процессами на уровне ферментативных реакций, гуморальных факторов регуляции и клеточных мембран [16]. Нитратная интоксикация рыб способствует изменению клеточного состава периферической крови [17], поэтому мониторинг концентраций форм азота в процессе выращивания гидробионтов является крайне важным методом, позволяющим оценить эффективность функционирования аквапонной установки.
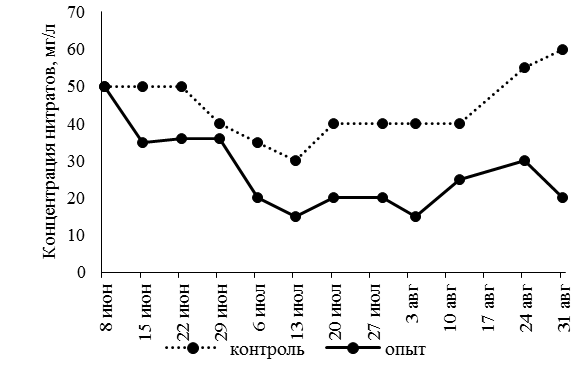
Содержание растворенного в воде кислорода не опускалось ниже 6,5 мг/л, что соответствует нормативным показателям для рыбоводных хозяйств. Активная реакция среды (pH) в основном была нейтральной, иногда смещаясь в щелочную сторону. Проведенные наблюдения за динамикой содержания нитритов, нитратов, аммония свидетельствуют о том, что их концентрация в аквапонной установке была ниже, чем в рыбоводных емкостях (рис. 1).
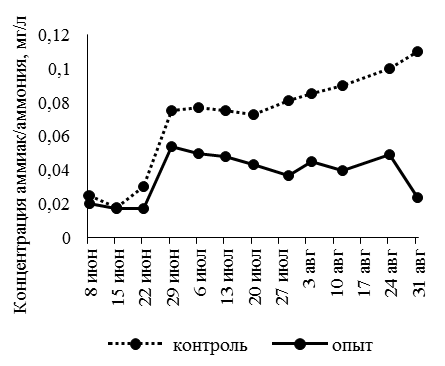

а б
в
Рис. 1 (окончание). Динамика концентраций азотсодержащих соединений в рыбоводных емкостях: а – NH3/NH4; б – NO2 ; в – NO3
Fig. 1 (ending). Dynamics of concentrations of nitrogen-containing compounds in fish tanks:а – NH3/NH4; б – NO2; в – NO3
Величина содержания аммиак-аммония в аквапонной установке составила в среднем – 0,04 ± 0,06 мг/л, нитритов – 0,193 ± 0,02 мг/л, нитратов – 26,83 ± 0,10 мг/л, что меньше в 1,9; 2,2 и 1,6 раза соответственно, чем в бассейнах, где рыба выращивалась без применения аквапоники.
Одним из важнейших факторов, позволяющих оценить эффективность функционирования аквапонной установки, является темп линейно-весового роста гидробионтов. В процессе исследований установлено превышение данного показателя у опытной группы рыб (табл. 1).
Таблица 1
Table 1
Динамика размерно-весовых показателей молоди тиляпии нильской,
содержащейся в условиях аквапонной системы
Dynamics of the size and weight parameters of the juvenile tilapia of the Nile
contained in the conditions of the aquaponic system
|
Период экспериментального выращивания, сут |
Масса, г |
Длина, см |
||
|
Опыт |
Контроль |
Опыт |
Контроль |
|
|
7 |
3,04 |
2,24 |
3,95 |
3,60 |
|
14 |
4,99 |
4,29 |
4,71 |
4,39 |
|
21 |
6,33 |
4,94 |
5,55 |
5,02 |
|
28 |
8,81 |
5,98 |
6,09 |
5,36 |
|
35 |
13,68 |
9,62 |
7,25 |
6,41 |
|
42 |
19,67 |
12,47 |
8,15 |
6,98 |
|
51 |
24,33 |
16,27 |
8,97 |
7,70 |
|
57 |
29,45 |
15,00 |
9,31 |
7,41 |
|
65 |
34,98 |
20,03 |
10,2 |
8,34 |
|
77 |
41,07 |
24,13 |
10,37 |
8,94 |
|
91 |
48,46 |
33,40 |
11,39 |
9,56 |
В возрасте 91 сут средняя масса экземпляров тиляпии нильской, содержащейся в условиях аквапонической системы, составила 48,46 г (отдельные экземпляры достигали 63 г), что практически в 1,5 раза выше аналогичного показателя молоди контрольной совокупности. Наибольшей длиной также характеризовались особи экспериментальной группы. Некоторые экземпляры достигали 14 см и более (рис. 2).

Рис. 2. Молодь нильской тиляпии в возрасте 3 мес, выращенная в условиях аквапонной установки
Fig. 2. Juveniles of the Nile tilapia at the age of 3 months, grown in an aquaponic installation
Более высокая абсолютная скорость роста (абсолютный прирост) был присуща особям, содержащимся в условиях аквапонической системы. Данная величина, составившая 0,5 г/сут, превышала аналогичный показатель экземпляров контрольной группы практически в 1,7 раза.
В ходе исследований был изучен режим выращивания микрозелени в условиях аквапоники (рис. 3).

Рис. 3. Микрозелень базилик микс, полученная аквапонным методом
Fig. 3. Microgreens basil mix obtained by the aquaponic method
Продолжительность вегетационного периода варьировала от 13 до 25 дней в зависимости от вида культуры, что позволило получить ранний урожай витаминной зелени, который составил от 195 до 274 г с лотка. Наибольшей биомассой характеризовался микрогрин базилика, что свидетельствует о хорошей приспособляемости данного вида растительных культур к существованию в условиях аквапонических систем. Результаты наблюдений представлены в табл. 2.
Таблица 2
Table 2
Урожайность микрозелени при выращивании в условиях аквапонной установки
The yield of microgreens in growing under conditions of an aquaponic installation
|
Показатель |
Рукола культурная (Индау) |
Базилик микс |
Кресс-салат |
|
Продолжительность вегетационного периода, дней |
25 |
14 |
13 |
|
Высота растений, см: |
|||
|
через 5 дней после всходов; |
5,2 |
4,0 |
4,2 |
|
через 13, 14 дней после всходов; |
10,0 |
9,2 |
8,5 |
|
через 25 дней после всходов |
20,0 |
– |
– |
|
Урожай микрозелени с лотка 25 × 50 см, г |
195 |
274 |
219 |
Проведенные исследования подтверждают высокую эффективность фитофильтра как одного из ключевых составляющих аквапонной системы, функциональная роль которого заключается в нивелировании токсического воздействия различных форм азота, являющихся продуктом метаболизма, на гидробионтов. При этом существенную роль
в эффективности фитофильтра играет объем или площадь корневой системы растений.
Заключение
Результаты экспериментального выращивания тиляпии нильской и микрозелени в условиях аквапонной системы свидетельствуют о несомненных преимуществах данного типа культивирования гидробионтов и растений. В частности, средняя масса рыб, содержащихся в указанных условиях, а также их абсолютная скорость роста превысили аналогичные показатели контрольной группы в 1,5 и 1,7 раза соответственно. Таким образом, рекомендуется применение данного типа культивирования как одного из элементов, способствующих повышению экономической эффективности функционирования аквакультурных хозяйств индустриального типа.
1. Григорьев В. А., Ковалева А. В., Сорокина М. Н. Опыт совместного выращивания клариевого сома (Clarias gariepinus Burchell, 1822) и салата (Lactuca sativa L.) методом аквапоники // Естественные науки. 2015. № 4 (53). С. 96–101.
2. Ивкин М. М. Исследование некоторых методов работы с аквапоникой для выращивания растений в емкостях на субстрате // Научно-технический STARTUP 2021: сб. ст. Междунар. науч.-исслед. конкурса (Петрозаводск, 10 января 2022 г.). Петрозаводск: Междунар. центр науч. партнерства «Новая Наука», 2022. С. 65–75.
3. Сулайманова Н. Ч. Аквапоника – рациональный метод выращивания растений и рыб // Студент года 2021: сб. ст. Междунар. учеб.-исслед. конкурса (Петрозаводск, 19 мая 2021 г.). Петрозаводск: Междунар. центр науч. партнерства «Новая Наука», 2021. Ч. 2. С. 382–390.
4. Ромашова Ю. А. Совместное выращивание гидробионтов и растений как перспективное направление развития индустриальной аквакультуры // Интеллектуальный потенциал молодых ученых как драйвер развития АПК: материалы Междунар. науч.-практ. конф. молодых ученых и обучающихся (Санкт-Петербург, Пушкин, 24–26 марта 2021 г.). СПб.: Изд-во Санкт-Петерб. гос. аграр. ун-та, 2021. Ч. 1. С. 260–262.
5. Гридина Т. С. Инновационная биотехнология вы-ращивания объектов аквакультуры и сельскохозяйственных растений с применением биопрепарата в искусственно сформированной системе этажного типа // Аквакультура осетровых рыб: проблемы и перспективы: материалы докл. Междунар. науч.-практ. конф. (Астрахань, 10–12 октября 2017 г.). Астрахань: Изд-во Астрахан. гос. ун-та, 2017. С. 74–77.
6. Белоус А. В., Мурашев С. В. Микрозелень – продукт питания для людей с современным ритмом жизни // Вестн. Студенч. науч. о-ва. 2018. Т. 9. № 1. С. 234–236.
7. Иванова М. И., Литнецкий А. Ю., Литнецкая О. Л., Кашлева А. И., Разин А. Ф. Микрозелень (Microgreens) и сеянцы (Baby leafs) – новые категории органической овощной продукции // Новые и нетрадиционные растения и перспективы их использования. 2016. № 12. С. 406–415.
8. Xiao Z., Lester G. E., Luo Y., Wang Q. Assessment of vitamin and carotenoid concentrations of emerging food products: edible microgreens // Journal of agricultural and Food Chemistry. 2012. V. 60. N. 31. P. 7644–7651.
9. Di Gioia F., Santamaria P. The nutritional properties of microgreens Las propiedades nutricionales de las micro-hortalizas // Microgreens: Novel, fresh and functional food to explore all the value of biodiversity. Publisher: Eco-logica. Chapter: 3. P. 41–50.
10. Ivanova M. I., Litnetskii A., Litnetskaya O., Kash-leva A. I., Razin A. F. Microgreens and Baby leafs – New Categories of Organic Vegetable Products // New and non-traditional plants and prospects for their use. 2016. N. 12. P. 406–415.
11. Самбуров А. М. Проросток и микрозелень как особый вид нетрадиционного сырья // Конкурентоспособность территорий: XXIII Всерос. эконом. форум молодых ученых и студентов. Екатеринбург, 2020. Т. 1. С. 111–113.
12. Степанова Н. Ю. Производство и пищевая ценность пряностей // Научное обеспечение развития АПК в условиях реформирования: материалы Науч.-практ. конф. «АПК России: прошлое, настоящее, будущее»(Санкт-Петербург, 29–31 января 2015 г.). СПб.: Изд-во СПбГАУ, 2015. С. 280–283.
13. Amato M., Caruso M. C., Guzzo F., Commisso M., Bochicchio R., Galgano F. Nutritional quality of seeds and leaf metabolites of Chia (Salvia hispanica L.) from Southern Italy // European Food Research Technology. 2015. N. 3. P. 615–625.
14. Adom K. K., Liu R. H. Antioxidant activity of grain // Journal Agriculture Food Chemistry. 2002. N. 50. P. 6182–6187.
15. Правдин И. Ф. Руководство по изучению рыб. М., 1966. 376 с.
16. Черкесова Д. У., Шахназарова А. Б. Токсическое воздействие нитритов на организм рыб. URL: https://cyberleninka.ru/article/n/toksicheskoe-vozdeystvie-nitritov-na-organizm-ryb (дата обращения: 26.07.2023).
17. Верголяс М. Р. Определение токсичности нитратов с использованием цитоморфологических параметров разных тканей рыб как биомаркера. URL: https://cyberleninka.ru/article/n/opredelenie-toksichnosti-nitratov-s-ispolzovaniem-tsitomorfologicheskih-parametrov-raznyh-tkaney-ryb-kak-biomarkera (дата обращения: 02.05.2023).
















