Россия
Россия
Приведены сведения о распространении чужеродного для ихтиофауны Дагестана вида – амурского чебачка Pseudorasbora parva (Temminck et Schlegel, 1846) – в пределах региона. Установлено, что вид расширил свой ареал в рассматриваемом регионе, в 2021 г. обнаружен в реках Манасозень (9 экз.), Гамриозень (10 экз.), Уллучай (6 экз.), Рубас (6 экз.), Аварское Койсу (приток р. Сулак, в районе расположения Гоцатлинской ГЭС), а также в оз. Мочох. Предположено, что широкое распространение P. parva связано с высокой экологической пластичностью, миграционной активностью личинок и мальков, большой их выживаемостью, быстрым ростом и ускоренным половым созреванием. Представленная морфологическая изменчивость популяции амурского чебачка на основании изучения 20 признаков, в том числе 5 меристических и 15 пластических, выявила незначительную вариабельность морфологических признаков, обусловленную различными условиями среды обитания в регионе. Амурский чебачок является природным очагом инфекционной болезни плавательного пузыря, опасной для автохтонной ихтиофауны и объектов аквакультуры, и пищевым конкурентом и потребителем икры и личинок автохтонных рыб. При высокой численности и длительном голодании P. parva может составить серьезную конкуренцию для молоди карпа и пестрого толстолобика, проявлять хищническую реакцию по отношению к соразмерной молоди промыслово-ценных видов рыб. Для контроля численности этого вселенца в регионе целесо-образно использование аборигенных хищников – речного окуня Perca fluviatilis (Linnaeus, 1758), щуки Esox lucius (Linnaeus, 1758) и судака Sander lucioperca (Linnaeus, 1758).
Дагестан, водоемы, инвазивный вид, амурский чебачок, Pseudorasbora parva, интродукция, морфология, численность
Введение
Амурский чебачок Pseudorasbora parva (Temminck et Schlegel, 1846) – мелкая короткоцикловая рыба из семейства Cyprinidae (единственный представитель рода Pseudorasbora в ихтиофауне России), с длиной тела, не превышающей 11 см, и максимальной продолжительностью жизни 5 лет. Подходящими биотопами для P. parva являются различные мелководные водоемы, теплые слабопроточные участки рек и озер, а также заросшие участки [1, 2]. В естественной среде встречается в р. Амур, во внутренних водоемах Китая, Монголии, Японии, Кореи, Лаоса, Тайваня и на островах Хайнань [3].
Согласно мировым данным целенаправленная антропогенная реконструкция фауны водных экосистем зачастую приводит к значительному повышению числа неаборигенных видов рыб. Интродукция новых видов далеко не всегда положительно сказывалась на повышении рыбопродуктивности. Известно много примеров, когда интродукция чужеродных видов изменяла существующие пищевые цепи, что приводило к нарушению экологического баланса и вытеснению эндемичных видов [4]. В бывшем СССР водоемы Северного и Северо-Западного Кавказа были одним из основных полигонов по целенаправленной акклиматизации рыб. В качестве объектов для экспериментальной акклиматизации использовали виды: пиленгас Liza haematocheilus (Temminck et Schlegel, 1845), сингиль Chelon auratus (Risso, 1810), остронос Chelon saliens (Risso, 1810), кета Oncorhynchus keta (Walbaum, 1792), горбуша Oncorhynchus gorbuscha (Walbaum, 1792), малоротый буффало Ictiobus bubalus (Rafinesque, 1818), большеротый буффало Ictiobus cyprinellus (Valenciennes, 1844), хольбрукская гамбузия Gambusia holbrooki (Girard, 1859), белый толстолобик Hypophthalmichthys molitrix (Valenciennes, 1844), пестрый толстолобик Aristichthys nobilis (Richardson, 1845), белый амур Ctenopharyngodon idella (Valenciennes, 1844) [5]. За последние 50 лет P. parva распространилась по водоемам Евразии, значительно расширив свой ареал в результате непреднамеренной интродукции, когда для вселения были завезены дальневосточные виды рыб [2, 6]. В период 1954–1961 гг. молодь белого амура (в количестве 2,4 млн экз.) была завезена из Китая для разведения в прудах и водохранилищах бывших республик СССР в Средней Азии, Казахстане, Украине, Молдавии, а также в бассейне р. Кубань. А уже позднее, начиная с 1964 г., особенно широкомасштабно в 1970–1980 гг., подращенная молодь дальневосточных видов (H. molitrix, A. nobilis, а также C. idella) выпускалась в дельты рек Волга, Урал, Кура, Терек, водохранилища Волго-Донского канала, внутренние водоемы Дагестана [7]. В эти периоды P. parva, который очень похож на сеголеток
C. idella, также проник в искусственные биотопы, оптимально подходящие для экологии данного вида.
В результате бракеражной интродукции, благодаря благоприятным условиям среды амурский чебачок широко расселился в водоемах и водотоках Средней Азии и Казахстана [8, 9], Грузии [10], Армении [11], Азербайджана [6], Ирана [12], а также по всей южной части Европы до Англии [13–15]. Данный вид рыбы характеризуется как самый инвазивный в Европе, представляющий опасность для местной ихтиофауны из-за передачи нового патогена и нежелательного воздействия, возникающего в результате процессов, включающих усиление межвидовой конкуренции [15]. В Великобритании P. parva впервые зарегистрирован в аквакультуре в 1986 г., а в естественных водоемах – в 1996 г. Этот вид рыб является природным очагом инфекционной болезни плавательного пузыря, опасной для автохтонной ихтиофауны и объектов аквакультуры [14]. Занесение в водные объекты чужеродных видов рыб, распространяющих сопутствующих паразитов, может вызвать нежелательные изменения генетического разнообразия аборигенов, что негативно отразится на сохранении редких и особо ценных видов [15].
Благодаря своей высокой экологической пластичности, репродуктивной специфике, защите потомства и высокой миграции личинок и мальков [16] уже в начале 1970-х гг. P. parva проник в природные пресные водоемы Понто-Каспийско-Аральской провинции. Основным источником P. parva в естественных водоемах являются расположенные вблизи прудовые хозяйства. В настоящее время в Европейской части России популяции амурского чебачка встречаются в бассейнах рек Кубань, Дон, а также в нижнем течении рек Кума и Терек [5, 7, 17], в частности, есть данные о выходе P. parva в Таганрогском заливе Азовского моря, где соленость колеблется от 5 до 7 ‰ [18]. В целом на сегодняшний день имеется много литературных сведений о внеареальном распространении амурского чебачка.
Недостаточно внимания уделялось изучению биологии большинства интродуцированных видов в природных водах Северо-Западного Кавказа.
Во многих случаях информация, полученная десятилетия назад, переносилась из одного литературного источника в другой без проверки. В работе А. Н. Пашкова с соавторами [5] анализировались рыбы из притоков р. Кубань, но нет упоминаний р. Терек, однако ссылка на этот источник ошибочно приведена в работах Д. П. Карабанова и др. [6, 19].
Основная цель настоящей работы – выяснить современные границы распространения инвазивного вида – амурского чебачка – в пределах водоемов и водотоков Дагестана, поскольку достоверные и систематизированные данные о расселении данного вида, как и других инвазивных видов, в регионе до настоящего времени отсутствовали.
Материалы и методы
Ихтиологический материал по P. parva собирался в период с 2020 по 2022 г. из следующих водных объектов Дагестана: в водотоках – реках Манасозень (возле с. Манас), Гамриозень (возле с. Каякент), Уллучай (возле с. Татляр), Рубас (возле с. Рубас) и водоемах – в оз. Мочох (возле с. Мочох) и в водохранилище Гоцатлинской ГЭС (возле с. Чалда). С использованием рыболовных сачков (длина рукоятки 1,5 м, диаметр 50 см, ячея дели 3 мм) в водотоках и мальковой волокуши (длина 6 м, высота 1,2 м, ячея в крыльях 5,5 мм (килечная дель), куток – газовое сито № 7) в водоемах всего было собрано и проанализировано 45 экз. рыб с 6 станций. В реках (водотоках) P. parva особенно часто встречался на участках со слабым течением (0,4–0,6 м/с) и с обильной водной растительностью. Места находок и сбора амурского чебачка представлены на рис., а видовой и количественный составы уловов приведены в табл. 1.
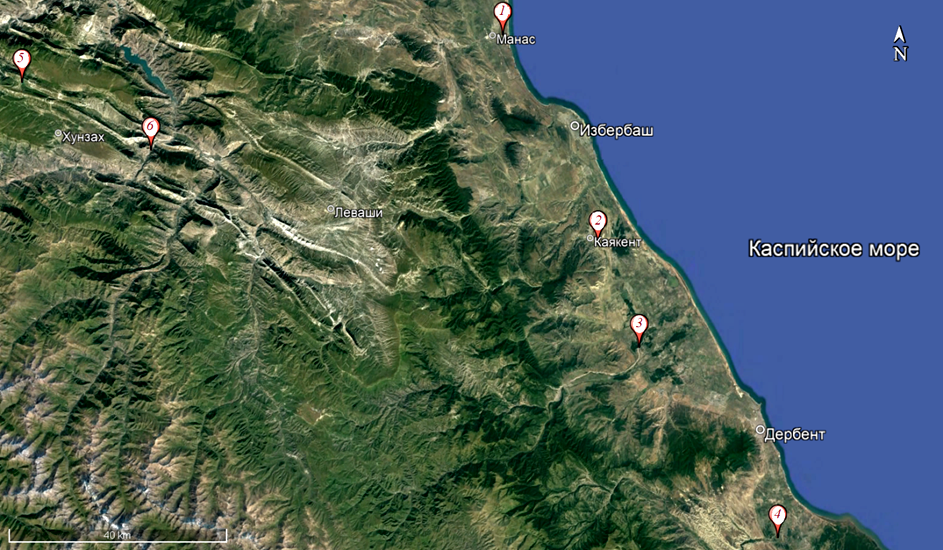
Места находок P. parva в водоемах и водотоках Дагестана: 1 – р. Манасозень (N 42º 42' 56" – 42º 43' 28",
E 47º 40' 48" – 47º 42' 35") – 9 экз.; 2 – р. Гамриозень (N 42º 22' 14" – 42º 22' 39", E 47º 54' 15" – 47º 55' 30") – 10 экз.;
3 – р. Уллучай (N 42º 11' 27" – 42º 12' 40", E 48º 00' 45" – 48º 01' 28") – 6 экз.; 4 – р. Рубас (N 42º 52' 35" – 41º 53' 18",
E 48º 19' 25" – 48º 19' 53") – 6 экз.; 5 – оз. Мочох (N 42º 37' 36" – 42º 37' 54", E 46º 37' 11" – 46º 37' 19") – 8 экз.;
6 – водохранилище Гоцатлинской ГЭС (N 42º 31' 20" – 42º 32' 07", E 46º 54' 34" – 46º 55' 25") – 6 экз.
Places of finds of P. parva in reservoirs and watercourses of Dagestan: 1 – R. Manasozen (N 42º 42' 56" - 42º 43' 28",
E 47º 40' 48" - 47º 42' 35") - 9 copies; 2 - R. Gamriozen (N 42º 22' 14" - 42º 22' 39", E 47º 54' 15" - 47º 55' 30") - 10 copies;
3 - the Ullechai River (N 42º 11' 27" - 42º 12' 40", E 48º 00' 45" - 48º 01' 28") - 6 copies; 4 - R. Rubas (N 42º 52' 35" - 41º 53' 18", E 48º 19' 25" - 48º 19' 53") - 6 copies; 5 - oz. Mochokh (N 42º 37' 36" - 42º 37' 54", E 46º 37' 11" - 46º 37' 19") - 8 copies; 6 - the reservoir of the Gotsatlinskaya hydroelectric power station (N 42º 31' 20" - 42º 32' 07", E 46º 54' 34" - 46º 55' 25") - 6 copies
Таблица 1
Table 1
Качественный и количественный состав уловов в районе исследований
Qualitative and quantitative composition of catches in the study area
|
Вид рыб |
Водный объект |
|||||
|
р. Манасозень |
р. Гамриозень |
р. Уллучай |
р. Рубас |
оз. Мочох |
вдхр. Гоцатлинской ГЭС |
|
|
n, экз. |
||||||
|
Сем. Cyprinidae Bonaparte, 1832 |
||||||
|
Амурский чебачок Pseudorasbora parva (Temminck et Schlegel, 1846) |
9 |
10 |
6 |
6 |
8 |
6 |
|
Терский усач Barbus ciscaucasicus (Kessler, 1877) |
13 |
16 |
11 |
5 |
– |
5 |
|
Усач булат-маи Luciobarbus capito (Güldenstädt, 1773) |
2 |
3 |
2 |
– |
– |
– |
|
Восточная быстрянка Alburnoides eichwaldii (De Filippi, 1863) |
11 |
19 |
17 |
15 |
– |
– |
|
Терский подуст Chondrostoma oxyrhynchum (Kessler, 1877) |
6 |
5 |
2 |
9 |
– |
– |
|
Голавль Squalius cephalus (Linnaeus, 1758) |
9 |
8 |
6 |
8 |
– |
– |
Окончание табл. 1
Ending of the table 1
|
Вид рыб |
Водный объект |
|||||
|
р. Манасозень |
р. Гамриозень |
р. Уллучай |
р. Рубас |
оз. Мочох |
вдхр. Гоцатлинской ГЭС |
|
|
n, экз. |
||||||
|
Сем. Cyprinidae Bonaparte, 1832 |
||||||
|
Терский пескарь Gobio holurus (Fowler, 1976) |
7 |
6 |
8 |
8 |
9 |
6 |
|
Кавказская уклейка Alburnus hohenackeri (Kessler, 1877) |
6 |
6 |
4 |
7 |
8 |
– |
|
Шемая каспийская Alburnus chalcoides (Güldenstädt, 1772) |
– |
– |
– |
3 |
– |
– |
|
Рыбец каспийский Vimba persa (Pallas, 1814) |
– |
– |
2 |
2 |
– |
– |
|
Серебряный карась Carassius gibelio (Bloch, 1782) |
10 |
– |
– |
5 |
– |
– |
|
Пестрый толстолобик Aristichthys nobilis (Richardson, 1845) |
– |
– |
– |
– |
4 |
– |
|
Белый толстолобик Hypophthalmichthys molitrix (Valenciennes, 1844) |
– |
– |
– |
– |
1 |
– |
|
Белый амур Ctenopharyngodon idella (Valenciennes, 1844) |
– |
– |
– |
– |
6 |
5 |
|
Карп Cyprinus carpio (Linnaeus, 1758) |
– |
– |
– |
– |
6 |
6 |
|
Корейская востробрюшка Hemiculter leucisculus (Basilewsky, 1855) |
– |
– |
– |
– |
– |
2 |
|
Сем. Salmonidae Rafinesque, 1815 |
||||||
|
Радужная форель Oncorhynchus mykiss (Walbaum, 1792) |
– |
– |
– |
– |
6 |
4 |
|
Сем. Cobitidae, Swainson, 1839 |
||||||
|
Предкавказская щиповка Sabanejewia caucasica (Berg, 1906) |
2 |
3 |
– |
4 |
– |
– |
|
Сем. Balitoridae Swainson, 1839 |
||||||
|
Голец Крыницкого Oxynoemacheilus merga (Krynicki, 1840) |
7 |
8 |
9 |
2 |
– |
– |
|
Усатый голец Barbatula barbatula (Linnaeus, 1758) |
3 |
2 |
2 |
1 |
– |
– |
|
Сем. Percidae Cuvier, 1816 |
||||||
|
Речной окунь Perca fluviatilis (Linnaeus, 1758) |
2 |
– |
– |
– |
1 |
– |
|
Итого |
87 |
86 |
69 |
75 |
49 |
33 |
Важно также отметить, что в 2022 г. амурский чебачок в количестве 3 экз. был обнаружен нами и в Республике Ингушетия в небольшом озере-пруду на р. Асса (по дороге на Ассинское ущелье – N 42º 53' 44" – 42º 53' 46", E 44º 56' 44" – 44º 56' 46"). В последние годы на Северном Кавказе данный вид был отмечен также и в водных объектах Кабардино-Балкарской республики [20].
Для сравнения популяции амурского чебачка в рассматриваемых водоемах и водотоках Дагестана нами проводился анализ изменчивости морфологических признаков по сокращенной методике [21], включающей 5 меристических признаков – число лучей в спинном (D) и анальном плавниках (A); число чешуй в боковой линии (l. l.), над боковой линией (SD), под боковой линией (SA); 15 пластических признаков – длина тела до конца чешуйного покрова (l, мм), длина головы (c), диаметр глаза (do), длина рыла (ao), заглазничное расстояние (po), ширина головы (wc), антедорсальное расстояние (aD), постдорсальное расстояние (pD), длина основания анального плавника (lAb), длина основания спинного плавника (lDb), длина брюшного плавника (lV), длина грудного плавника (lP), наибольшая высота тела (H), наименьшая высота тела (h), пектровентральное расстояние (PV). Пластические признаки тела рыб рассчитывали в процентах от длины тела (l), а признаки головы в процентах от длины головы (c). Рассматриваемые морфологические признаки P. parva приведены в табл. 2.
Таблица 2
Table 2
Морфологические признаки P. parva из водных объектов Дагестана и нативного ареала
Morphological features of P. parva from water bodies of Dagestan and native range
|
Признак |
Водный объект |
||||||||
|
р. Манасозень |
р. Гамриозень |
р. Уллучай |
р. Рубас |
оз. Мочох |
вдхр. Гоцатлинской ГЭС |
Бассейн р. Амур* |
Бассейн р. Раздольная, Приморский край** |
||
|
n = 9 |
n = 10 |
n = 6 |
n = 6 |
n = 8 |
n = 6 |
n = 220 |
n = 32 |
||
|
Пластические признаки |
|||||||||
|
l, мм |
51,80 |
51,20 |
51,50 |
54,50 |
50,50 |
50,00 |
57,50 |
55,30 |
|
|
c / l, % |
24,78 |
24,56 |
24,77 |
24,34 |
24,54 |
24,80 |
23,95 |
25,47 |
|
|
do / c, % |
25,98 |
26,03 |
25,93 |
26,80 |
25,80 |
25,65 |
25,26 |
26,04 |
|
|
ao / c, % |
34,05 |
34,12 |
33,19 |
33,20 |
33,10 |
32,96 |
32,15 |
32,13 |
|
|
po / c, % |
44,70 |
44,51 |
44,28 |
44,60 |
44,81 |
44,81 |
43,63 |
42,47 |
|
|
wc / c, % |
44,12 |
43,12 |
43,31 |
42,95 |
43,21 |
41,32 |
40,72 |
– |
|
|
aD / l, % |
50,70 |
51,00 |
51,90 |
52,11 |
52,42 |
51,25 |
48,35 |
50,06 |
|
|
pD / l, % |
36,19 |
36,09 |
36,00 |
36,01 |
36,05 |
36,00 |
– |
36,45 |
|
|
lAb / l, % |
9,78 |
9,38 |
9,56 |
9,22 |
9,34 |
9,28 |
8,00 |
8,59 |
|
|
lDb / l, % |
13,00 |
13,09 |
13,29 |
13,11 |
13,22 |
13,12 |
12,55 |
12,74 |
|
|
lV / l, % |
18,11 |
18,00 |
17,92 |
18,00 |
18,00 |
17,55 |
17,50 |
17,65 |
|
|
lP / l, % |
16,97 |
16,77 |
16,65 |
16,50 |
16,32 |
16,81 |
16,65 |
16,22 |
|
|
H / l, % |
24,12 |
25,00 |
25,60 |
24,30 |
25,50 |
24,60 |
22,25 |
25,04 |
|
|
h / l, % |
11,89 |
11,40 |
11,70 |
11,61 |
12,00 |
11,52 |
10,65 |
11,22 |
|
|
PV / l, % |
24,38 |
24,10 |
24,05 |
24,40 |
24,00 |
23,30 |
23,60 |
– |
|
|
Меристические признаки |
|||||||||
|
D |
III 7 |
||||||||
|
A |
III 6 |
||||||||
|
l. l. |
36,00 |
36,34 |
36,00 |
36,00 |
36,12 |
36,00 |
36,50 |
37,04 |
|
|
SD |
5 |
– |
5–6 |
||||||
|
SA |
4 |
||||||||
* Согласно [9]; ** согласно [22].
Результаты и обсуждение
Река Манасозень впадает в Каспийское море, образуяcь от слияния рек Параул-озень (длина 44 км) и Губденозень (длина 28 км). Длина р. Манасозень от места слияния составляет 17 км. Сбор ихтиологического материала проводили в сентябре 2021 г. возле с. Манас (см. рис.). В контрольных уловах на рассматриваемом участке р. Манасозень встречались
13 видов рыб, включая и изучаемый нами вид – амурский чебачок, который был пойман в количестве 9 экз. (см. табл. 1). Длина тела (l) амурского чебачка колебалась от 48 до 62 мм, в среднем составила 51,8 мм. Значения изменчивости морфологических признаков P. parva р. Манасозень приведены в табл. 2.
Река Гамриозень берет начало из родников и ручьев в Северной части хребта Лес, со склонов горы Мигбалю. Бассейн реки расположен в центральной и предгорной части внешнегорного Дагестана. Ниже с. Кичи-Гамри р. Гамриозень притоков не имеет и на всем протяжении до с. Каякент разбирается на орошение прилегающих территорий, устье реки заилено и до моря практически не доходит. Сбор ихтиологического материала проводили в сентябре 2021 г. возле с. Каякент. В р. Гамриозень встречались те же самые виды рыб, что и в р. Манасозень (за исключением серебряного карася Carassius gibelio (Bloch, 1782) и речного окуня Perca fluviatilis (Linnaeus, 1758)), в том числе обнаруженный вселенец – амурский чебачок (см. табл. 1). Материал по P. parva собран в количестве 10 экз., длина тела (l) особей варьировала от 45 до 55 мм, в среднем составила 51,2 мм. Сводные данные об изменчивости морфологических признаков амурского чебачка р. Гамриозень представлены в табл. 2.
Река Уллучай берет начало в северо-западной части хребта Кокма и впадает в Каспийское море.
В пределах горной зоны находится 85 % площади ее бассейна. Вода из реки часто используется для орошения сельскохозяйственных угодий. Сбор ихтиологического материала проводили в сентябре 2021 г. возле с. Татляр. В экспериментальных уловах рассматриваемого участка реки встречались 11 видов рыб (см. табл. 1). В отличие от р. Гамриозень в контрольных уловах р. Уллучай отсутствовала предкавказская щиповка, но присутствовал рыбец.
В уловах встречался и амурский чебачок, длина тела (l) которого колебалась от 45 до 60 мм и в среднем составила 51,5 мм. Морфологические признаки P. parva р. Уллучай приведены в табл. 2.
Река Рубас впадает в Каспийское море, начинается из родников на северо-восточном склоне одного из хребтов внутреннего Дагестана в 3,4 км юго-восточнее горы Джуфу-даг. Воды реки используются в основном для орошения сельскохозяйственных угодий. Ихтиологический материал собирали в одноименном населенном пункте Рубас. В рассматриваемом районе в уловах отмечено 13 видов рыб (см. табл. 1), в основном из семейства Cyprinidae, в том числе и амурский чебачок, материал по которому собран в количестве 6 экз. Длина тела (l) пойманных особей колебалась от 50 до 60 мм, в среднем – 54,5 мм. Сводные данные об изменчивости морфологических признаков амурского чебачка р. Рубас представлены в табл. 2.
Озеро Мочох – озеро обвально-запрудного типа на р. Моджох (приток р. Рухутляра) в бассейне Андийского Койсу. Озеро образовалось в 1962–1963 гг. в межгорной впадине в результате схода оползня с хребта Танусдирил. В том же году из оз. Казеной-Ам были перевезены и выпущены 600 особей эндемичного подвида кумжи (эйзенамская форель) Salmo trutta ezenami Berg, 1948, которая довольно быстро приспособилась к местным условиям [23]. Однако в начале 2000-х гг. форель исчезла в озере в связи с ухудшением химического состава воды в результате поступления в озеро весной 1999 г. раствора креолина, использовавшегося для обработки сельскохозяйственных животных (в частности, для борьбы с псороптозом овец) из близлежащих проплывных ванн. После глубоких гидробиологических и экологических изменений в режиме озера местные жители начали вводить чужеродные виды дальневосточных растительноядных рыб, а также карпа Cyprinus carpio (Linnaeus, 1758) и речного окуня, что привело к смене видового состава ихтиофауны. По-видимому, в результате вселения этих видов в оз. Мочох случайно попал и амурский чебачок. В настоящее время в озере указанные виды успешно натурализовались, особенно P. parva, который нашел благоприятные экологические условия, соответствующие потребностям данного вида. В будущем численность амурского чебачка здесь, возможно, увеличится, и он станет доминирующим видом озера, т. к. у P. parva наблюдается проявление хищнических реакций к соразмерной молоди других видов рыб. Длина тела (l) амурского чебачка, пойманного в мае 2022 г. в оз. Мочох, колебалась от 42 до 56 мм, в среднем 50,5 мм. Морфологические признаки
P. parva оз. Мочох приведены в табл. 2.
Гоцатлинская гидроэлектростанция (ГЭС) находится на р. Аварское Койсу (бассейн р. Сулак), возле с. Чалда и вместе с Ирганайской ГЭС входит в состав каскада ГЭС на р. Аварское Койсу, являясь его верхней ступенью. В 2006–2015 гг. Дагестанский филиал ПАО «РусГидро» провел масштабное зарыбление в водохранилищах своих ГЭС – Гергебильской, Гунибской, Чириюртовской, Чиркейской, Ирганайской и Миатлинской. В эти водоемы было выпущено около 1,8 млн экз. молоди карпа, белого амура, радужной форели Oncorhynchus mykiss (Walbaum, 1792) и кормовых беспозвоночных (Gammaridae и Mysidae). В конце мая 2022 г. в ходе проведения мониторинговых исследований в водохранилищах, в частности на водохранилище Гоцатлинской ГЭС, нами был обнаружен вселенец P. parva в количестве 6 экз. А в водохранилищах Ирганайской и Миатлинской ГЭС амурский чебачок
не отмечен, но был обнаружен уже другой вселенец – корейская востробрюшка Hemiculter leucisculus (Basilewsky, 1855). В водохранилищах Чириюртовской и Чиркейской ГЭС инвазионные виды рыб нами не выявлены.
В контрольных уловах водохранилища Гоцатлинской ГЭС встречались как неполовозрелые, так и половозрелые особи P. parva с длиной тела (l) 38–55 мм. Основные сводные морфологические признаки амурского чебачка представлены в табл. 2. Обнаруженные молодь и половозрелые рыбы с развитыми гонадами могут свидетельствовать об ус-
пешном естественном воспроизводстве его в водохранилище. В водохранилища ГЭС бассейна р. Сулак амурский чебачок, как и корейская востробрюшка, могли быть случайно вселены в результате проводимых мероприятий по интродукции карпа и белого амура.
Как видно из данных, представленных в табл. 2, основные морфометрические показатели амурского чебачка из водоемов и водотоков Дагестана вполне соответствуют морфологическим характеристикам вида P. parva. По изученным признакам все образцы очень похожи друг на друга, а различия в некоторых пластических признаках могут быть обусловлены отличающимися условиями обитания рыб в данном регионе.
Натурализация и дальнейшее увеличение численности амурского чебачка может нанести значительный ущерб прудовым хозяйствам, сократив долю ценных аборигенных видов в рыбных сообществах водоемов Дагестана. По литературным данным, в водоемах Средней Азии амурский чебачок, случайно интродуцированый в 1970-е гг., стал пищевым конкурентом и потребителем икры и личинок автохтонных рыб [16]. Для амурского чебачка характерны возрастные изменения в питании: молодые особи P. parva являются типичными планктонофагами, а взрослые – бентофагами [1, 16]. Однако исследования, проведенные в прудовых хозяйствах, показали, что при высокой численности амурский чебачок может составить серьезную конкуренцию для молоди карпа и пестрого толстолобика, основных объектов товарного выращивания, из-за сходства спектров их питания [9, 24]. Также наблюдалось, что в нагульных прудах P. parva способен конкурировать с более крупными особями, употребляя в пищу комбикорм, и даже нападать на рыб значительно крупнее их по размерам и массе [24], а в мальковых прудах охотиться на личинок карпа, когда пищи мало или она отсутствует [9]. Факультативный паразитизм P. parva обусловлен строением его ротового аппарата, характеризующегося относительно большой высотой рта и почти полным окостенением челюстей [2, 9, 18]. В аквариальных условиях было также показано, что при длительном голодании и постепенном повышении температуры воды P. parva проявляет хищническую реакцию по отношению к соразмерной молоди промыслово-ценных видов карповых рыб [2].
Также необходимо отметить, что хотя сам P. parva устойчив ко многим паразитам и болезням рыб, при увеличении численности в водоеме он является потенциально опасным для высших позвоночных животных, т. к. может быть промежуточным хозяином некоторых паразитов [25].
Амурский чебачок не играет большой роли в качестве потенциальной цели для хищных видов рыб из-за особенностей своей биологии и выраженного оборонительного поведения. Тем не менее, в некоторых водоемах Европы амурский чебачок может составлять значительную часть рациона речного окуня, щуки Esox lucius (Linnaeus, 1758)
и судака Sander lucioperca (Linnaeus, 1758), поэтому представляется целесообразным использовать указанных аборигенных хищников для контроля популяции этого инвазивного вида.
Заключение
На основании изучения 20 признаков (5 меристических и 15 пластических) морфологическая изменчивость популяции амурского чебачка продемонстрировала незначительную вариабельность морфологических признаков, обусловленную различными условиями среды обитания в регионе. Судя по широкому распространению амурского чебачка по водоемам и водотокам Дагестана и достаточно высокой численности, особенно в реках, вероятно, что данный вид довольно давно проник в водоемы при интродукции других водных биологических ресурсов, в частности дальневосточных растительноядных рыб. Однако пути проникновения этого чужеродного вида, в частности в реки, остается дискуссионным,
и нельзя исключить, что заселение амурского чебачка происходило из разных источников. По последним имеющимся генетическим данным [22], в водоемах Северного Кавказа и прилегающих территорий в настоящее время обнаружен только гаплотип «A» (по гену COI mtDNA), исторически соответствующий российской части бассейна р. Амур и северо-восточного Китая. Альтернативный путь вселения – через водоемы Южной и Центральной Европы – в данном случае менее вероятен, т. к. этот коридор интродукции связан с происхождением материнской популяции из бассейна р. Янцзы и маркируется гаплотипом «B».
Для снижения риска дальнейшего распространения амурского чебачка и появления (проникновения) других инвазивных видов рыб в регионе необходимо просвещение населения о недопустимости выпуска чужеродных рыб и их молоди в водоемы, а также введение строгого контроля за разведением объектов аквакультуры.
1. Мухачева В. А. К биологии амурского чебачка (Pseudorasbora parva Schlegel) // Тр. Амур. ихтиолог. экспедиции 1945-1949 гг. М.: Изд-во МОИП, 1950. Т. 1. С. 365-374.
2. Абраменко М. И. Особенности пищевого поведения амурского чебачка Pseudorasbora parva (Temminck et Schlegel, 1846) (Ciprinidae: Gobioninae) в новых условиях обитания // Вестн. Юж. науч. центра РАН. 2012. Т. 8, № 4. С. 81-87.
3. Konishi M., Hosoya K., Takata K. Natural hybridization between endangered and introduced species of Pseudorasbora, with their genetic relationships and characteristics inferred from allozyme analyses // Journal of Fish Biology. 2003. V. 63. P. 213-231.
4. Britton J. R. Contemporary perspectives on the ecological impacts of invasive freshwater fishes // Journal of Fish Biology. 2022. V. 101. P. 15240.
5. Пашков А. Н., Плотников Г. К., Шутов И. В. Новые данные о составе и распространении видов-акклиматизантов в ихтиоценозах континентальных водоемов Северо-Западного Кавказа // Изв. вузов. Северо-Кавказский регион. 2004. № S1 (приложение). С. 46-52.
6. Карабанов Д. П., Кодухова Ю. В., Мустафаев Н. Дж. Амурский чебачок Pseudorasbora parva (Cyprinidae) - новый вид в ихтиофауне Азербайджана // Рос. журн. биолог. инвазий. 2013. № 1. С. 41-50.
7. Богуцкая Н. Г., Кудерский Л. А., Насека А. М., Сподарёва В. В. Пресноводные рыбы России за пределами исторических ареалов: обзор типов интродукций и инвазий // Биологические инвазии в водных и наземных экосистемах. М.: Т-во науч. изд. КМК, 2004. С. 155-171.
8. Алиев Д. С., Веригина И. А., Световидова А. А. Видовой состав рыб, завозимых вместе с белым амуром и толстолобиком из Китая // Проблемы рыбохозяйственного использования растительноядных рыб в водоемах СССР. Ашхабад: Изд-во АН ТуркменССР, 1963. С. 178-180.
9. Батраева М. Н. К биологии амурского чебачка // Биология водоемов Казахстана. Алма-Ата, 1970. С. 18-20.
10. Шония Л., Джапошвили Б., Кокосадзе Т. Инвазийный вид Pseudorasbora parva (Teleostei, Cyprinidae) в экосистеме озера Базалети // Зоолог. жур. 2011. Т. 90, № 10. С. 1277-1280.
11. Пипоян С. Х., Аракелян А. С. О распространении амурского чебачка Pseudorasbora parva (Temminck et Schlegel, 1846) (Actinopterygii: Cyprinidae) по водоемам Армении // Рос. журн. биолог. инвазий. 2015. № 2. С. 67-74.
12. Roudbar A. J., Vatandoust S., Eagderi S., Jafari S., Mousavi-Sabet H. Freshwater fishes of Iran; an updated checklist // AACL Bioflux. 2015. V. 8. N. 6. P. 855-909.
13. Bianco P. G. Occurrence of the Asiatic gobionid Pseudorasbora parva (Temminck and Schlegel) in south eastern Europe // Journal of Fish Biology. 1988. V. 32. P. 973-974.
14. Gozlan R. E., Pinder A. S., Shelley J. Occurrence of the Asian cyprinid Pseudorasbora parva in England // Journal of Fish Biology. 2002. V. 61. P. 298-300.
15. Britton J. R., Davies G. D., Brazier M. Towards the successful control of the invasive Pseudorasbora parva in the UK // Biological Invasions. 2010. V. 12. P. 125-131.
16. Макеева А. П., Заки Мохамед М. И. Размножение и развитие псевдорасборы Pseudorasbora parva (Schlegel) в водоемах Средней Азии // Вопр. ихтиологии. 1982. Т. 22, № 1. С. 80-92.
17. Поздняк В. Г. Амурский чебачок в бассейне реки Кумы // Животный мир Предкавказья и сопредельных территорий: межвуз. сб. науч. тр. Ставрополь: Изд-во СПГИ, 1988. С. 64-65.
18. Подушка С. Б. Проникновение амурского чебачка Pseudorasbora parva в Азовское море // Науч.-техн. бюл. лаб. ихтиологии ИНЭНКО. Вып. 1. СПб.: Тема, 1999. С. 36-37.
19. Карабанов Д. П., Кодухова Ю. В., Слынько Ю. В. Новые находки Амурского чебачка Pseudorasbora parva (Temm. et Schl., 1846) в Европейской части России // Рос. журн. биолог. инвазий. 2009. № 1. С. 11-13.
20. Бербекова И. А., Якимов А. В., Шахмурзов М. М., Львов В. Д. Состав и структура уловов рыбаков из естественных водоемов Кабардино-Балкарии // Austrian Journal of Technical and Natural Sciences. 2014. N. 11-12. P. 5-9.
21. Правдин И. Ф. Руководство по изучению рыб (преимущественно пресноводных). М.: Пищ. пром-сть, 1966. 376 с.
22. Karabanov D. P., Kodukhova Y. V., Pashkov A. N., Reshetnikov A. N., Makhrov A. A. “Journey to the West”: Three phylogenetic lineages contributed to the invasion of Stone moroko, Pseudorasbora parva (Actinopterygii: Cyprinidae) // Russian Journal of Biological Invasions. 2021. V. 12, no. 1. P. 67-78.
23. Barkhalov R. M., Rabazanov N. I., Orlov A. M., Orlova S. Yu. The Endangered Kezenoi-Am Trout, Salmo ezenami // Imperiled: The Encyclopedia of Conservation. Amsterdam: Elsevier, 2022. P. 427-435.
24. Тромбицкий И. Д., Каховский А. Е. О факультативном паразитизме псевдорасборы Pseudorasbora parva (Schlegel) в рыбоводных прудах // Вопр. ихтиологии. 1987. Т. 27, № 1. С. 166-167.
25. Fan P. C. Viability of metacercariae of Clonorchis sinensis in frozen or salted freshwater fish // International Journal for Parasitology. 1998. V. 28. P. 603-605.
















