Россия
Россия
Представлены материалы о современном состоянии аквакультуры в России и в мире, в частности о биотехнике разведения и выращивания судака в установках замкнутого цикла. Обыкновенный судак (Sander lucioperca Linnaeus, 1758) пользуется повышенным спросом среди населения. Приведены результаты работ по искусственному получению потомства судака в экспериментальной нерестовой установке, позволяющей создать условия для нереста, максимально сходные с условиями открытых водоемов. Работа состояла из 3 этапов: выдерживание производителей судака и подготовка их к нересту; нерест; инкубация икры и вылупление предличинок. Описаны способы стимулирования и нереста производителей судака, метод инкубации икры в индустриальных условиях. Показано, что все самцы созрели через 24 ч, самки – через 28 ч после инъецирования. Инкубация оплодотворенной икры судака осуществлялась на гнездах устройства для нереста. Оплодотворяемость икры на этапе гаструляции составила 70 %. В результате исследовательских работ подобраны оптимальные гидрохимические показатели и рыбоводно-биологические характеристики содержания производителей судака, инкубации икры интенсивным методом в управляемых условиях установки для нереста. Кроме того, зарегистрированы инфекционные, инвазионные и алиментарные заболевания, представлены варианты лечения и профилактических обработок. Результаты проведенных исследований по получению потомства судака в условиях экспериментальной установки для нереста свидетельствуют о возможности ее использования в промышленных масштабах. Разработка метода воспроизводства судака в индустриальных условиях с использованием специального устройства для нереста позволит получить жизнестойкое потомство в контролируемых условиях среды.
аквакультура, экспериментальная нерестовая установка, судак, биотехнология, нерест, инкубация, температура воды
Введение
Многие виды гидробионтов во всем мире уже исчезли или находятся на грани исчезновения, но спрос на продукцию рыболовства продолжает увеличиваться вследствие роста населения Земли.
В результате влияния всех этих факторов аквакультура становится самым быстрорастущим сегментом сельского хозяйства.
По данным Продовольственной и сельскохозяйственной организации ООН [1], около 50 % потребляемой рыбной продукции в мире производится предприятиями аквакультуры, в то время как в 1970-е гг. доля аквакультуры составляла всего 3–6 % мировой поставки рыбы [2]. За последнее десятилетие мировая аквакультура стала производить вдвое больше продукции и по своим объемам догнала традиционное рыболовство. Но в отличие от последнего, чьи объемы не растут последние 20 лет, при этом рост не прогнозируется из-за снижения биопродуктивности Мирового океана, аквакультура обладает большим потенциалом. Стимулом для быстрого развития аквакультуры является еще и тот факт, что к 2050 г., согласно [3], население планеты составит 9–11 млрд чел., т. е. чтобы обеспечить всех продовольствием в необходимом количестве, необходимо будет производить на 60 % больше пищи [4].
Доля России в мировой продукции аквакультуры составляет в настоящее время только 0,2 %. Эта ситуация обусловлена тем, что и в России, и в Советском Союзе основные силы рыбного хозяйства были направлены на развитие и наращивание объемов вылова рыбы. Главным лимитирующим фактором развития аквакультуры в России и в мире является нехватка недорогих эффективных биотехнологий, новых объектов аквакультуры, технических средств и экологичных кормов.
При неблагоприятных условиях естественного размножения проходных и полупроходных рыб возможно восстановить их запасы в морях России за счет заводского воспроизводства [5], но наиболее эффективным способом увеличения товарной рыбной продукции для нужд населения считается аквакультура.
Для успешного развития аквакультуры в условиях рыночной экономики необходимо пересмотреть технологические методы выращивания ценных объектов аквакультуры с целью обеспечения их рентабельности. Разработки промышленного рыбоводства значительно снизят рыболовную нагрузку на естественные водоемы [6].
Исследования, проведенные в Европе, свидетельствуют о растущем внимании к судаку как к коммерчески ценному объекту аквакультуры [7, 8]. Еще несколько десятилетий назад судак был описан как один из видов, представляющих большой интерес
с точки зрения его разведения в системах с полным контролем над репродуктивным циклом. В настоящее время разведение судака переходит от исследовательских и экспериментальных работ к реальному промышленному внедрению [9, 10].
Судак (Sander lucioperca, Linnaeus, 1758) считается нетрадиционным видом выращивания для юга нашей страны. Судак – вид, имеющий большое значение для дальнейшего развития интенсивной аквакультуры, поэтому полный контроль над репродуктивным циклом данного вида является высокоприоритетной задачей [11]. Разработка биотехнологий выращивания этого объекта позволит ввести в аквакультуру юга России рентабельные и высокоэффективные технологические решения.
Вследствие высокой пластичности к параметрам водной среды судак может быть использован для индустриального культивирования в системах с регулируемыми параметрами водной среды. Контролируемый нерест позволяет организовать работу предприятия на круглогодичной основе с расчетом выходов посадочного материала вплоть до каждой недели, а также способствует контролируемому зарыблению водоемов в любой период года.
В настоящее время в мировой практике с использованием полностью регулируемых гидролого-гидрохимических параметров среды и с полноценным кормлением рыб выращивают как молодь судака, так и рыб для формирования ремонтно-маточных стад и реализации в торговой сети. Однако, несмотря на накопленные знания и опыт, имеющиеся у российских и иностранных исследователей и сотрудников рыбхозов, биотехника разведения и выращивания судака в установках замкнутого водообеспечения (УЗВ) не считается до конца разработанной [12].
Разработка метода воспроизводства судака в индустриальных условиях с использованием специального устройства для нереста позволит получить жизнестойкое потомство в контролируемых условиях среды.
Целью данных исследований явилось проведение экспериментальных работ по получению и инкубации икры судака (Sander lucioperca Linnaeus, 1758) в УЗВ с использованием на этапе преднерестового содержания и нереста производителей экспериментальной нерестовой установки.
В задачи исследований входило:
– разработка методов адаптации производителей судака к искусственным условиям среды;
– разработка метода получения и инкубации икры судака в экспериментальной нерестовой установке.
Материал и методы
Исследования по подготовке производителей судака (Sander lucioperca Linnaeus, 1758) к нересту, а также получению от них потомства в условиях установки для нереста, имеющей замкнутый цикл водообеспечения, проводились в аквакомплексе Береговой научно- экспедиционной базы «Кагальник» Южного научного центра Российской академии наук (Ростовская область, п. Кагальник). Кормление производителей судака осуществляли в соответствии с разработанными нормативами.
Работа состояла из 3 этапов:
– выдерживание производителей и подготовка
к нересту;
– нерест;
– инкубация икры, вылупление.
Содержание производителей перед нерестом включало 2 этапа:
– содержание производителей в садках в условиях естественных температур;
– содержание производителей в установке для нереста.
Для осуществления исследовательских работ производители судака завозились из ЗАО «Миусский лиман». Отбирались особи с нормальным экстерьером, без уродств, покраснений, язв и травм, при соотношении самок и самцов 1 : 1. Средняя масса производителей составила 1,77 кг.
Транспортировку самок и самцов проводили
в полиэтиленовых емкостях «еврокуб». Данная емкость должна быть заполнена речной водой на ¾ объема. Для наполнения водой имеется заливное отверстие диаметром 120 мм. Температура воды в емкостях в среднем составляла 1,5 °С, плотность посадки – 40,2 кг/м3. После транспортировки рыба была обработана в 5 %-м солевом растворе (3 мин) и помещена в садки с речной водой, температура которой составила 2,7 °С.
Новое техническое средство «Нерестовое устройство для судака» включает все необходимые комплектующие и технические разработки (в частности, систему регулирования термического режима), позволяющие создать условия для нереста судака, максимально сходные с таковыми в естественных открытых водоемах.
Опытный образец установки для преднерестового содержания производителей и осуществления нереста судака представляет собой полноценную замкнутую систему. Главная составляющая – специально разработанный двухсекционный лоток, оснащенный независимой подачей свежей и сливом отработанной воды. Основные гидрохимические показатели водной среды контролируются соответствующими датчиками. Также в состав комплекса входят биомеханический фильтр, циркуляционный насос, система освещения. Система аэрации поддерживает оптимальный уровень кислорода в воде (рис. 1).

Рис. 1. Внешний вид установки для нереста
Fig. 1. Appearance of the spawning unit
Лоток сконструирован таким образом, что есть возможность раздельного и совместного содержания разнополых рыб, создания кругового тока воды и кругового движения рыбы. Внутри лотка установлены 4 съемных гнезда для инкубации икры судака. В лотке предусмотрены 2 шандоры, которые совместно с режимом тока воды по трубам позволяют регулировать движение воды в лотке. Для удобства работы лоток имеет 2 секции (отделения), которые позволяют содержать 2 группы рыб с разным сроком получения половых продуктов.
Перед посадкой производителей в экспериментальную установку в течение двух недель они находились в прибрежном садковом комплексе. При этом самки и самцы содержались в разных отсеках.
В период пересадки рыб из садкового комплекса в установку для нереста температура в исходном водоеме (протока Свиное гирло) и установке составляла 5,1 °С. Известно, что в интервале температур 11,5–15,0 °С количество полученных личинок судака с уродствами минимально, и этот интервал температур является оптимальным для инкубации икры данного вида [13–17]. Поэтому после перевода производителей и адаптации к новым условиям температуру воды в установке постепенно (шаг температуры 1–1,5 °С) повысили до 14–15 °С.
В процессе инкубации и подращивания личинок концентрация растворенного кислорода составляла 8–8,6 мг/л.
Особей, протестированных на степень готовности к нересту, из садкового комплекса для передержки рыб отсаживали в установку для нереста. Соотношение полов определено исходя из литературных данных – 1 : 1 [18]. После пересадки провели антипаразитарную обработку хлоридом натрия (из расчета 2 г соли на 1 л воды).
После установления нерестовой температуры воды в экспериментальной установке проводили подготовку посаженных производителей к нересту с использованием гормональных препаратов – гипофиза сазана из расчета 3 мг/кг для самок и 2,3 мг/кг для самцов. Инъецирование осуществляли дробно через 24 ч: предварительная инъекция для самок составила 1 мг/кг рыбы [19], разрешающая – 2 мг/кг массы рыб, разрешающая для самцов – 2,3 мг/кг. Далее визуально отслеживалось появление на дне лотка первых икринок. Для определения процента оплодотворения из лотка в чашку Петри была отобрана проба икры.
Во время проведения инкубации с целью профилактики икра была обработана раствором фиолетового «К» из расчета 0,01 г/л во избежание вспышки сапролегниоза.
Результаты и их обсуждение
Транспортировка судака в целом прошла удовлетворительно, отхода не было, однако на теле, вероятно, от испуга и метания в еврокубе, появились небольшие травмы в виде потертостей и небольших ссадин. Перепад температур воды в транспортировочной емкости и в реке составил 0,3 °С.
На основании полученных результатов можно говорить о том, что транспортировку производителей судака в еврокубах возможно проводить при низких температурах воды и воздуха. При высоких температурах транспортировка подобным способом сопряжена с высокими рисками ввиду низкой выживаемости судака.
После пересадки производителей судака из садков в емкости установки для нереста наблюдали беспокойство и резкие движения, характерные для рыб в период стресса. Но уже через 2–3 мин состояние рыб приходило в норму. По мере роста температуры воды были заметны активные действия самцов, которые подходили вплотную к хвостовому стеблю самок.
Созревание наступило у самцов через 24 ч, у самок через 28 ч, что определялось по икринкам, выпавшим на дно рыбоводной емкости. Качество репродуктивных клеток самцов было удовлетворительным и соответствовало 3–5 баллам по шкале
Г. М. Персова [20].
Для осеменения 100 г икры судака использовали 2 см3 спермы, согласно рекомендациям [21]. Осеменение осуществляли «сухим» способом: половые продукты смешивали, затем добавляли небольшое количество воды [22]. Оплодотворенную икру помещали на гнезда с искусственным субстратом без предварительного обесклеивания.
Основная часть оплодотворенной икры судака инкубировалась на гнездах устройства для нереста. Некоторое ее количество отмечалось на дне лотка. Оплодотворяемость икры на этапе гаструляции составляла 70 % от общего количества икры. Первые личинки появились через 4 суток.
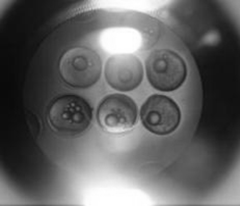
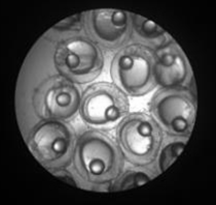
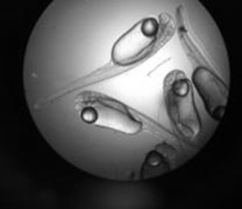
Вылупившуюся личинку судака выловили и рассадили в аквариумы в Центре коллективного пользования ЮНЦ РАН. На рис. 2 представлена икра на разных стадиях развития.
|
а |
б |
в |
|
г |
д |
е |
Рис. 2. Развитие икры судака и внешний вид личинок судака: а – неоплодотворенная икра; б – оплодотворение;
в – через 2 ч 10 мин образование бластодиска; г – через 22 ч 50 мин гаструляция и образование зародышевых пластов; д – через 90 ч отчленение хвостового отдела от желточного мешка; е – через 98 ч массовое вылупление
Fig. 2. Development of pike-perch eggs and appearance of pike-perch larvae: a – unfertilized eggs; б – fertilization;
в – after 2 hours and 10 minutes: formation of a blastodisc; г – after 22 hours and 50 minutes: gastrulation and formation
of germ layers; д – after 90 hours: separation of the caudal segment from the yolk sac; е – after 98 hours: mass hatching
Для успешного выращивания судака необходимо знание требований, предъявляемых этим объектом к окружающей среде на всех этапах развития. Взрослый судак весьма требователен к температуре и в период нереста предпочитает места с температурой воды 14–18 °С и глубиной 0,2–0,4 м [23, 24], поэтому на протяжении всего периода исследования фиксировались гидрохимические показатели среды (табл. 1).
Таблица 1
Table 1
Гидрохимические показатели содержания производителей судака и инкубации икры
в управляемых условиях установки для нереста
Hydrochemical indicators of farming pike-perch spawners and caviar incubation
in the controlled conditions of a spawning unit
|
Показатель |
Значение |
|
Преднерестовое содержание производителей судака на естественном термическом режиме |
|
|
Температура воды, °С |
5–8 |
|
Растворенный кислород, мг/л |
9–12 |
|
pH |
7–8 |
|
Преднерестовое содержание судака в уcтановке для нереста |
|
|
Начальная температура воды, °С |
соответствует температуре воды в открытом водоеме содержания производителей |
|
Нерестовая температура воды, °С |
13–14 |
|
pH |
6,8–7,8 (в пределах 6,5–8,3) |
|
Растворенный кислород, мг/л |
8–9 (не ниже 7,5) |
|
Общий аммонийный азот (NH4+), мг/л |
до 1 |
|
Нитриты (NO2–), мг/л |
до 0,2 |
|
Нитраты (NO3–), мг/л |
12 |
|
БПК5, мгО2/л |
до 10 |
|
Инкубация |
|
|
Температура воды, °С |
14–15 |
|
pH |
6,8–7,8 (в пределах 6,5–8,0) |
|
Растворенный кислород, мг/л |
8–9 (не ниже 7,5) |
|
Общий аммонийный азот (NH4+), мг/л |
до 1 |
|
Нитриты (NO2–), мг/л |
0,015 |
|
Нитраты (NO3–), мг/л |
до 3 |
|
БПК5, мгО2/л |
до 9 |
Рыбоводно-биологические показатели содержания производителей судака и инкубации икры представлены в табл. 2.
Таблица 2
Table 2
Рыбоводно-биологические показатели содержания производителей судака и инкубации икры
в управляемых условиях установки для нереста
Fish breeding and biological indicators of farming pike-perch spawners and caviar incubation
in controlled conditions of a spawning unit
|
Показатель |
Значение |
|
Обработка производителей от одноклеточных эктопаразитов |
|
|
Хлорид натрия, г/л воды |
2 |
|
Преднерестовое содержание судака в установке для нереста |
|
|
Растворенный кислород, мг/л |
8–9 (не ниже 7,5) |
|
Шаг увеличения температуры воды до температуры нереста, °С |
1–1,2 |
|
Выдерживание рыбы на нерестовой температуре, сут |
12–14 |
|
Количество гипофиза для инъекции, мг/кг массы тела |
3 – самкам 3 – самцам |
|
Количество инъекций гипофизом, шт. |
2 (предварительная – 30 % и разрешающая – 70 %) |
|
Расход воды в установке, л/мин/м3 |
4–6 (регулируемый) |
|
Уровень воды в установке, м |
0,3–0,45 |
|
Плодовитость самок, тыс. шт./кг массы тела |
160–200 |
|
Инкубация |
|
|
Растворенный кислород, мг/л |
8–9 (не ниже 7,5) |
|
Количество гнезд в установке, шт. |
6 |
|
Расход воды в установке, л/мин |
3–4 |
|
Количество икры, шт. |
~1,2 млн |
|
Продолжительность инкубации, сут |
5–7 |
При проведении рыбохозяйственных мероприятий происходит неизбежное травмирование рыбы (стрессовые условия, перевозка, сортировка). На поврежденных участках тела возможны появления различных заболеваний.
В условиях УЗВ у судака были зарегистрированы инфекционные (вирусные, бактериальные, грибковые), инвазионные и алиментарные заболевания, лечение которых целесообразно чередовать с профилактическими обработками.
На поврежденных участках тела развивалось протозойное заболевание – ихтиофтириоз.
Ресничная инфузория Ichthyophthirius multifiliis локализуется под эпителием кожи и жабр, нарушая кожное дыхание и газообмен у рыб (рис. 3).
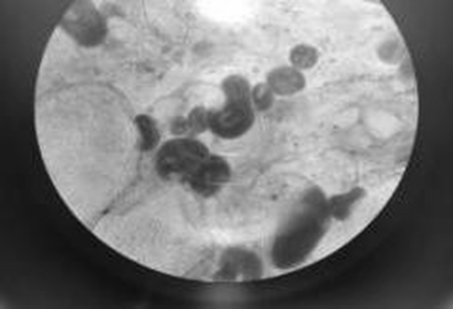
Рис. 3. Ichthyophthirius multifiliis с жабр судака
Fig. 3. Ichthyophthirius multifiliis from pike-perch gills
При сильном заражении крупные паразиты хорошо видны в виде небольших белых бугорков,
с больной рыбы сходит эпителий. При поражении жабр нарушаются процессы дыхания, наступает смерть (рис. 4).

Рис. 4. Гибель судака от вспышки ихтиофтириоза
Fig. 4. Death of pike-perch from an ichthyophthiriasis outbreak
Для борьбы с ихтиофтириозом применяли ванны с солью (3 кг/м3, в течение 8 сут) и с органическими красителями (0,6 г/м3 в течение 5 ч). Это позволило снизить уровень инвазии до безопасного для здоровья рыб уровня.
Вспышки заболеваний отмечаются чаще всего у ослабленных по каким-либо причинам рыб. Распространение инвазии происходит как через воду от зараженных рыб, так и через рыбоводное оборудование, в связи с чем рыбоводное оборудование подвергалось обеззараживанию хлорамином Б.
Заключение
Результаты проведенных исследований по получению потомства судака в условиях экспериментальной установки для нереста свидетельствуют
о возможности ее использования. Высока эффективность подготовки производителей к нересту. При оптимальных гидрохимических условиях все производители созрели, самцы – через 24 ч, самки – через 28 ч после инъецирования. Качество репродуктивных клеток удовлетворительно. Процент оплодотворения икры составил 70 %.
1. FAO. The State of World Fisheries and Aquaculture 2020. Sustainability in action. Rome: Food and Agriculture Organization of the United Nations, 2020. 224 р.
2. Little D. C., Newton R. W., Beveridge M. C. Aquaculture: a rapidly growing and significant source of sustainable food? Status, transitions and potential // Proceedings of the Nutrition Society. 2016. N. 75. P. 274-286.
3. Roos E., Bajzelj B., Smith P., Patel M., Little D., Garnett T. Greedy or needy? Land use and climate impacts of food in 2050 under different livestock futures // Global Environmental Change. 2017. N. 47. P. 1-12.
4. Fróna D., Szenderák J., Harangi-Rákos M. The Challenge of Feeding the World // Sustainability. 2019. N. 11. P. 5816.
5. Ходоревская Р. П., Некрасова С. О. Современное состояние и перспективы воспроизводства водных биологических ресурсов для промышленной аквакультуры в Астраханской области // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2019. № 3. С. 107-116.
6. Ablaisanova G. M., Assylbekova S. Zh., Sambetbaev A. Ab., Gomulka P. J., Isbekov K. B., Badryzlova N. S., Koishybayeva S. K. Prospects for growing juveniles and rearing fingerlings of pikeperch (Sander lucioperca) in cages in the conditions of fish farming of Almaty region // EurAsian Journal of BioSciences. 2020. N. 14. Р. 293-299.
7. Ljubobratovic U., Kucska B., Sandor Z., Peteri A., Ronyai A. Effects of stocking density, feeding technique and vitamin C supplementation on the habituation on dry feed of pikeperch (Sander lucioperca) pond reared juveniles // Iranian Journal of Fisheries Sciences. 2016. N. 15. P. 1337-1347.
8. Policar T., Stejskal V., Kristan J., Podhorec P., Svinger V., Blaha M. The effect of fish size and stocking density on the weaning success of pond-cultured pikeperch Sander lucioperca L. juveniles // Aquaculture International. 2013. N. 21. Р. 869-882.
9. Dalsgaard J., Lund I., Thorarinsdottir R., Drengstig A., Arvonen K., Pedersen P. B. Farming different species in RAS in Nordic countries: current status and future perspectives // Aquacult. Eng. 2013. N. 53. P. 2-13.
10. Steenfeldt S., Fontaine P., Overton J. L., Policar T., Toner D., Falahatkar B., Falahatkar B., Horváth Á., Khemis I. B., Hamza N., Mhetli M. Current status of eura-sian percid fishes aquaculture // Biology and Culture of Percid Fishes. Springer, Netherlands. 2015. P. 817-841.
11. Ljubobratović U., Péter G., Demény F., Kugyela N., Horváth Á., Pataki B., Horváth Z., Sándor Z. J., Rónyai A. Reproductive performance in virgin pikeperch (Sander lucioperca L.) femalesfed different dietary levels of arachidonic acid with respect to the durationof spawning induction // Aquaculture Reports. 2020. N. 18. Р. 100430.
12. Дельмухаметов А. Б., Пьянов Д. С. Рост судака различных поколений в установках замкнутого водоснабжения // Изв. Калинингр. гос. техн. ун-та. 2014. № 32. С. 85-90.
13. Михеев П. В., Мейснер Е. В., Михеев В. П. Садковое рыбоводное хозяйство на водохранилищах. М.: Пищ. пром-сть, 1970. 159 c.
14. Мунтян С. П., Резников П. Н. Зависимость длины тела зародышей судака от температуры инкубации // Эколого-морфологические и эколого-физиологические исследования развития рыб. М.: Наука, 1978. С. 124-136.
15. Брума И. Х. Биотехника искусственного воспроизводства судака в условиях Приднестровья // Совершенствование технологии выращивания рыб при высокой степени интенсификации. Кишинев, 1981. С. 63-74.
16. Королев А. Е., Терешенков И. И. Биотехника инкубации икры судака // Сб. науч. тр. ГосНИИОРХ. 1986. № 221. С. 17-19.
17. Пат. 1700802 Россия, МКИ6 АО1К 61/100. Способ искусственного разведения судака / Жмурова Е. Х., Вдовенко Н. Е., Ермолаева Г. В., Мирошник Г. И. Азов. НИИ рыб. хоз-ва, 1995. № 4785973/13. Заявл. 11.10.1989; опубл. 20.08.1995, Бюл. № 23.
18. Самойлов К. Ю. Структура популяции и генетическое разнообразие судака Sander lucioperca (L.) Волго-Ахтубинской системы нижней Волги: дис. … канд. биол. наук. М., 2017. 110 с.
19. Иванов А. П. Рыбоводство в естественных водоемах. М.: Агропромиздат, 1988. 367 с.
20. Неваленный А. Н., Пономарева Е. Н., Сорокина М. Н. Биологические основы рыбоводства. М.: Моркнига, 2016. 434 с.
21. Zakes Z., Demska-Zakes K. Artificial spawning of pikeperch (Sander lucioperca L.) stimulated with human choriogonic gonadotropin (hCG) and mammalian GnRh analogue with a dopamine inhibitor // Archives of Polish Fisheries. 2005. N. 13. P. 63-75.
22. Bienkiewicz M., Gomulka P., Kestemont P. Artificial reproduction of pikeperch. Olsztyn, 2007. 80 p.
23. Хрусталев Е. И., Курапова Т. М., Жуков В. В. Биотехнический и производственный потенциал пастбищной аквакультуры на трансграничных водоемах России и Литвы. Калининград: Изд-во ИП Мишуткина И. В., 2009. 198 с.
24. Дельмухаметов А. Б. Биотехника формирования и эксплуатации ремонтно-маточного стада судака в установках замкнутого цикла водообеспечения: автореф. … канд. биол. наук. Калининград, 2012. 24 с.