Россия
Россия
Россия
Россия
Представлены санитарно-паразитологические результаты исследований рыб на примере окуня обыкновенного (Perca fluviatilis L.) – одного из самых распространенных представителей хищных рыб в Астраханской области. У всех изученных образцов было обнаружено только два вида гельминтов – род Eustrongylides (личинки нематод) и вид Rossicotrema donicum (метацеркарии трематод). Чаще особи окуня были поражены метацеркариями Rossicotrema donicum. Отмечена взаимосвязь между количественным и качественным составом обнаруженных гельминтов. Количество эустронгилид, извлеченных из окуня, больше в образцах из р. Кигач, в то время как количество метацеркариев при этом наблюдалось минимальное. Наибольшее количество Rossicotrema donicum обнаружено у образцов из р. Волга, при этом эустронгилиды в окунях из отобранной точки отсутствуют. Был проведен анализ гидрохимических показателей выбранных водоемов (Наримановский район Астраханской обл. – р. Волга, Красноярский район – р. Кигач, Приволжский район – р. Кривая Болда), и сопоставление приведенных выше данных привело к обнаружению положительной и обратной корреляционной зависимости между показателями комбинированного индекса загрязненности воды (КИЗВ), удельного КИЗВ (УКИЗВ) и обнаруженными паразитами. Коэффициент корреляции между КИЗВ и количеством Rossicotrema donicum составил 0,97, между УКИЗВ и Rossicotrema donicum 0,97, КИЗВ и количеством эустронгилид – минус 0,98, УКИЗВ и количеством эустронгилид – минус 0,98. Предположено, что количество Rossicotrema donicum растет с ухудшением качества воды, а количество Eustrongylides, напротив, уменьшается. Основываясь на определенной зависимости, можно предположить, что самым чистым водоемом является проток Кигач (обнаружено максимальное количество эустронгилид – 20), а самым грязным – р. Волга (эустронгилиды не обнаружены, количество Rossicotrema donicum – 369).
гельминты, паразитофауна, окунь обыкновенный, загрязнение водоемов, эустронгилиды, метацеркарии, экстенсивность и интенсивность инвазии
Введение
Астраханская область отличается богатыми запасами водных биологических ресурсов. Дельта реки Волги обеспечивает рыбной продукцией не только нашу область, но и другие регионы страны. Согласно докладу Службы природопользования и охраны окружающей среды Астраханской области «Об экологической ситуации в Астраханской области в 2019 г.» в Волго-Каспийском и Северо-Каспийском рыбохозяйственных подрайонах (Астраханская область) вылов полупроходных и речных рыб в 2019 г. составил 42,2 тыс. т (освоение – 78 %). Но несмотря на высокие показатели рыбный промысел приходит в упадок. Известно, что хозяйственная деятельность населения приводит к загрязнению окружающей среды (в том числе и водных объектов, протекающих по урбанизированным территориям) поллютантами. В современном мире в связи с бурным ростом промышленности, объектов сельскохозяйственного производства загрязнение природной среды приобрело глобальные масштабы. Оно обусловлено поступлением во внешнюю среду различных неорганических и органических веществ или видов энергии (тепло, звук, радиоактивное и электромагнитное излучение и пр.). В Астраханской области основными источниками загрязнения поверхностных водоемов являются объекты городского жилищно-комму-
нального хозяйства, на долю которых приходится 82 % всех загрязненных вод региона [1, 2].
Численность биологических водных ресурсов не только подвержена влиянию уровневого режима, качества воды, водообменных процессов, но и обусловлена развитием отношений с другими представителями фауны. Отношения «хищник – жертва», «паразит – хозяин» играют особую роль в формировании численности и видового разнообразия.
Отношения «паразит – хозяин» носят скрытый характер. Проследить степень влияния паразитарных заболеваний на качественный и количественный состав рыбы очень сложно, но важно не только для оценки и проведения мероприятий, направленных на сохранение численности рыб, но и для профилактики распространения болезней среди населения. Основным источником инвазивных болезней при использовании рыбы в пищу являются гельминты, поэтому велика необходимость изучения видового разнообразия и мониторинг численности и ареала распространения гельминтов рыб в регионах с развитым промышленным рыболовством [3].
Результаты гельминтологических и химических исследований и анализ данных о состоянии водоемов позволяют установить причинно-следственную взаимосвязь между разными экологическими факторами и формированием паразитофауны, а также проследить уровень загрязнения токсическими веществами водоема и его обитателей. Это в дальнейшем может способствовать эффективному прогнозированию и управлению эпидемиологической и санитарной обстановкой региона.
Целью данной работы являлась оценка влияния некоторых интегральных показателей качества воды на распространенность гельминтозов окуня обыкновенного (Perca fluviatilis L.).
Для достижения поставленной цели потребовалось решить следующие задачи:
– охарактеризовать эпизоотологическую обстановку изучаемых водоемов;
– изучить состояние окуня из некоторых водоемов дельты р. Волги в отношении гельминтозных инвазий;
– установить степень и вид зависимости между различными экологическими факторами и количеством инвазий, а также распространенностью возбудителями инвазий.
Материал и методы исследования
Объектом исследования являлся обыкновенный окунь (Perca fluviatilis L.) – наиболее распространенный вид окуневых рыб в водоемах Астраханской области. Было исследовано 30 образцов (двухлеток), выловленных из р. Волги (Наримановский район), р. Кигач (Красноярский район), р. Кривая Болда (Приволжский район) – по 10 проб из каждого водоема.
Работа включала анализ литературы о гидрохимических показателях водных объектов (комбинированный индекс загрязненности воды (КИЗВ)
и удельный КИЗВ (УКИЗВ)), из которых были выловлены образцы окуня [4], проведение лабораторных исследований (внешний осмотр и установление некоторых биологических параметров, гельминтологические исследования). Лаборатория мониторинга загрязнения поверхностных вод Астраханского центра по гидрометеорологии и мониторингу окружающей среды выполняла анализы в поверхностных водах по 49 ингредиентам по методикам Гидрохимического института, изложенным в [5]. Паразитологические исследования проводили в соответствии с «Правилами ветеринарно-санитарной экспертизы пресноводной рыбы и раков» [6], МУК13.2.988-00 «Методы санитарно-паразитологической экспертизы рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработки» [7]
и «Методикой паразитологического инспектирования морской рыбы и рыбной продукции (морская рыба-сырец, рыба охлажденная и мороженая)» [8]. Определяли такие показатели, как экстенсивность
и интенсивность инвазии, а также коэффициент «К» (допустимое среднее число паразитов на 1 кг рыбы, находится делением общего числа паразитов в выборке на общую массу (в кг) выборки).
Экстенсивность инвазии, или встречаемость паразитов (в англоязычной литературе – Prevalence), есть процент зараженных хозяев конкретным видом или группой паразитов (число зараженных особей делится на число всех исследованных и умножается на 100 %).
Интенсивность инвазии (Intensity) – среднеарифметический показатель числа паразитов, приходящихся на одну зараженную особь хозяина (число обнаруженных паразитов делится на число зараженных особей) [9].
Результаты исследований
Прежде чем приступить к гельминтологическим и химическим исследованиям, мы установили некоторые биологические характеристики окуня обыкновенного для определения возможной взаимосвязи между ними и уровнем пораженности окуня гельминтами. Так, одним из основных факторов, определяющих качественный и количественный состав паразитофауны, является возраст хозяина [10]. С возрастом наблюдается увеличение не только числа паразитов, но и интенсивности заражения. Причины этого явления для отдельных видов паразитов различны. С возрастом рыб увеличивается количество потребляемой пищи, в том числе промежуточных хозяев паразитов.
Такие параметры, как длина и масса, были установлены для подсчета коэффициента «К» – допустимого среднего числа паразитов на 1 кг рыбы, в случае обнаружения не опасных для человека паразитов.
Средняя длина отобранных образцов из р. Ахтубы, пр. Кигач (район с. Подчалык) окуня обыкновенного составила 21,6 см, масса – 217,1 г, возраст – преимущественно 2 года. Исследованные особи были преимущественно самцами. В рыбе было обнаружено по одному паразиту нематод и трематод: род Eustrongylides и вид Rossicotrema donicum.
Средняя длина образцов, отобранных из р. Волги (район с. Верхнее Лебяжье), составила 16,9 см, масса – 155,0 г, возраст – 2 года. Исследованные особи были преимущественно самцами. Был обнаружен один паразит вида Rossicotrema donicum.
Средняя длина отобранных из р. Кривая Болда (район с. Яманцуг) образцов составила 19,7 см, масса – 172,0 г, возраст – 2 года. Исследованные особи были преимущественно самцами. Было обнаружено 2 паразита: род Eustrongylides и вид Rossicotrema donicum.
У всех изученных образцов было обнаружено только два вида паразита – род Eustrongylides и вид Rossicotrema donicum. Чаще особи окуня были поражены метацеркариями Rossicotrema donicum (рис. 1).
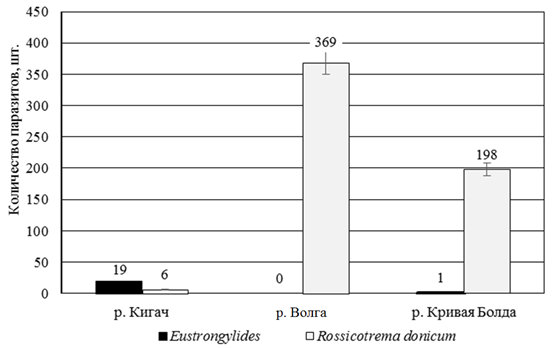
Рис. 1. Количество и видовой состав обнаруженных паразитов в исследованных водоемах
Fig. 1. Abundance and species composition of the detected parasites in the studied water bodies
Количество эустронгилид, извлеченных из окуня, больше в образцах из р. Кигач, в то время как количество метацеркариев при этом минимальное. Наибольшее количество Rossicotrema donicum обнаружено у образцов из р. Волги, при этом эустронгилиды отсутствуют.
Также была обнаружена закономерность – количество Rossicotrema donicum растет с ухудшением качества воды, а количество Eustrongylides, напротив, уменьшается (табл. 1).
Таблица 1
Table 1
Сопоставление количества обнаруженных гельминтов с качеством вод рек Волга,
Кигач и Кривая Болда
Comparison of the number of detected helminths with the quality of water in the Volga river,
the Kigach river and the Krivaya Bolda river
|
Створ |
КИЗВ |
УКИЗВ |
Rossicotrema donicum, шт. |
Eustrongylides, шт. |
|
77,44 |
4,3 |
369 |
0 |
|
|
р. Ахтуба, пр. Кигач, с. Подчалык |
63,4 |
3,52 |
6 |
19 |
|
р. Кривая Болда, с. Яманцуг |
73,8 |
4,1 |
198 |
1 |
Самым чистым водоемом можно назвать проток Кигач (обнаружено максимальное количество эустронгилид – 19), а самым грязным – р. Волгу (эустронгилиды не обнаружены, количество Rossicotrema donicum – 369).
Объяснить отсутствие эустронгилид в наиболее загрязненных водоемах можно, рассмотрев их жизненный цикл и всех промежуточных хозяев, это
и будет являться следующими этапами данного исследования. У паразита сложный жизненный цикл,
в который входят два промежуточных хозяина: паратенический хозяин и окончательный хозяин. Цикл начинается, когда болотная птица выделяет фекалии в водоем или поблизости от него. С фекалиями яйца паразита проливаются, и как только они достигают воды, олигохета (водный червь) или мелкие ракообразные (копеподы и амфиподы) питаются яйцами
и становятся первыми промежуточными хозяевами. Внутри олигохет или ракообразных из яиц паразита вылупляются личинки второй и третьей стадии. Когда рыба питается инфицированным олигохетом, она становится вторым промежуточным хозяином,
а паразит превращается в личинку четвертой стадии. Наконец, когда болотная птица питается инфицированной рыбой, она становится окончательным, или последним, хозяином, а Eustrongylides становится половозрелым. Паразит становится взрослым в течение 3–5 ч после заражения и откладывает яйца в течение 14–23 дней после заражения. Цикл повторяется, когда паразит становится половозрелым
и откладывает яйца, через фекалии птицы во внешнюю среду. Если более крупная рыба, амфибия или рептилия поедает инфицированную рыбу до того, как это делает болотная птица, она становится паратеническим хозяином до тех пор, пока ее не поедает окончательный хозяин [11].
Один из промежуточных хозяев данного паразита является достаточно требовательным к условиям среды обитания: «Амфиподы (гаммариды, понтопорея) являются первыми промежуточными хозяевами скребней, циатоцефалид и некоторых других гельминтов рыб. Указанные ракообразные широко распространены в природных водоемах
с чистой и проточной водой, поскольку они весьма требовательны к качеству внешней среды, особенно к кислородному режиму» [12, с. 23].
Следует отметить, что в желудке и кишечнике исследованных окуней, в которых были обнаружены эустронгилиды, также присутствовали остатки мелких ракообразных (в большом количестве). Это свидетельствует о значительном количестве их
в данном водоеме и значимости в рационе окуня. Наличие мелких ракообразных лишь доказывает, что состояние водоема в санитарном отношении находится на допустимом уровне.
Сопоставление приведенных выше данных привело к обнаружению положительной и обратной корреляционной зависимости между показателями КИЗВ, УКИЗВ и обнаруженным видовым составом и количеством паразитов. Коэффициент корреляции между КИЗВ и количеством Rossicotrema donicum
и УКИЗВ и Rossicotrema donicum составил 0,97, между КИЗВ и количеством Eustrongylides и УКИЗВ и количеством Eustrongylides – минус 0,98.
Исходя из полученных результатов исследований были определены экстенсивность и интенсивность инвазии (рис. 2 и 3) для каждого вида паразита в каждом водоеме.
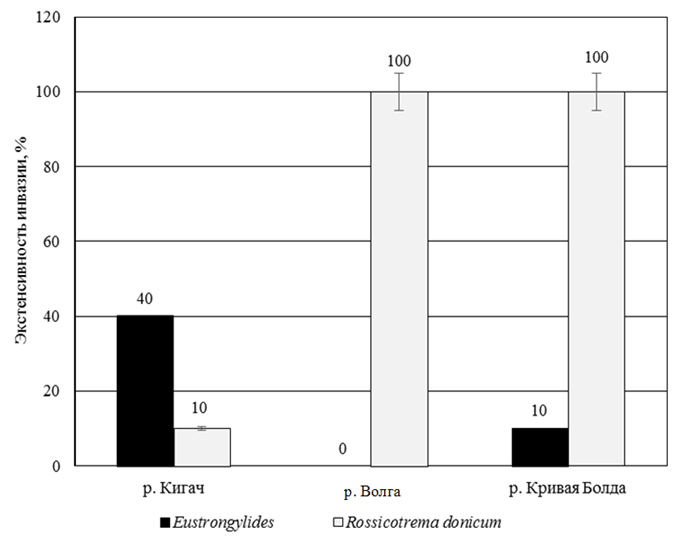
Рис. 2. Экстенсивность инвазии исследованных образцов
Fig. 2. Extensiveness of the studied samples invasion
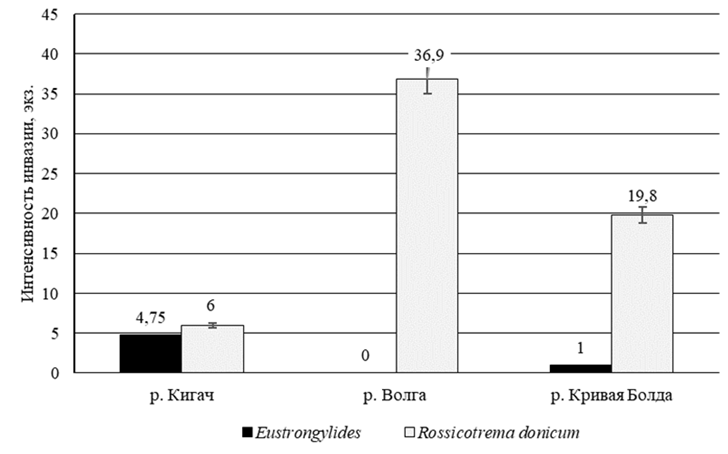
Рис. 3. Интенсивность инвазии исследованных образцов
Fig. 3. Intensiveness of the studied samples invasion
Самый большой показатель интенсивности
и экстенсивности инвазии наблюдается у образцов из р. Волги по метацеркариям Rossicotrema donicum. Данный водоем является самым неблагополучным в санитарном состоянии, а также
в плане эпизоотологической обстановки.
Паразиты рода Eustrongylides не нормируемый ТР ТС 040/2016 «О безопасности рыбы и рыбной продукции» [13] показатель, поэтому при установлении безопасности рыбы, пораженной этим паразитом, используется допустимое среднее число паразитов на 1 кг рыбы (табл. 2).
Таблица 2
Table 2
Допустимое среднее число паразитов на 1 кг рыбы
Permissible average number of parasites per 1 kg of fish
|
Виды паразитов в мясе |
«К» (допустимое среднее число паразитов на 1 кг рыбной продукции) |
К |
||
|
р. Кигач |
р. Волга |
р. Кривая Болда |
||
|
Нематоды, цестоды, личинки скребней и мелкие капсулы |
1,0 |
8,8 |
0 |
0,6 |
Следует отметить, что изучение всей паразитофауны окуня не являлось целью или одной из задач работы, но в ходе гельминтологического исследования другие паразиты (эктопаразиты) обнаружены не были. Эктопаразиты являются наиболее чувствительными к условиям окружающей среды, а их отсутствие может свидетельствовать о неблагоприятных параметрах в водоемах.
Заключение
Выявлено, что в р. Волга показатель экстенсивности и интенсивности зараженности метацеркариями Rossicotrema donicum окуня обыкновенного максимальный (100 % и 36,9 экз. соответственно). Данный водоем следует отнести к неблагополучным в эпизоотическом отношении. Лучше ситуация отмечена в р. Кривая Болда: показатель экстенсивности по метацеркариям на том же уровне, что
и в р. Волге (100 %), тогда как интенсивность
в 2 раза ниже (19,8 экз.). Также в р. Кривая Болда обнаружены нематоды (экстенсивность 10 %, интенсивность 1 экз.). Самым чистым среди всех исследованных водоемов в санитарном отношении является р. Кигач: экстенсивность и интенсивность по нематодам – 40 % и 4,75 экз., метацеркарям –
10 % и 6 экз. Но данный водоем нельзя назвать благополучным в эпидемиологическом отношении,
т. к. коэффициент К «Допустимое среднее число паразитов на 1 кг рыбы» превышает норму в 8,8 раз.
У всех изученных образцов окуня обыкновенного было обнаружено только два вида паразита – род Eustrongylides и вид Rossicotrema donicum. Чаще особи окуня были поражены метацеркариями Rossicotrema donicum (этот вид встречался во всех исследованных водоемах: в р. Кигач – 6, р. Волга – 369, р. Кривая Болда – 198). Эустронгилиды были выявлены только в двух водоемах: р. Кигач – 19,
р. Кривая Болда – 1.
Количество Rossicotrema donicum растет с ухудшением качества воды, а Eustrongylides, напротив, уменьшается. Самым чистым водоемом из трех исследованных можно считать проток Кигач (обнаружено максимальное количество эустронгилид – 20), а самым грязным – р. Волга (эустронгилиды не обнаружены, количество Rossicotrema donicum – 369). Обнаружена корреляционная зависимость между показателями КИЗВ, УКИЗВ и количеством паразитов: положительная тесная корреляция с коэффициентом 0,97 отмечена между интегральными показателями качества воды (КИЗВ, УКИЗВ) и количеством Rossicotrema donicum, в то время как тесная отрицательная корреляция (минус 0,98) отмечена между интегральными показателями качества воды (КИЗВ, УКИЗВ) и количеством Eustrongylides. Исходя из этого, можно отметить, что Rossicotrema donicum является индикатором грязной воды,
а Eustrongylides – чистой. Полученные данные указывают на взаимосвязь между качественным и количественным составом гельминтофауны и качеством среды их обитания.
1. Терентьева З. Х. Исследование объектов окружающей среды на загрязненность возбудителями инвазий на территории Оренбургской области // Теория и практика паразитарных болезней животных. М.: Изд-во ФГБУ ВНИИП им. К. И. Скрябина ФАНО России, 2014. С. 308-311.
2. Гальперина А. Р., Бареева А., Королевская В., Сопрунова О. Оценка состояния водотоков г. Астрахани по гидробиологическим и микробиологическим показателям // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2019. № 4. С. 24-31.
3. Мошу А. Гельминты рыб водоемов Днестровско-Прутского междуречья, потенциально опасные для здоровья человека // Междунар. ассоц. хранителей реки «Eco-TIRAS» / ред. И. Тромбицкого. Кишинэу: Eco-TIRAS, 2014. 88 с.
4. Доклад об экологической ситуации в Астраханской области в 2019 году // Служба природопользования и охраны окружающей среды Астраханской области. URL: https://nat.astrobl.ru/docs/document-16g5-4e75-4e0a-75 (дата обращения: 21.09.2020).
5. Руководство по химическому анализу поверхностных вод суши. Ростов н/Д.; Новочеркасск: НОК, 2009. Ч. 1. 1032 с.
6. Правила ветеринарно-санитарной экспертизы пресноводной рыбы и раков, утв. Минсельхозом СССР. URL: https://docs.cntd.ru/document/902124923 (дата обращения: 11.02.2019).
7. МУК13.2.988-00. Методы санитарно-паразитологической экспертизы рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработки. URL: https://docs.cntd.ru/document/1200030400 (дата обращения: 11.02.2019).
8. Методика паразитологического инспектирования морской рыбы и рыбной продукции (морская рыба-сырец, рыба охлажденная и мороженая). URL: https://docs.cntd.ru/document/1200121293 (дата обращения: 12.02.2019).
9. Аниканова В. С., Бугмырин С. В., Иешко Е. П. Методы сбора и изучения гельминтов мелких млекопитающих: учеб. пособие. Петрозаводск: Изд-во Карел. науч. центра РАН, 2007. 145 с.
10. Догель В. А. Итоги и перспективы паразитологических исследований в Ленинградском университете // Вестн. Ленингр. гос. ун-та. 1948. № 3. C. 31-39.
11. Spalding M. G., Форрестер Д. Дж. Патогенез Eu-strongylides ignotus (Nematoda: Dioctophymatoidea) у Ciconiiformes // Журн. болезней дикой природы. 1993. № 2. С. 250-260.
12. Богданова Е. А. Паразиты рыб как биоиндикаторы токсикологической ситуации в водоеме. СПб.: Изд-во ГОСНИОРХ, 1993. 22 с.
13. О безопасности рыбы и рыбной продукции: ТР ЕАЭС 040/2016 от 18 октября 2016 г. № 162. URL: https://docs.cntd.ru/document/420394425 (дата обращения: 12.02.2019).
















