Россия
Россия
Северокаспийские моллюски характеризуются высокой частотой встречаемости и широкой вариабельностью количественных показателей. В исследованиях, проведенных с 2013 по 2017 г. на акватории западной части Северного Каспия, частота встречаемости моллюсков составила 64 %. Численность находилась в диапазоне 10–8 290 экз./м2, биомасса – 0,003–1 162,066 г/м2. Моллюски обитали на глубинах 2,5–29,0 м при абсолютном содержании кислорода 1,29–8,52 мл/л, относительном – 21–134 %. Наибольшей частотой встречаемости (29 %) отличался вид Abra ovata. Вид Mytilaster lineatus встречался с частотой 24 %. По результатам исследований установлены пределы толерантности к содержанию кислорода всех видов моллюсков, обитающих в Северном Каспии, а также зоны оптимума для наиболее часто встречаемых представителей малакофауны. Минимальная концентрация кислорода, зафиксированная в придонном слое воды в западной части Северного Каспия в исследуемый период (1,29 мл/л), не является критической для видов Mytilaster lineatus, Hypanis angusticostata и Didacna barbotdemarnyi. Концентрацию кислорода менее 3 мл/л выдерживают виды Cerastoderma lamarcki и Abra ovata, менее 4 мл/л – Hypanis vitrea. Прочие виды, в том числе и виды, встреченные в единичных случаях, обитают при содержании кислорода свыше 4,06 мл/л. Оксифильными видами являются Hypanis semipellucida и Didacna pyramidata. Широкой экологической валентностью к кислороду обладают Mytilaster lineatus, Didacna barbotdemarnyi и Cerastoderma lamarcki. Наиболее благоприятным для развития моллюсков является абсолютное содержание кислорода в диапазоне 5,78–6,08 мл/л, в котором обнаружены все виды моллюсков. У большинства видов наблюдался рост количественных показателей при возрастании концентрации кислорода от 4 до 6 мл/л.
кислород, гипоксия, Северный Каспий, моллюски, толерантность к кислороду, численность, биомасса
Введение
Объектами данного исследования являются представители моллюсков (тип Mollusca).
В Каспийском море моллюски представлены двумя классами – двустворчатыми и брюхоногими [1]. Они обживают разные диапазоны глубин
и солености, относятся к различным экологическим группам по способам питания.
Mytilaster lineatus (Gmel.), Driessena polymorpha (Pall.) и Didacna trigonoides (Pall.) – неподвижные сестонофаги или фильтраторы эпифауны, поселяются на поверхности грунта и различных подводных предметах и улавливают пищевой материал из наддонной воды. Driessena polymorpha обитает в опресненных участках [2], Mytilaster lineatus встречается до глубины 50 м, является одним из господствующих видов малакофауны в Каспийском море [1, 3].
Подвижные, зарывающиеся в грунт сестонофаги, фильтраторы инфауны Cerastoderma lamarcki (Reeve), Hypanis angusticostata (Borcea), Hypanis vitrea (Eichw.) способны как отфильтровывать пищевые частицы из воды, так и брать их с поверхности осадка [2]. Cerastoderma lamarcki встречается на глубинах до 30 м, при солености не ниже 5 ‰ [1]. Hypanis angusticostata – вид, обитающий в самом поверхностном слое грунта, куда зарывается либо полностью, либо наполовину. Эвритопен, но предпочитает илы. Излюбленная соленость – 6–10 ‰. Фильтрует взвешенные частицы из воды и с поверхности грунта при помощи подвижных сифонов [4, 5]. Hypanis vitrea обитает преимущественно до 20 м, Hypanis semipellucida Logv. et Star. – до 30 м, Theodoxus pallasi Ldh. – до 35 м. Didacna barbot-demarnyi (Grimm) встречается до 40 м, предпочитает песчаные грунты; Hypanis plicata Eichw. – до 30 м, при солености не ниже 4 ‰; Hypanis laeviuscula (Eichw.) – не глубже 85 м и не ниже 4 ‰ [1]. Abra ovata (Phil.) толерантен к изменению температуры, солености и содержанию кислорода [6], в Северном Каспии обитает в широком диапазоне глубин – от 3 до 30 м. Наибольшие концентрации Abra ovata наблюдаются на глубине 6–12 м. Предпочитает песчаные и илистые грунты [7]. Ведет подвижный образ жизни. По способу добывания пищи – собиратель [8]. Один из господствующих на Каспии видов [3].
В Северном Каспии моллюски – доминирующая группа. Они имеют важное значение в питании рыб, поскольку являются кормовыми объектами различных видов бычковых, годовиков и взрослых особей леща, воблы, осетровых [7, 9]. Для достоверного прогноза динамики развития экосистем подход к их изучению должен учитывать механизм воздействия совокупности внешних факторов на структурно-функциональные характеристики биоценозов [10]. Однако несмотря на то, что многие исследователи указывали на различную адаптацию бентонтов к колебаниям растворенного в воде кислорода [11–15], на угрозу снижения биомассы бентоса в условиях дефицита кислорода и гибель бентосных организмов при заморах [16], экологическая толерантность к кислороду северокаспийских моллюсков не определена.
Учитывая периодическое формирование гипоксии в придонном слое воды в Северном Каспии [17], изучение отношения данной группы бентонтов
к газовому режиму – важная часть детекции состояния кормовой базы ихтиофауны.
Материалы и методы исследования
Исследования проведены с 2013 по 2017 г. на акватории западной части Северного Каспия. Общее количество станций отбора проб – 246. Содержание кислорода в придонном слое воды определялось йодометрическим методом [18]. Гидробиологические исследования (подсчет численности, биомассы, а также определение организмов до вида, расчет частоты встречаемости) проведены согласно общепринятым методикам [1, 19, 20]. При определении толерантности моллюсков к кислороду средние величины численности и биомассы были рассчитаны внутри массивов, сгруппированных по концентрации кислорода в месте отбора (1,29–2,00 мл/л;
2,01–3,00 мл/л; 3,01–4,00 мл/л и т. д.).
Результаты исследования и их обсуждение
Диапазон изменений концентрации кислорода составил 1,29–8,52 мл/л (21–134 % относительного содержания). Дефицит кислорода (менее 80 % насыщения) возникал преимущественно на локальных участках мелководной (до 5-метровой изобаты) зоны и на границе Северный Каспий – Средний Каспий. Формирование гипоксии было обусловлено термохалинной стратификацией водных масс.
Частота встречаемости моллюсков составила 64 %. Численность находилась в диапазоне 10–8 290 экз./м2; биомасса – 0,003–1 162,066 г/м2. Моллюски обитали на глубинах 2,5–29,0 м при абсолютном содержании кислорода 1,29–8,52 мл/л, относительном – 21–134 %. При этом количественные показатели бентонтов зависели от концентрации кислорода. Численность
и биомасса возрастали в диапазоне 4,00–8,00 мл/л растворенного в воде кислорода (рис. 1).
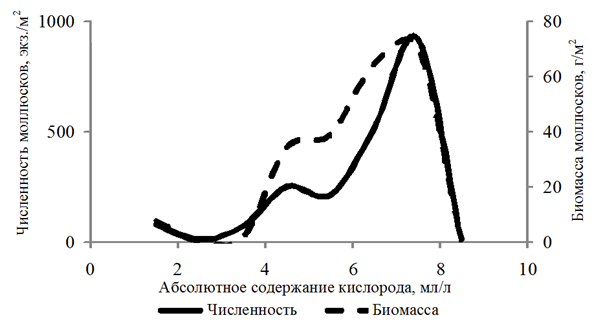
Рис. 1. Численность и биомасса моллюсков в зависимости
от абсолютного содержания кислорода в придонном слое воды
Fig. 1. Abundance and biomass of mollusks depending
on the absolute oxygen content in the bottom water layer
Наибольшей частотой встречаемости (29 %) отличался вид Abra ovata. Бентонты обнаружены на глубинах 3,3–21,0 м. Численность организмов изменялась от 10 до 1 780 экз./м2, биомасса – от 0,002 до 103,520 г/м2. Abra ovata встречен при абсолютном содержании кислорода 2,19–7,67 мл/л, относительном содержании кислорода 32–134 %. Рост численности и биомассы абры наблюдался
в диапазоне 4,00–6,00 мл/л растворенного в воде кислорода (рис. 2).
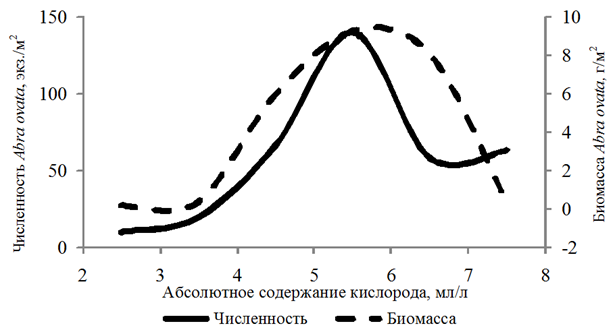
Рис. 2. Численность и биомасса Abra ovata
в зависимости от абсолютного содержания кислорода в придонном слое воды
Fig. 2. Abundance and biomass of Abra ovate
depending on the absolute oxygen content in the bottom water layer
Вид Mytilaster lineatus встречался с частотой
24 %. Он обживал глубины 4,0–28,0 м. Численность этого вида изменялась от 10 до 3 940 экз./м2, биомасса – от 0,002 до 120,710 г/м2. Абсолютное содержание кислорода в ареале его обитания изменялось в пределах 1,29–8,57 мл/л, относительное –21–123 %. Резкий рост численности организмов отмечен при концентрации кислорода 6,00–8,00 мл/л, биомассы – 4,00–6,00 мл/л (рис. 3).

Рис. 3. Численность и биомасса Mytilaster lineatus
в зависимости от абсолютного содержания кислорода в придонном слое воды
Fig. 3. Abundance and biomass of Mytilaster lineatus
depending on the absolute oxygen content in the bottom water layer
Didacna protracta (Eichw.) встречалась с частотой 19 % на глубинах 3,3–27,0 м. Численность ее изменялась в пределах 10–880 экз./м2, биомасса – 0,003–771,18 г/м2. Организмы обнаружены при 4,06–7,74 мл/л и 59–134 % содержания кислорода.
Cerastoderma lamarcki встречался с частотой
19 % на глубинах 4,0–29,0 м. За период исследований численность варьировала от 10 до 8 130 экз./м2, биомасса – от 0,009 до 89,180 г/м2. Организмы обитали при абсолютном содержании кислорода 1,82–7,68 мл/л, относительном содержании кислорода 26–134 %.
Частота встречаемости Hypanis angusticostata составила 14 %. За период исследований численность данного вида изменялась от 10 до 70 экз./м2, биомасса – от 0,003 до 31,787 г/м2. Организмы встречались на глубинах 2,5–12,4 м при абсолютном содержании кислорода 1,29–6,58 мл/л, относительном содержании кислорода 21–123 %.
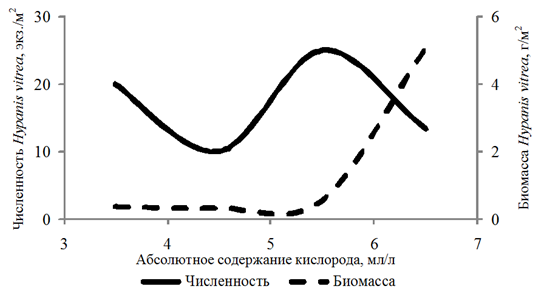
Частота встречаемости Hypanis vitrea составила 11 %. Численность изменялась в интервале
10–60 экз./м2, биомасса – 0,02–15,057 г/м2. Организмы обнаружены на глубинах 2,8–16,0 м при абсолютном содержании кислорода 3,98–6,28 мл/л, относительном содержании кислорода 75–108 %.
Биомасса Didacna protracta и Hypanis angusticostata увеличивалась с возрастанием концентрации кислорода до 6,00 мл/л, Hypanis vitrea – до 7 мл/л (рис. 4).
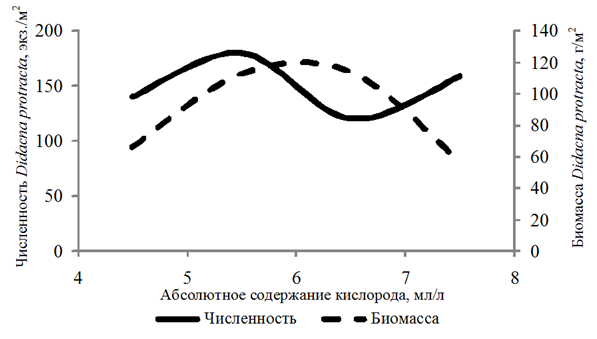
а
Рис. 4. Численность и биомасса Didacna protracta (а)
в зависимости от абсолютного содержания кислорода в придонном слое воды
Fig. 4. Abundance and biomass of Didacna protracta (а)
depending on the absolute oxygen content in the bottom water layer
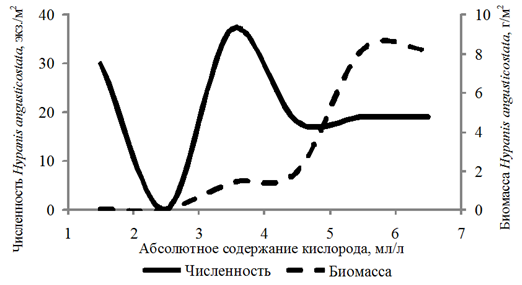
б
в
Рис. 4 (окончание). Численность и биомасса Hypanis angusticostata (б) и Hypanis vitrea (в)
в зависимости от абсолютного содержания кислорода в придонном слое воды
Fig. 4 (ending). Abundance and biomass of Hypanis angusticostata (б) and Hypanis vitrea (в)
depending on the absolute oxygen content in the bottom water layer
Распределение численности этих видов по акватории Северного Каспия не зависело от содержания растворенного в воде кислорода.
Didacna barbotdemarnyi обнаружена c частотой
8 % на глубинах 8,8–25,0 м. Численность этого вида изменялась в диапазоне 10–1 190 экз./м2, биомасса – 0,03–336,540 г/м2 при 1,29–7,74 мл/л и 21–134 % содержания кислорода. Рост численности и биомассы наблюдался при возрастании концентрации кислорода от 4,00 до 6,00 мл/л, при большем содержании кислорода зафиксирован спад количественных показателей (рис. 5).
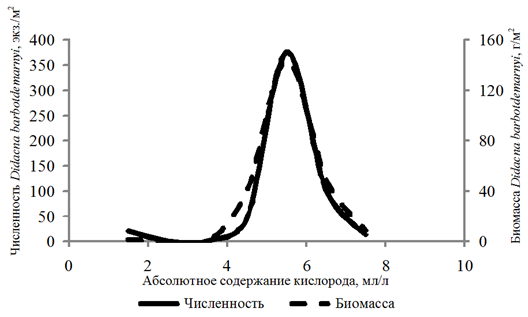
Рис. 5. Численность и биомасса Didacna barbotdemarnyi
в зависимости от абсолютного содержания кислорода в придонном слое воды
Fig. 5. Abundance and biomass of Didacna barbotdemarnyi
depending on the absolute oxygen content in the bottom water layer
Рост количественных показателей при возрастании концентрации кислорода от 4 до 6 мл/л наблюдается у большинства моллюсков: у Abra ovata и Didacna barbotdemarnyi увеличиваются
и численность, и биомасса; у Mytilaster lineatus, Didacna protracta, Hypanis angusticostata, Hypanis vitrea – только биомасса.
При дальнейшем возрастании содержания кислорода количественные показатели бентонтов
в большинстве случаев снижаются. Причина этого явления, вероятно, имеет гидрохимическую природу. Высокое содержание кислорода в придонном слое воды наблюдается только при ограниченном расходе кислорода на окислительные процессы. Это возможно в биотопах, грунты которых представлены крупнозернистыми фракциями, с низким содержанием органического вещества как в придонном слое воды [21], так и в составе донных отложений [22]. Крупнозернистые осадки обеднены и биогенными элементами [23], а, как известно, количественные характеристики бентоса зависят от обеспеченности пищей [24]. Кроме того, в окислительных условиях миграция биогенов из грунтов в воду протекает достаточно слабо [25]. Можно предположить, что жесткий грунт и низкое содержание питательных веществ в наддонной воде и донных отложениях ограничивают развитие моллюсков.
Данной закономерности не подчиняется динамика количественных показателей двух видов моллюсков: Hypanis vitrea и Cerastoderma lamarcki.
Частота встречаемости Hypanis semipellucida
и Theodoxus pallasi составила по 2 %. Представители Hypanis semipellucida обитали на глубинах 12,0–24,0 м при высоком (5,78–7,68 мл/л, 79–134 %) содержании кислорода. Theodoxus pallasi обживал глубины
10,5–22,0 м. Численность была на отметке
10,0 экз./м2, биомасса изменялась от 0,070 до
0,876 г/м2. Содержание кислорода в ареале его обитания варьировало в пределах 4,95–7,67 мл/л, 81–134 %. Также крайне низкой (2 %) была частота встречаемости Didacna trigonoides и Didacna pyramidata (Grimm). Didacna trigonoides обитала на глубинах 5,3–10,0 м. Численность ее во всех случаях была на отметке 10 экз./м2, биомасса колебалась от 5,95 до 42,689 г/м2. При этом содержание кислорода варьировало от 4,06 до 6,08 мл/л (68–106 %). Didacna pyramidata встречалась на глубинах 10,0–22,0 м. Численность изменялась в интервале 10–70 экз./м2, биомасса – 11,176–61,330 г/м2. Представители данного вида зарегистрированы в зоне с высоким содержанием кислорода – 5,59–7,27 мл/л (96–123 %).
В единичных случаях зарегистрированы Hypanis laeviuscula, Didacna parallella (Bog.) и Dreissena rostriformis (Desh.), эти моллюски найдены на глубинах 5,3; 21,0 и 11,3 м соответственно. Hypanis lаeviuscula обитал при содержании кислорода
4,89 мл/л (81 %). Численность его была равна
20 экз./м2, биомасса – 6,320 г/м2. Didacna parallella (численностью 20 экз./м2, биомассой 14,030 г/м2) обнаружена на станции, где абсолютное содержание кислорода составляло 7,22 мл/л, относительное содержание кислорода – 103 %. Численность Dreissena rostriformis составила 10 экз./м2, биомасса – 0,590 г/м2. Содержание кислорода на станции обнаружения этого вида равнялось 7,51 мл/л (127 %).
Пределы толерантности к содержанию кислорода моллюсков (кроме тех видов, что зарегистрированы в единичных случаях) представлены в таблице.
Пределы толерантности отдельных видов моллюсков к содержанию кислорода
Limits of tolerance to the oxygen content for certain species of molluscs
|
Вид |
Содержание кислорода |
|||
|
Минимум |
Максимум |
|||
|
Абсолютное |
Относительное содержание, % |
Абсолютное |
Относительное содержание, % |
|
|
Abra ovata |
2,19 |
32 |
7,67 |
134 |
|
Mytilaster lineatus |
1,29 |
21 |
8,57 |
123 |
|
Didacna protracta |
4,06 |
59 |
7,74 |
134 |
|
Cerastoderma lamarcki |
1,82 |
26 |
7,68 |
134 |
|
Hypanis angusticostata |
1,29 |
21 |
6,58 |
123 |
|
Hypanis vitrea |
3,98 |
75 |
6,28 |
108 |
|
Didacna barbotdemarnyi |
1,29 |
21 |
7,74 |
134 |
|
Hypanis semipellucida |
5,78 |
79 |
7,68 |
134 |
|
Theodoxus pallasi |
4,95 |
81 |
7,67 |
134 |
|
Didacna trigonoides |
4,06 |
68 |
6,08 |
106 |
|
Didacna pyramidata |
5,59 |
96 |
7,27 |
123 |
Таким образом, минимальная концентрация кислорода, зафиксированная в придонном слое воды в западной части Северного Каспия в исследуемый период (1,29 мл/л), не является критической для видов Mytilaster lineatus, Hypanis angusticostata и Didacna barbotdemarnyi. Концентрацию кислорода менее 3 мл/л выдерживают виды Cerastoderma lamarcki и Abra ovata, менее 4 мл/л – Hypanis vitrea. Прочие виды, в том числе и виды, встреченные в единичных случаях, обитают при содержании кислорода свыше 4,06 мл/л. При этом оксифильными видами являются Hypanis semipellucida и Didacna pyramidata, обнаруженные при содержании кислорода не ниже 5,78 и 5,59 мл/л соответственно. Широкая экологическая валентность к кислороду характерна для Mytilaster lineatus, Didacna barbotdemarnyi и Cerastoderma lamarcki. Самым узким диапазоном толерантности отличается Didacna pyramidata.
Пространственное распределение моллюсков в зависимости от газового режима в придонном слое воды выглядит следующим образом.
С началом изоксигены 1,29 мл/л появляются самые устойчивые к низкому содержанию кислорода виды Mytilaster lineatus, Hypanis angusticostata и Didacna barbotdemarnyi (рис. 6).
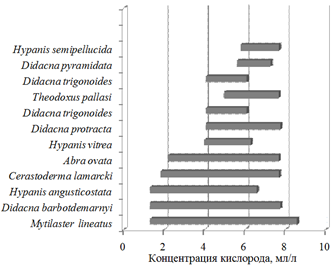
Рис. 6. Наличие видов типа Mollusca при разной концентрации кислорода
Fig. 6. Presence of Mollusca species at different oxygen concentrations
С изоксигеной 1,82 мл/л появляется Cerastoderma lamarcki. Как только насыщение вод кислородом достигает 2,19 мл/л, регистрируется Abra ovata. При 3,98 мл/л появляется Hypanis vitrea. При содержании растворенного в воде кислорода более 4,06 мл/л обнаруживаются Didacna protracta и Didacna trigonoides. Далее, при 4,95 мл/л, в составе моллюсков появляется Theodoxus pallasi. С изоксигеной 5,59 мл/л обнаруживается Didacna pyramidata, 5,78 мл/л – Hypanis semipellucida. Виды, зарегистрированные в единичных случаях, встречены при концентрации кислорода 4,89 мл/л (Hypanis lаeviuscula), 7,22 мл/л (Didacna parallella) и 7,51 мл/л (Dreissena rostriformis).
Убывание видов происходит в следующем порядке. Didacna trigonoides исчезает при содержании кислорода свыше 6,08 мл/л. Далее, при абсолютном содержании кислорода более 6,28, исчезает Hypanis vitrea. За изоксигеной 6,58 мл/л в бентосном сообществе не встречался вид Hypanis angusticostata, за изоксигеной 7,27 мл/л – Didacna pyramidata. При концентрации кислорода свыше 7,67 мл/л не обнаружены Abra ovata и Theodoxus pallasi; 7,68 мл/л – Cerastoderma lamarcki и Hypanis semipellucida. За изоксигеной 7,74 мл/л отсутствовали Didacna protracta и Didacna barbotdemarnyi. Самым устойчивым к высокой концентрации растворенного в воде кислорода является Mytilaster lineatus, встреченный при максимальном за период исследований содержании кислорода (8,57 мл/л).
Таким образом, наиболее благоприятной для развития моллюсков является концентрация кислорода от 5,78 до 6,08 мл/л. Именно в этом диапазоне обитают все виды моллюсков (кроме тех, что зарегистрированы в единичных случаях).
Заключение
Представители типа Mollusca характеризуются высокой частотой встречаемости и широкой вариабельностью количественных показателей. Моллюски обитают в широком диапазоне содержания кислорода. Разные виды имеют различную кислородную зону адаптации. Наибольшей устойчивостью
к дефициту кислорода отличались Mytilaster lineatus, Hypanis angusticostata и Didacna barbotdemarnyi. Оксифильными видами являются Hypanis semipellucida и Didacna pyramidata. Широкая экологическая валентность к кислороду характерна для Mytilaster lineatus, Didacna barbotdemarnyi и Cerastoderma lamarcki. Самым узким диапазоном толерантности отличается Didacna pyramidata.
Наиболее благоприятным для развития северо-каспийских моллюсков является абсолютное содержание кислорода в диапазоне 5,78–6,08 мл/л,
в котором обнаружены все виды моллюсков. При этом рост количественных показателей у большинства видов наблюдался при возрастании концентрации кислорода от 4 до 6 мл/л.
1. Атлас беспозвоночных Каспийского моря / под ред. Я. А. Бирштейна. М.: Пищ. пром-сть, 1968. 414 с.
2. Яблонская Е. А. Многолетние изменения биомассы разных трофических групп бентоса Северного Каспия // Тр. ВНИРО. 1975. Т. CVIII. С. 50-64.
3. Янина Т. А., Свиточ А. А., Сорокин В. М., Курбанов Р. Н. Биоразнообразие малакофауны Каспийского моря: природный и антропогенный вклад // Морские биологические исследования: достижения и перспективы: сб. материалов Всерос. науч.-практ. конф. с междунар. участием, приуроч. к 145-летию Севастоп. биологич. ст.: в 3 т. Севастополь: ЭКОСИ-Гидрофизика, 2016. Т. 2. С. 201-204.
4. Карпевич А. Ф. Отношение некоторых семейств вида Cardidae к солевому режиму Северного Каспия // Докл. АН СССР. 1946. Т. 54. № 1. С. 73-75.
5. Малиновская Л. В. Многолетняя динамика количественного развития Hypanis angusticostata (Borcea) в Северном Каспии // Вопр. промысловой океанологии. 2007. Вып. 4. № 1. С. 114-131.
6. Малиновская Л. В. Многолетняя динамика развития моллюсков Северного Каспия // Рыбохозяйственная наука на Каспии: задачи и перспективы: материалы Междунар. конф., посв. 40-летию ГУДП «Дагестанское отделение КаспНИРХ». Астрахань: Изд-во КаспНИРХ, 2003. С. 118-121.
7. Каспийское море. Фауна и биологическая продуктивность / под ред. Е. А. Яблонской. М.: Наука, 1985. 276 с.
8. Малиновская Л. В., Зинченко Т. Д. Многолетняя динамика биомассы вселенцев Hediste diversicolor müller и Abra ovata (Philippi) в Северном Каспии // Рос. журн. биолог. инвазий. 2010. № 4. С. 32-44.
9. Хлопкова М. В., Гусейнов М. К., Гусейнов К. М., Гасанова А. Ш. К фауне двустворчатых моллюсков дагестанского побережья Каспийского моря // Юг России: экология, развитие. 2018. Т. 13. № 2. С. 9-21. DOI:https://doi.org/10.18470/1992-1098-2018-2-9-21.
10. Шитиков В. К., Зинченко Т. Д. Многомерный статистический анализ экологических сообществ (обзор) // Теоретич. и приклад. экология. 2019. № 1. С. 5-11. DOI:https://doi.org/10.25750/1995-4301-2019-1-005-011.
11. Осадчих В. Ф. Состав и распределение мизид в Северном Каспии // Тр. Касп. науч.-исследоват. ин-та мор. рыб. хоз-ва и океанографии. 1959. Т. XV. С. 103-110.
12. Абдурахманов Г. М., Сокольская Е. А. Основные экологические особенности бентоса Северного Каспия // Юг России: экология, развитие. 2009. № 4. С. 65-68.
13. Дегтярева Л. В., Кострыкина Т. А., Даирова Д. С., Кашин Д. В., Письменная О. А., Петренко Е. Л. Отношение кольчатых и круглых червей к кислороду в западной части Северного Каспия // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2019. № 1. С. 20-27. DOI:https://doi.org/10.24143/2073-5529-2019-1-20-27.
14. Дегтярева Л. В., Кострыкина Т. А. Отношение корофиид к кислороду в западной части Северного Каспия // Проблемы сохранения экосистемы Каспия в условиях освоения нефтегазовых месторождений: материалы VII Науч.-практ. конф. с междунар. участием (Астрахань, 18 октября 2019 г.). Астрахань: Изд-во КаспНИРХ, 2019. С. 56-59.
15. Дегтярева Л. В., Даирова Д. С., Кострыкина Т. А., Письменная О. А., Кашин Д. В. Экологическая валентность к кислороду северокаспийских мизид и кумовых ракообразных // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2019. № 4. С. 32-41. DOI:https://doi.org/10.24143/2073-5529-2019-4-32-41.
16. Катунин Д. Н. Гидроэкологические основы формирования экосистемных процессов в Каспийском море и дельте реки Волги. Астрахань: Изд-во Кас-пНИРХ, 2014. 478 с.
17. Островская Е. В., Гаврилова Е. В., Курапов А. А., Варначкин С. А. Влияние изменений климата на гидролого-гидрохимические характеристики Северного Каспия // Астрахан. вестн. эколог. образования. 2020. № 6 (60). С. 25-35. DOI:https://doi.org/10.36698/2304-5957-2020-19-6-25-35.
18. РД 52.10.736-2010. Объемная концентрация кислорода в морских водах. Методика измерений йодометрическим методом. М.: Изд-во ФГУ «ГОИН», 2010. 27 с.
19. Методика изучения биогеоценозов внутренних водоемов / под ред. Ф. Д. Мордухай-Болтовского. М.: Наука, 1975. 240 с.
20. Романова Н. Н. Методические указания к изучению бентоса южных морей СССР. М.: Изд-во ВНИРО, 1983. 14 с.
21. Плотников И. С. Многолетние изменения фауны свободноживущих водных беспозвоночных Аральского моря. СПб.: Изд-во ЗИН РАН, 2016. 168 с.
22. Лобковский Л. И., Левченко Д. Г., Леонов А. В., Амбросимов А. К. Геоэкологический «портрет» экосистемы Каспийского моря // Геоэкологический монито-ринг морских нефтегазоносных акваторий. М.: Наука, 2005. С. 263-298.
23. Страхов Н. М. Избранные труды. Общие проблемы геологии, литологии и геохимии. М.: Наука, 1983, 640 с.
24. Студников С. Н., Малиновская Л. В., Кузин А. В. Динамика развития зообентоса на акватории месторождения им. Ю. Корчагина в Северном Каспии // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2018. № 2. С. 89-97. DOI:https://doi.org/10.24143/2073-5529-2018-2-89-97.
25. Александрова З. С. Влияние донных отложений на режим кислорода и содержание биогенных веществ в Азовском море: дис. ... канд. геогр. наук. Ростов н/Д., 1980. 203 с.
















