Россия
Россия
Значительный интерес для рыбохозяйственной отрасли в настоящее время представляет удовлетворение спроса на качественные функциональные рыбные корма с учетом успешного их импортозамещения. Де-фицит белкового сырья высокого качества негативно влияет на кормопроизводство, снижая объемы производства полноценных комбикормов. Для частичной замены рыбной муки в качестве альтернативного источника белка возможно применение в составе кормов продуктов микробиологического синтеза. Основное преимущество данного компонента – в более высокой скорости накопления биомассы микроорганизмов по сравнению с растениями и животными. Изучение белковых продуктов биосинтеза как кормовых компонентов необходимо обосновать с точки зрения экономической целесообразности и возможности их включения в кормовую базу гидробионтов. Это позволит стимулировать развитие аквакультуры и увеличить объемы интенсивных форм рыбоводства. В ходе научно-исследовательской работы была проведена частичная замена рыбной муки в стартовом (20,0 %) и продукционном (15,0 %) комбикорме для молоди креветки Розенберга на белковую кормовую добавку DREAMFEED®, представляющую собой концентрат микробного белка Methylococcus capsulatus. Анализ питательной ценности комбикормов показал, что комбикорм с кормовой белковой добавкой DREAMFEED® имел содержание белка 67,01–67,34 % и энергии 20,1–20,5 МДж/кг. Более высокий темп роста показала опытная группа, потреблявшая корм с заменой рыбной муки на кормовую добавку DREAMFEED®. Абсолютный прирост составил 17,53 и 14,53 г у опытной и контрольной групп соответственно. За весь период исследования выживаемость в опытном варианте составила 89,0 %. В контрольном варианте выживаемость не превысила 82,0 %. В результате анализа минерального состава печени, мышц и панциря культивируемых креветок установлено, что во всех исследуемых образцах присутствует К. Наибольшее количество К зафиксировано в мышцах креветок контрольной группы – 14 996 ± 150 мг/кг, при 14 867 ± 135 мг/кг у опытной группы. Наименьшее количество К зафиксировано в образцах печени опытной группы – 5 049 ± 254 мг/кг, при 6 520 ± 221,0 мг/кг у креветок контрольной группы.
белок, добавка, микроорганизмы, прирост, физиология, кормление, креветка
Введение
В настоящее время на фоне интенсивного роста товарной аквакультуры, развития кормопроизводства и совершенствования технологий выращивания гидробионтов аквакультура стала важной частью продовольственной безопасности. Отмечается повышение государственной вовлеченности в развитие малого бизнеса фермеров, что способствует развитию рыбохозяйственной отрасли в России [1]. Интенсивно развивается не только товарное рыбоводство, но и индустриальное выращивание креветок. Эффективность выращивания ракообразных, в том числе креветок, зависит от качества корма [2, 3]. Необходимый уровень белка в кормовой смеси для креветок должен быть не менее 40,0 %, при этом для производителей содержание протеина достаточно на уровне 30,0 %, для молоди – 30,0–40,0 %, для личинок – 55,0 % [4]. Источником белка в кормах для креветок являются мясо кальмара, соевая мука, креветочная мука и некоторые виды рыбной муки. Важным условием является удовлетворение потребностей креветок в незаменимых аминокислотах: фенилаланине, лизине, гистидине, аспарагиновой кислоте, треонине, валине, метионине, изолейцине, лейцине и триптофане [5]. Для производства эффективных полнорационных комбикормов необходимо качественное белковое сырье, дефицит которого осложняет ситуацию с кормопроизводством и негативно влияет на выпуск стартовых и продукционных комбикормов. Однако это способствует разработке нового кормового сырья, а также исследованию кормовых компонентов, уже успешно применяемых в практике сельского хозяйства. При этом основным критерием является удовлетворение биологическим потребностям культивируемых гидробионтов. В частности, замена рыбной муки на иные источники протеина позволит не только снизить проблему закупки дефицитного компонента, но и разработать монокорма для представителей нерыбных объектов аквакультуры [6–9]. Одним из перспективных путей получения белковых веществ является микробный синтез. Выращивание микроорганизмов на различном сырье, богатом углеродом и другими биогенными элементами, позволяет получать микробные массы. Для получения таких белковых препаратов используют бактерии, накапливающие до 60,0–70,0 % белка от своей массы, при соблюдении специальных условий выращивания. Метанотрофные бактерии при соблюдении определенных условий способны использовать природный газ как питательную среду. При этом отмечается быстрый рост, размножение и увеличение биомассы, богатой белком, витаминами и биологически активными веществами. В условиях растущего дефицита рыбной муки и других компонентов животного происхождения изучение новых белковых продуктов биосинтеза с точки зрения возможности и экономической целесообразности использования их в кормах для рыб представляется важнейшей задачей, решение которой будет способствовать развитию и наращиванию объемов интенсивных форм рыбоводства. Целью исследования является оценка влияния экструдированного высокобелкового продукта микробиологического синтеза в качестве альтернативного белкового компонента в полностью экструдированных комбикормах на показатели роста и физиологическое состояние пресноводной креветки Розенберга.
Материалы и методы исследования
Испытание вариантов экструдированных комбикормов для пресноводной креветки проводили в условиях аквариального комплекса (Инновационный центр «Биоаквапарк – научно-технический центр аквакультуры») Астраханского государственного технического университета (АГТУ), а также лабораторных условиях научно-исследовательской лаборатории «Осетроводство и перспективные объекты аквакультуры» АГТУ. Объектом исследования служила гигантская пресноводная креветка Macrobrachium rosenbergii (De Man, 1879) (рис. 1).

Рис. 1. Гигантская пресноводная креветка Macrobrachium rosenbergii
Fig. 1. Giant freshwater shrimp Macrobrachium rosenbergii
Посадочный материал содержали в аквариумах (400 л) с искусственной аэрацией и фильтрацией, а также подогревом воды. Для укрытия креветок были сооружены домики из керамики и пластика. Плотность посадки составила 100 шт. на аквариум: опытный и контрольный (двойная повторность). Оптимальный фоторежим для молоди и взрослых особей в условиях эксперимента – 12 : 12 (свет : темнота) при освещенности 1 000 лк. На протяжении исследования контролировали гидрохимический режим, водообмен, рост и развитие креветок (табл. 1).
Таблица 1
Table 1
Гидрохимические показатели воды в аквариумах
Hydrochemical parameters of water in aquariums
|
Показатель |
Диапазон колебаний |
Технологическая норма* |
|
Активная реакция среды, pH |
7,0–7,8 |
6,8–7,2 |
|
Кислород, мг/л |
7,4–8,1 |
5,0 |
|
Аммонийный азот, мг N/л |
0,06–0,09 |
2–4 |
|
Нитриты, мг N/л |
0,01–1,26 |
до 0,1–0,2 |
|
Нитраты, мг N/л |
2,1–53 |
до 60 |
|
Температура, °С |
25–29 |
26–28 |
*Данные [10].
Содержание кислорода фиксировали по данным термооксиметра Mарк-302М. Водородный показатель регистрировали с помощью рН-метра HANNA. Концентрацию биогенных элементов в воде измеряли с помощью экспресс-тестов Sera, используемых в соответствии с инструкцией разработчика. Для предотвращения возникновения грибковых заболеваний в ходе экспериментальной работы проводились постоянный контроль качества выростной среды и профилактические меры борьбы с заболеваниями. Профилактические меры позволили снизить элиминацию, однако отход отдельных особей случался у подрастающих креветок как проявление каннибализма. При проведении стандартного биологического анализа у креветок определяли общую длину (от конца рострума до конца тельсона) и массу тела, регистрировали выживаемость. Длину L молоди креветок измеряли с помощью окуляр-микрометра, измерение взрослых особей осуществляли с помощью штангенциркуля/линейки с точностью до 1 мм. Индивидуальную массу определяли с помощью электронных весов (AND, точность до 0,0001 г; Масса-К, точность до 0,01 г), предварительно обсушив гидробионтов фильтровальной бумагой (рис. 2).
|
|
|
Рис. 2. Взвешивание и измерение гигантской пресноводной креветки Розенберга
Fig. 2. Weighing and measuring Rosenberg's giant freshwater shrimp
Контрольный и опытный комбикорма были изготовлены в лабораторных условиях методом экструзии крахмалосодержащего сырья, гранулирования и получения гранул нужного размера [11]. В процессе изготовления в корма была добавлена кормовая добавка DREAMFEED® (ООО «Гипробиосинтез», Россия), являющаяся концентратом микробного белка из инактивированной культуры клеток Methylococcus capsulatus (штамм ГБС-15) – 100 %, с содержанием сырого протеина – 70–80 %, липидов – 9–14 %, золы – 6–10 % и влаги не более 10 %. Кормовую добавку вводили в комбикорм в количестве 15,0 и 20,0 % (табл. 2).
Таблица 2
Table 2
Состав рецепта гранулированно-экструдированного корма, %
Composition of the granulated-extruded feed recipe, %
|
Компонент |
Продукционный |
Стартовый |
||
|
Опыт |
Контроль |
Опыт |
Контроль |
|
|
Рыбная мука |
57,0 |
72,0 |
52,0 |
72,0 |
|
Пшеничный глютен |
15,0 |
|||
|
Крилевая мука |
5,0 |
|||
|
Премикс |
1,0 |
|||
|
Мука из кожицы винограда |
1,0 |
|||
|
Кровяная мука |
3,0 |
|||
|
DREAMFEED® |
15,0 |
– |
20,0 |
– |
|
Рыбий жир |
3,0 |
|||
Органолептические и технологические показатели полученного гранулированно-экструдированного корма (водостойкость, набухаемость, крошимость) определяли в лабораторных условиях согласно действующим ГОСТ [12–14]. Скорость набухания определяли по абсолютной сухой массе. Выращивание молоди пресноводной креветки с применением экспериментальных кормов разделили на 2 этапа: кормление стартовыми кормами с добавлением 20 % DREAMFEED® (65 дней), кормление продукционными кормами с добавлением 15 % добавки DREAMFEED® (70 дней). С помощью рыбоводно-биологического анализа определяли эффективность проведенной работы. За период выращивания (135 суток) изменения длины и массы фиксировали на контрольных измерениях (контрольные точки). Рыбоводно-биологические показатели определяли по следующим формулам [15–17]:
– абсолютный прирост:
Pаб = mк – m0,
где mк и m0 – конечная и начальная масса, г;
– коэффициент упитанности по Фультону:
QФ = (W · 100) / l3,
где W – масса тела, г; l – абсолютная длина, см;
– коэффициент массонакопления:
Kм = ((mк1/3 – m01/3) · 3) / t,
где t – продолжительность исследования, сут;
– среднесуточный прирост:
Рср.сут = (mк – m0) / t;
– среднесуточная скорость роста, %:
А = [(mк / m0 )1/t – 1] · 100.
Затраты кормов фиксировали ежедневно как важный показатель выращивания. Кормовые затраты определяли как общее количество корма, внесенного в емкость для выращивания [18]. Выживаемость учитывали поштучным методом. Результаты исследований обработаны с применением общепринятых методов биологической статистики [19] и программы Microsoft Excel. Статистический анализ проводили с определением среднего арифметического значения М, статистической ошибки m, стандартного отклонения σ, коэффициента вариации CV. Уровень различий оценивали с помощью критерия достоверности Стьюдента.
Результаты исследований
Отмечено, что опытные комбикорма хорошо поедались креветкой. Крошимость стартовых и продукционных кормов составила 1,5 %, контрольной партии – 1,6 %. Скорость набухания опытных партий корма составила 5,5 мин при водостойкости 36,0 мин. У контрольной партии корма скорость набухания 5,0 мин, при водостойкости 30,0 мин. Анализ питательной ценности экспериментальных комбикормов и количество микроэлементов представлены в табл. 3 и на рис. 3.
Таблица 3
Table 3
Питательная ценность опытного и контрольного комбикормов
Nutritional value of experimental and control compound feed
|
Комбикорм |
Углеводы, % |
Белок, % |
Жир, % |
Энергия, МДж/кг |
|
Контроль |
2,49 |
66,04 |
9,69 |
19,9 |
|
Стартовый |
3,68 |
67,34 |
10,01 |
20,5 |
|
Продукционный |
3,38 |
67,01 |
9,93 |
20,1 |
|
Контроль |
Ca ˃ K ˃ Na ˃ Mg ˃ Fe ˃ Zn ˃ Mn ˃ Cu ˃ Co |
|
Стартовый |
Ca ˃ K ˃ Na ˃ Mg ˃ Fe ˃ Zn ˃ Cu ˃ Mn ˃ Co |
|
Продукционный |
Ca ˃ K ˃ Na ˃ Mg ˃ Fe ˃ Zn ˃ Cu ˃ Mn ˃ Co |
Рис. 3. Расположение микроэлементов в тестируемых кормах
Fig. 3. The location of trace elements in the tested feeds
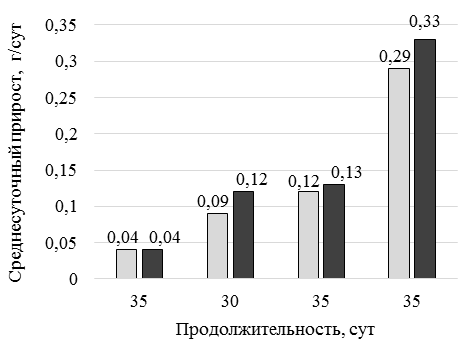
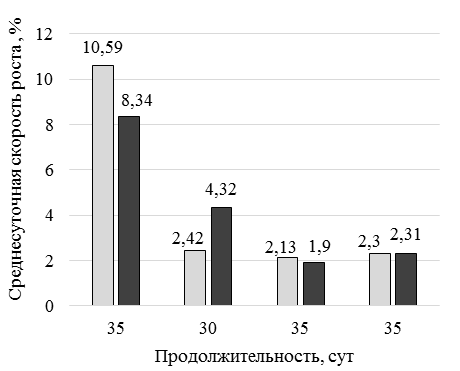
Анализ микроэлементов в тестируемых кормах выявил значительное различие по Cu (см. рис. 3): в опытных вариантах количество Cu составило 99,0–99,2 мг/кг, в контрольном варианте 6,58 мг/кг. На 1 этапе (65 сут) при использовании стартового корма (рис. 4) с кормовой добавкой DREAMFEED® средняя масса возрастала с постоянной скоростью при стабильном повышении абсолютного прироста и среднесуточной скорости роста (рис. 5).
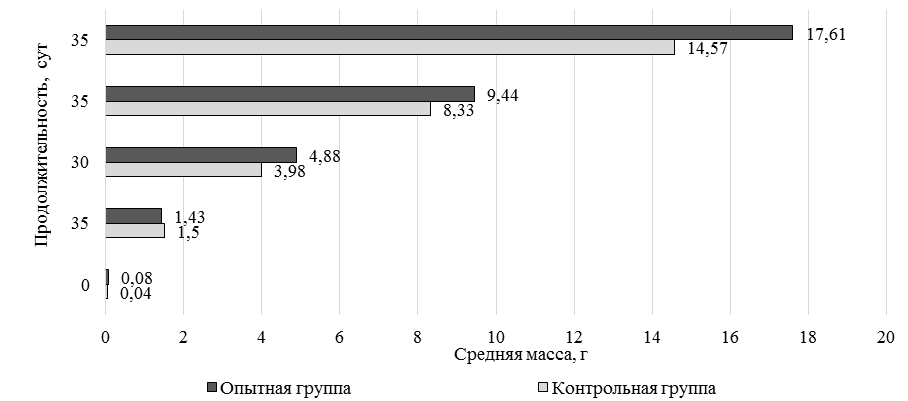
Рис. 4. Динамика средней массы креветки, выращиваемой на кормах с кормовой добавкой DREAMFEED®
Fig. 4. Dynamics of the average weight of shrimp grown on feed with the feed additive DREAMFEED®
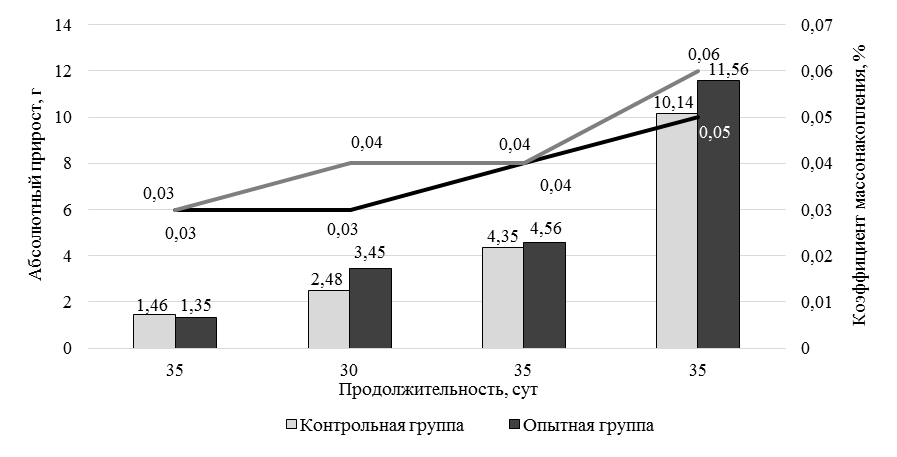
а
Рис. 5. Динамика рыбоводно-биологических показателей креветки в условиях эксперимента:
а – абсолютный прирост и коэффициент массонакопления
Fig. 5. Dynamics of fish-breeding and biological parameters of shrimp under experimental conditions:
a – absolute gain and mass accumulation coefficient
|
|
|
|
б |
в |
Рис. 5 (окончание). Динамика рыбоводно-биологических показателей креветки в условиях эксперимента:
б – среднесуточный прирост; в – среднесуточная скорость роста
Fig. 5 (ending). Dynamics of fish-breeding and biological parameters of shrimp under experimental conditions:
б – average daily increase; в – average daily growth rate
В обоих вариантах исследования отмечается нарастание темпа роста после адаптации к новым условиям выращивания, что выражается в увеличении абсолютного прироста на 2-й месяц исследования. При этом более существенные изменения произошли у опытной группы креветок. При использовании кормовой добавки DREAMFEED® абсолютный прирост в постадаптационный период выращивания был выше на 39,11 %, чем у контрольной группы, а увеличение показателя относительно 1-го месяца выращивания произошло в 2,5 раза. Аналогичная динамика наблюдается для показателя среднесуточного прироста. За первый этап выращивания среднесуточный прирост находился на одном уровне в обоих вариантах исследования. Стабильные условия выращивания и полноценное кормление позволили увеличить этот показатель, что особенно проявилось у креветок опытной группы. Показатель на 33,33 % был выше, чем у креветок контрольной группы за тот же этап. Коэффициент массонакопления находился на одном уровне в обоих вариантах исследования и составлял 0,06 ед. Последний показатель характеризует физиологическую полноценность выращенной пресноводной креветки. На 2-м этапе выращивания использовали продукционные корма с добавлением 15,0 % кормовой добавки DREAMFEED®. Отмечается, что переход на корм с меньшим содержанием тестируемой кормовой добавки (15,0 %) способствовал некоторому сдерживанию интенсивности роста. Разница показателей средней массы опытной и контрольной групп креветок составила 11,7 %. В дальнейшем интенсивность роста возобновилась, разница средних масс составила 17,26 %. Описанная тенденция полностью повторила ситуацию 1-го этапа выращивания и подтвердила, что смена рациона является биогенным фактором, требующим адаптации организма к новым условиям кормления. За весь период исследования рыбоводно-биологические показатели опытной группы несколько превышали показатели контрольной группы. Абсолютный прирост составил 17,53 и 14,53 г у опытной и контрольной групп соответственно. Среднесуточный прирост у опытной группы креветок составил 0,13 г/сут, у особей контрольной группы этот показатель составил 0,11 г/сут. Коэффициент массонакопления в обеих группах был на уровне 0,05 ед. Выживаемость креветок находилась на высоком уровне и за весь период выращивания составила 89,0 % у опытной группы и 82,0 % у контрольной группы. Условия выращивания и технология кормления напрямую оказывают влияние на количество элементов в организме культивируемых гидробионтов. Анализ накопления элементов необходим как для практических целей, так и для понимания формирования микроэлементного состава организмов. Для получения кормовой добавки DREAMFEED® используется минеральная среда, содержащая соли калия, магния, меди, железа, марганца, цинка, и природный газ. При этом присутствие меди и железа необходимо для функционирования ферментов, отвечающих за окисление метана. В результате этого в готовом сухом продукте может содержаться высокое остаточное количество меди – 200–300 мг/кг. Ввиду того, что креветки являются продуктом питания человека, необходимо учитывать накопление в них микроэлементов и оценивать качество выращиваемой продукции. Результаты анализа минерального состава органов и тканей культивируемой креветки представлены в табл. 4.
Таблица 4
Table 4
Количество микроэлементов в тканях и органах гигантской пресноводной креветки, мг/кг
The amount of trace elements in the tissues and organs of giant freshwater shrimp, mg/kg
|
Показатель |
Печень |
Панцирь |
Мышцы |
||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
||
|
Cu |
28,84 ± 0,28 |
2 142,0 ± 14 |
34,57 ± 0,89 |
95,88 ± 0,90 |
17,08 ± 0,57 |
40,47 ± 0,23 |
|
|
Zn |
89,97 ± 0,28 |
83,76 ± 0,75 |
39,26 ± 0,35 |
51,74 ± 0,49 |
49,42 ± 0,33 |
53,55 ± 0,85 |
|
|
Mn |
3,57 ± 0,23 |
4,86 ± 0,16 |
4,29 ± 0,05 |
5,74 ± 0,04 |
1,19 ± 0,01 |
1,31 ± 0,02 |
|
|
K |
6 520 ± 221,0 |
5 049 ± 254 |
6 399 ± 39 |
5 968,0 ± 58,0 |
14 996 ± 150 |
14 867 ± 135 |
|
|
Co |
0,267 ± 0,013 |
0,275 ± 0,015 |
0,100 ± 0,021 |
0,110 ± 0,011 |
0,200 ± 0,008 |
0,117 ± 0,011 |
|
|
Mg |
358,0 ± 33,0 |
580,0 ± 223,0 |
2 033,0 ± 12,0 |
2 086 ± 51 |
511,0 ± 3,0 |
514,0 ± 8,0 |
|
|
Fe |
224,0 ± 21,0 |
157,0 ± 10,0 |
96,5 ± 12,6 |
89,2 ± 0,9 |
114,0 ± 11,0 |
111,0 ± 4,0 |
|
|
Cа |
– |
1 079,0 ± 24,0 |
1 005,0 ± 26,0 |
||||
В табл. 5 представлены особенности микроэлементного состава исследованных образцов.
Таблица 5
Table 5
Расположение микроэлементов в тканях и органах гигантской пресноводной креветки в порядке убывания
The arrangement of trace elements in the tissues and organs of the giant freshwater shrimp in descending order
|
Образец |
Группа |
Порядок микроэлементов |
|
Печень |
Опыт |
K > Cu > Mg > Fe > Zn > Mn > Co |
|
Контроль |
K > Mg ~ Fe > Zn > Cu > Mn > Co |
|
|
Панцирь |
Опыт |
K > Mg > Cu ~ Fe > Zn > Mn > Co |
|
Контроль |
K > Mg > Fe > Zn ~ Cu > Mn > Co |
|
|
Мышцы |
Опыт |
K > Ca > Mg > Fe > Zn ~ Cu >Mn > Co |
|
Контроль |
K > Ca > Mg > Fe > Zn > Cu > Mn > Co |
В условиях эксперимента первое место среди микроэлементов занимает K, который присутствует во всех образцах в количестве, значительно превышающем остальные. Ca определили лишь в образцах мышечной ткани. Количество Mg было закономерно выше (до 2 033–2 086 мг/кг) в образцах панциря; в мышцах и печени количество этого микроэлемента было в 3,5–5,6 раза меньше, чем в образцах панциря. Количество Zn достаточное и соотносится с данными о количестве микроэлементов у промысловых ракообразных в естественной среде обитания. Это свидетельствует о нормальном количестве цинксодержащих ферментов в организмах, которые встречаются во всех классах ферментов. Важнейшим среди них является карбоангидраза, катализирующая обратный процесс гидратации CO2. В условиях эксперимента Fe в основном аккумулируется в печени и мышцах, значения у опытной и контрольной групп рыб не имеют существенных различий. Интересна динамика накопления Cu – важного микроэлемента в процессах тканевого дыхания. В условиях эксперимента наибольшее количество Cu отмечено в печени. У опытной группы креветок показатель в 75 раз выше, чем у креветок контрольной группы, что, вероятно, связано с большим количеством Cu в кормах.
Заключение
В ходе научно-исследовательской работы была проведена замена рыбной муки в стартовом (20,0 %) и продукционном (15,0 %) комбикорме для молоди гигантской пресноводной креветки Розенберга на белковую кормовую добавку DREAMFEED®, представляющую собой концентрат микробного белка Methylococcus capsulatus. В результате проведенных исследований по органолептическим показателям установлено, что исследуемые корма соответствуют требованиям ГОСТ-2014. По результатам анализа рыбоводно-биологических показателей установлено, что рост креветок опытной группы, потреблявшей корм с заменой рыбной муки на кормовую добавку DREAMFEED®, имеет тенденцию к увеличению, что проявляется более высокой скоростью роста. Оценка качества креветок, с точки зрения содержания в них микроэлементов, показала сходство микроэлементного состава мышечной ткани, панциря и печени опытной и контрольной групп креветок. Однако в условиях эксперимента в печени опытных групп креветок зафиксировано наибольшее количество Cu (2 142,0 мг/кг), что связано с большим содержанием этого микроэлемента в кормах.
1. Мирошникова Е. П., Зуева М. С., Аринжанов А. Е., Килякова Ю. В. Современное состояние аквакультуры в России и за рубежом // Актуальные проблемы прикладной биотехнологии и инженерии: сб. материалов Междунар. науч.-практ. конф. Оренбург: Оренбург. гос. ун-т, 2023. С. 180–183.
2. Васильев А. А., Руднева О. Н., Руднев М. Ю., Гуркина О. А., Торопова В. В. Планирование технологических процессов в аквакультуре: учеб. пособие. Саратов, 2022. 135 с.
3. Sahu N. P., Jain K. K., Misra C. K. Effect of extrusion processing and steam pelleting diets on pellet durability, water absorption and physical response of Macrobrachium rosenbergii // Asian-Australian Journal of Animal Science. 2002. V. 15. p. 1354–1357.
4. Sarma А., Sahu N. P. Optimization of plant to animal protein ratio in the post larval diet of Macrobrachium rosenbergii // Indian Journal of Animal Science. 2002. N. 72. Р. 1051–1054.
5. Лагуткина Л. Ю., Лагуткин О. Ю. Аквакультура: приоритеты, ресурсы, технологии // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2010. № 1. С. 69–76.
6. Лагуткина Л. Ю., Пономарев С. В. Создание кормов на основе биомассы растительного и животного планктона прудовых экосистем для объектов тепловодной аквакультуры // Изв. Самар. науч. центра Рос. акад. наук. 2010. № 2. С. 748–753.
7. Лагуткина Л. Ю., Пономарев С. В. Создание кормов на основе биомассы растительного и животного планктона прудовых экосистем для объектов тепловодной аквакультуры // Изв. высш. учеб. завед. Сев.-Кавказ. регион. Сер.: Естественные науки. 2011. № 2. С. 57–61.
8. Лагуткина Л. Ю. Методы отлова и переработки биомассы растительного и животного планктона прудовых экосистем // Вестн. Астрахан. гос. техн. ун-та. Сер.: Рыбное хозяйство. 2012. № 1. С. 66–70.
9. Вилутис О. Е., Васильев А. А., Акчурина И. В., Поддубная И. В., Тарасов П. С. Изучение действия йодсодержащего препарата на продуктивность ленского осетра // Ресурсосберегающие экологически безопасные технологии производства и переработки сельскохозяйственной продукции: материалы IX Междунар. науч.-практ. конф. «Лапшинские чтения». Саранск: Изд-во Мордов. ун-та, 2013. С. 58–61.
10. Ковачева Н. П., Жигин А. В., Борисов Р. Р., Кряхова Н. В., Лебедев Р. О., Паршин-Чудин А. В., Ковачева Н. П. Биология и культивирование гигантской пресноводной креветки Macrobrachium rosenbergii (de Man, 1876). М.: Изд-во ВНИРО, 2015. 111 с.
11. Пономарев С. В., Гамыгин Е. А., Никоноров С. И., Пономарева Е. Н., Грозеску Ю. Н., Бахарева А. А. Технологии выращивания и кормления объектов аквакультуры юга России. Астрахань: Нова плюс, 2002. 264 с.
12. ГОСТ 28497-90 Межгосударственный стандарт. Комбикорма, сырье гранулированные. Методы определения крошимости. М.: Стандартинформ, 2006. 4 с.
13. ГОСТ 10385-2014. Межгосударственный стандарт. комбикорма для рыб. Общие технические условия. М.: Стандартинформ, 2006. 15 с.
14. ГОСТ 28497-2014. Корма, комбикорма. Метод определения крошимости гранул. М.: Стандартинформ, 2006. 7 с.
15. Винберг Г. Г. Интенсивность обмена и пищевые потребности рыб. Минск: Изд-во Белорус. ун-та, 1956. 253 с.
16. Купинский С. В., Баранов С. А., Резников В. Ф. Радужная форель – предварительные параметры стандартной модели массонакопления // Индустриальное рыбоводство в замкнутых системах: сб. науч. тр. М.: ВНИИПРХ, 1985. Вып. 46. С. 109–115.
17. Резников В. Ф., Баранов С. А., Стариков Е. А., Толчинский Г. И. Стандартная модель массонакопления рыбы // Механизация и автоматизация рыбоводства и рыболовства во внутренних водоемах. М.: ВНИИПРХ, 1978. Вып. 22. С. 182–196.
18. Пономарев С. В., Грозеску Ю. Н., Бахарева А. А. Индустриальное рыбоводство: учеб. для вузов. СПб.: Лань, 2013. 448 с.
19. Лакин Г. Ф. Биометрия: учеб. пособие. М.: Высш. шк., 1990. 293 с.