Россия
Россия
Россия
Россия
Оценено влияние различных концентраций (10; 11,1; 15,5; 21; 26,5; 32 %) диметилсульфоксида (ДМСО) в составе криосреды на способность дефростированной спермы белуги утилизировать супероксидный анион-радикал, пероксид водорода и оксид азота, а также на уровень пероксидного окисления липидов спермы. Показано, что во всем исследуемом интервале концентраций ДМСО дефростированная после хранения в жидком азоте в течение 3-х суток сперма белуги сохраняет способность утилизировать супероксидный анион-радикал и пероксид водорода, при этом наблюдается промотирование генерирования оксида азота из нитропруссида натрия, что может свидетельствовать о модулировании активности дефростированной спермы белуги, учитывая разнонаправленное изменение концентраций данных активных метаболитов кислорода в процессе криоконсервации. С повышением концентрации криопротектора супероксид анион-радикал-перехватывающая активность половых клеток возрастает, способность промотировать генерирование оксида азота снижается, пероксид водорода-перехватывающая активность изменяется неоднозначно. Обнаружено промотирование интенсивности пероксидации липидов дефростированной спермы белуги при увеличении концентрации ДМСО в криосреде. Во всех случаях полученные зависимости не являются монотонными, что, предположительно, связано с мультимодальностью данного криоагента. Установлены оптимальные концентрации ДМСО в криозащитной среде, составляющие 15,5 и 26,5 % для стимуляции супероксидной анион-радикал- и пероксид водорода-утилизирующей активности соответственно, а также исходная концентрация ДМСО в криосреде (10 %) для промотирования генерирования оксида азота дефростированной спермой белуги, обеспечивающая наименьший уровень пероксидации липидов спермы рыб.
сперма белуги, криоконсервация, диметилсульфоксид, супероксидный анион-радикал, пероксид водорода, оксид азота, пероксидное окисление липидов
Введение
Значительный потенциал для восстановления популяций осетровых рыб, сохранения их генофонда имеет криоконсервация спермы [1]. Однако известно, что репродуктивные клетки самцов осетровых обладают низкой криорезистентностью [2]. Успех криоконсервации во многом определяется составом криозащитной среды, подбором криопротектора и его оптимальной концентрации [3]. Известным, широко используемым протектором при криоконсервации спермы рыб, в том числе осетровых, является диметилсульфоксид (ДМСО) [4]. Данное соединение относится к проникающим криопротекторам, которые обеспечивают внутриклеточную защиту. Связывая молекулы воды посредством образования водородных связей, ДМСО препятствует оттоку воды из цитоплазмы во время замораживания, при кристаллизации обеспечивает образование малотравматичной для клеток структуры [5]. Тем не менее известно и о цитотоксическом действии ДМСО [6], в том числе на сперматозоиды осетровых [7].
Исследование механизма токсичности данного соединения показало, что ДМСО способен влиять на липид-липидные и липид-белковые взаимодействия [6], дестабилизировать мембрану репродуктивных клеток [8], вызывать денатурацию белков [9]. Для снижения токсического действия ДМСО необходимо подобрать его оптимальную концентрацию, при которой криопротектор будет проявлять криозащитные свойства при минимальном повреждающем действии на сперму рыб. На данный момент литературные данные об оптимальной концентрации ДМСО при криосохранении сперматозоидов осетровых крайне противоречивы [10–13], кроме того, в проведенных исследованиях изучали влияние различных концентраций ДМСО только на подвижность и фертильность половых клеток, не выявляя повреждение сперматозоидов рыб на молекулярном уровне. Насколько нам известно, не проводились исследования по влиянию различных концентраций ДМСО в составе криосреды на функционирование системы антиоксидантной защиты репродуктивных клеток в условиях криоконсервации. Между тем криорезистентность спермы рыб во многом зависит от способности клеток противостоять окислительным повреждениям, учитывая высокий риск развития окислительного стресса в репродуктивных клетках из-за гиперпродукции активных форм кислорода (АФК) при криоконсервации [14]. Также важно учитывать, что реальная концентрация ДМСО в криозащитной среде может увеличиваться при использовании данного соединения в качестве растворителя антиоксидантов, внесение которых в базовые криозащитные среды в последнее время становится рутинной процедурой [15].
Целью данной работы является определение влияния различных концентраций ДМСО (10; 11,1; 15,5; 21; 26,5; 32 %) в составе криосреды на утилизирующую активность дефростированной спермы белуги (Huso huso Linnaeus, 1758) в отношении таких АФК, как супероксидный анион-радикал (О2–•), пероксид водорода (Н2О2) и оксид азота (NO), а также уровень пероксидного окисления липидов (ПОЛ).
Материалы и методы
Реагенты и растворы. В работе использовались коммерчески доступные реагенты (Sigma-Aldrich, США) без дополнительной очистки. В состав базовой криосреды входили следующие компоненты:
10 % яичного желтка, 10 % ДМСО, 5 ммоль/л KCl, 130 ммоль/л NaCl, 20 ммоль/л NaHCO3 и 5,5 ммоль/л глюкозы [16]. Для работы были использованы микропланшетный спектрофотометр FlexA-200HT (Китай) и центрифуга с охлаждением GTR116C (Китай).
Сбор спермы. Объектом исследования являлась сперма белуги (Huso huso Linnaeus, 1758), полученная в середине мая 2024 г. от 3-х самцов 18–24 лет. Самцам белуги вводили однократную инъекцию LH-RHa (лютеинизирующий гормон – рилизинг-гормон этиламид). Сперму, собранную прижизненно с использованием катетера, охлаждали (8 ± 2 ºС) и доставляли в лабораторию в термоконтейнере. Все протоколы исследований выполнялись в соответствии с рекомендациями Комиссии по биоэтике Федерального государственного бюджетного учреждения науки «Федеральный исследовательский центр Южный научный центр Российской академии наук» (Протокол № 1 от 14 февраля 2025 г.). Согласно заключению данной комиссии проведенные экспериментальные исследования соответствуют принципам биоэтики и правилам использования животных в научных целях.
Общая процедура замораживания и размораживания спермы. Криоконсервацию спермы белуги проводили по методу Л. И. Цветковой [17]. Сперму в количестве 500 мкл смешивали в соотношении 1 : 1 с криосредой и полученную смесь распределяли по пробиркам Эппендорфа объемом 1,5 мл. Пробирки Эппендорфа со смесью помещали для уравновешивания в холодильник (Т = 4 °С) на 20 мин, затем переносили в криозамораживатель PLANER (UK), постепенно охлаждая от 5 до –70 °С со скоростью 20–25 °С/мин (время замораживания около 3 мин). После этого этапа проводилась глубокая заморозка в жидком азоте в течение 3 суток. Температуру измеряли электронным термометром. Дефростацию (размораживание) проб спермы проводили с использованием водяной бани в течение 30–40 с при температуре 38–40 °С.
Оценка способности дефростированной спермы белуги утилизировать O2–•. Способность дефростированной спермы белуги утилизировать О2–• определяли спектральным методом при 347 нм в модельной системе окисления адреналина в щелочной среде [18] по скорости образования промежуточного продукта окисления адреналина – адренолютина [19]. В ячейки 96-луночного планшета вносили 180 мкл бикарбонатного буфера, 10 мкл спермы и 10 мкл раствора адреналина с концентрацией 0,1 % (5,46 ммоль/л), планшет помещали в спектрофотометр, измеряли величину оптической плотности в течение 10 мин. Контрольная проба содержала все компоненты, кроме раствора адреналина.
Снижение скорости окисления адреналина в присутствии супернатанта, содержащего сперматозоиды, свидетельствует о O2–•-утилизирующей активности спермы белуги, которую рассчитывали относительно контроля (%), где за 100 % принимали уровень адренолютина в щелочном бикарбонатном буфере без добавления спермы. Все эксперименты проводились в трекратной повторности. O2–•-ути-
лизирующую активность (I, %,) рассчитывали по формуле
I = (1 − Ai / A0) · 100,
где Ai – оптическая плотность в пробе с добавлением спермы; A0 – оптическая плотность в контроле (без спермы).
Оценка способности спермы белуги утилизировать Н2О2. Предварительно готовили смесь, содержащую 1 мл дефростированной спермы белуги и 7 мл фосфатного буфера (рН 7,4). Далее полученную смесь центрифугировали в течение 10 мин (3 500 об/мин) и собирали надосадочную жидкость. В 96-луночный планшет помещали 100 мкл раствора H2O2 в фосфатном буфере (30 ммоль/л) и 100 мкл надосадочной жидкости в фосфатном буфере. Контрольный образец вместо супернатанта содержал 100 мкл фосфатного буфера. Концентрацию H2O2 определяли спектральным методом при 240 нм по скорости расходования Н2О2 [20]. Величину оптической плотности измеряли в течение 10 мин. Для каждой концентрации ДМСО было проведено по 3 параллельных независимых измерения. Исходя из полученных данных были построены кинетические кривые расходования H2O2, которые были линеаризованы в координатах уравнения первого порядка. По тангенсу угла наклона полученных прямых были рассчитаны константы скорости реакции разложения H2O2. Повышение скорости разложения H2O2 в присутствии супернатанта, содержащего сперматозоиды, свидетельствует об их утилизирующей активности в отношении данной АФК.
Определение активности дефростированной спермы белуги в отношении оксида азота NO. NO-утилизирующую активность спермы белуги определяли спектральным методом по ингибированию генерирования данной АФК из нитропруссида натрия в водном растворе при физиологическом значении pH 7,4. При взаимодействии NO с растворенным кислородом образуются нитрит-ионы, концентрацию которых определяли по поглощению продукта реакции нитрит-ионов с реактивом Грисса (растворы 0,33 % сульфаниловой кислоты и 0,1 % N-(1-нафтил)этилендиамина в 20 %-й ледяной уксусной кислоте, в соотношении 1 : 1) – азокрасителя алого цвета с максимальным поглощением при длине волны 548 нм [21]. В лунках планшета смешивали 50 мкл дефростированной спермы белуги с нитропруссидом Na (50 мкл, 5 ммоль/л) в фосфатном буфере при pH 7,4 (0,2 ммоль/л) и инкубировали при комнатной температуре на свету в течение 150 мин. Контрольный образец содержал 50 мкл ДМСО. К инкубируемому образцу добавляли 100 мкл реактива Грисса. Значения поглощения холостого опыта и образцов измеряли при 548 нм в течение 30 мин с интервалом 1 мин.
Определение уровня пероксидного окисления липидов в дефростированной сперме белуги. Определение уровня ПОЛ в дефростированной сперме белуги проводили по стандартной методике [22] спектрофотометрическим методом при длине волны 532 нм путем измерения концентрации вторичных карбонильных продуктов ПОЛ, образующих окрашенный комплекс с тиобарбитуровой кислотой (ТБК-АП). Охлажденную сперму рыб в объеме 25 мкл добавляли к 2 000 мкл 1,2 % охлажденного до 0–4 °С раствора KCl. Предварительно было показано отсутствие влияния ДМСО на уровень ПОЛ относительно контроля без добавок. Полученную смесь вместе с растворами аскорбиновой кислоты (100 мкл, 2,6 ммоль/л), соли Мора (100 мкл, 0,04 ммоль/л), трихлоруксусной кислоты (1 000 мкл, 40 %) разливали в полипропиленовые пробирки и помещали в термостатируемую (37 °С) водяную баню на 10 мин, после этого центрифугировали (3 000 об/мин) в течение 10 мин. Супернатант(2 000 мкл) отбирали в чистые пробирки и добавляли 1 000 мкл раствора ТБК (0,8 %). Далее пробирки помещали в кипящую водяную баню на 10 мин. После охлаждения до комнатной температуры к образцам добавляли хлороформ (1 000 мкл) до получения прозрачного раствора и центрифугировали (3 000 об/мин) в течение 15 мин. Отбирали прозрачный супернатант и измеряли оптическую плотность образца на спектрофотометре. Уровень ТБК-АП рассчитывали по формуле
ТБК-АП = (А · 3,0 · 3,2) / (0,156 · 2,0),
где А – оптическая плотность образцов; 3,0 – объем пробы, мл; 3,2 – общий объем исследованных проб, мл; 0,156 – экстинкция 1 нмоль ТБК-АП в 1 мл при 532 нм; содержание ТБК-АП в липидах спермы белуги выражали в наномолях на мл; 2,0 – объем супернатанта, взятого для определения ТБК-АП, мл.
Статистический анализ. С использованием программного обеспечения Statistica для Windows, версия 9.0 (StatSoft, Inc.) проведен статистический анализ полученных результатов, которые были представлены как среднее значение ±SD. Статистическая достоверность различий была установлена на уровне p < 0,05.
Результаты исследования
Влияние различных концентраций ДМСО в составе криозащитной среды на АФК-утилизирующую активность дефростированной спермы белуги. Результаты исследования влияния различных концентраций ДМСО в составе базовой криосреды на способность дефростированной спермы белуги утилизировать О2–•, H2O2 и NO представлены на рис. 1 и в табл.

Рис. 1. Влияние различных концентраций ДМСО в составе криосреды
на О2–•-утилизирующую активность дефростированной спермы белуги
Fig. 1. The effect of different concentrations of DMSO in the cryomedium
on the O2–• -recycling activity of defrosted beluga sperm
Влияние различных концентраций ДМСО
на H2O2–, NO-утилизирующую активность дефростированной спермы белуги
The effect of different concentrations of DMSO
on the H2O2–, NO-recycling activity of defrosted beluga sperm
|
Концентрация ДМСО, % |
АФК-утилизирующая активность |
|
|
NO, % ингибирования |
H2O2, k* · 105, с–1 |
|
|
10,0 |
–62,05 ± 9,91 |
6 |
|
11,1 |
–43,78 ± 2,88 |
4 |
|
15,5 |
–51,38 ± 1,67 |
6 |
|
21,0 |
–54,28 ± 7,86 |
6 |
|
26,5 |
–53,47 ± 8,46 |
8 |
|
32,0 |
–53,22 ± 1,99 |
6 |
* k – константа скорости утилизации Н2О2.
Показано, что при всех исследуемых концентрациях ДМСО в составе криозащитной среды дефростированная после хранения в жидком азоте в течение 3 суток сперма белуги обладает способностью утилизировать О2–• и Н2О2, причем при повышении концентрации криопротектора О2–•-перехватывающая активность половых клеток возрастает. Однако данная зависимость не является монотонной, что проявляется в наличии выраженного максимума при концентрации криопротектора 15,5 % (см. рис. 1).
Влияние различных концентраций ДМСО на способность дефростированной спермы белуги утилизировать Н2О2 неоднозначно (см. табл.): данная активность спермы белуги различается только при двух концентрациях криопротектора – 11,1 и 26,5 %, при концентрации ДМСО 26,5 % она в 2 раза превышает аналогичную активность при концентрации 11,1 %. При остальных концентрациях криопротектора способность спермы утилизировать Н2О2 одинаковая – константа скорости составляет 6 · 10–5 с–1.
Согласно полученным в работе данным при инкубировании дефростированной спермы белуги с нитропруссидом натрия – прекурсором NO – наблюдается промотирование образования данной азотсодержащей АФК на 40–60 %. Зависимость промотирующей активности дефростированной спермы белуги от концентрации ДМСО не является монотонной, что проявляется в наличии одного минимума при концентрации криопротектора 11,1 % (см. табл.). Наибольшее промотирование наблюдается при концентрации ДМСО 10 %. В интервале концентраций 11,1–21 % промотирующая активность криопротектора возрастает, далее до 32 % – остается неизменной.
Таким образом, установлена немонотонная зависимость активностей дефростированной спермы белуги в отношении О2–•, H2O2 и NO от концентрации ДМСО в составе криосреды. Оптимальная концентрация ДМСО, при которой наблюдается наибольшая способность утилизировать О2–• и H2O2, составляет 15,5 и 26,5 % соответственно. При этом наибольшее промотирование генерирования NO отмечено при исходной концентрации криопротектора в используемой криосреде (10 %).
Влияние различных концентраций ДМСО на интенсивность пероксидации липидов спермы белуги. Установлено незначительное повышение уровня вторичных карбонильных продуктов ПОЛ
в дефростированной сперме белуги на 5,2–11,5 % при добавлении ДМСО в интервале концентраций (11,1–32 %) по сравнению с дефростированной спермой рыб при использовании базовой криосреды с концентрацией ДМСО 10 % (рис. 2).
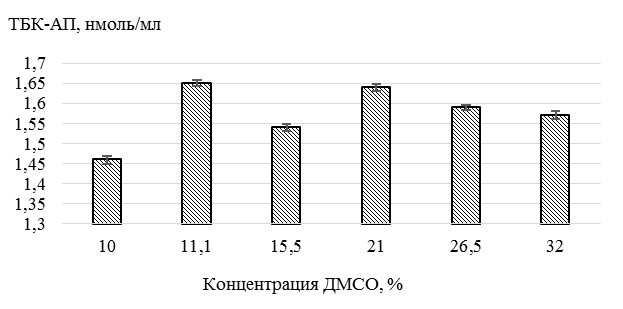
Рис. 2. Влияние различных концентраций ДМСО
в составе криосреды на уровень ПОЛ дефростированной спермы белуги
Fig. 2. The effect of different concentrations of DMSO
in the cryomedium on the LPO level of polystrosted beluga sperm
Согласно полученным данным зависимость уровня ПОЛ дефростированной спермы белуги от концентрации ДМСО в составе криосреды также является немонотонной, что проявляется в наличии двух выраженных максимумов, при концентрациях 11,1 и 21 %. При этом в интервале концентраций криопротектора 21–32 % наблюдается постепенное снижение его промотирующей активности. Наименьшая интенсивность процесса ПОЛ наблюдается в дефростированной сперме белуги, при криоконсервации которой использовали криосреду, содержащую 10 % ДМСО.
Обсуждение
Известно, что такие характеристики сперматозоидов, как малый размер, высокое отношение площади поверхности к объему и высокая проницаемость для воды, влияющие на вязкость и температуру стеклования внутриклеточного цитозоля, обуславливают меньшую восприимчивость репродуктивных клеток самцов рыб к холодовому шоку во время криоконсервации по сравнению с другими типами клеток [23]. Однако из-за высокой концентрации полиненасыщенных жирных кислот в их мембранах [24], ограниченной антиоксидантной защиты вследствие малого содержания цитоплазмы в зрелых сперматозоидах они уязвимы к окислительному стрессу. К тому же, в отличие от соматических клеток, сперматозоиды не могут эффективно восстанавливать свою ДНК, что делает их крайне восприимчивыми к окислительному повреждению. Указанные факторы обуславливают актуальность исследования влияния возрастающих концентраций ДМСО в составе используемой криозащитной среды на антиоксидантный статус сперматозоидов, учитывая уникальные свойства данного проникающего протектора, способного быстро входить в клетки и связываться с биомолекулами [25], проявлять как антиоксидантную [26], так и прооксидантную активность [27].
На сегодняшний день ДМСО, коммерчески доступный побочный продукт бумажной промышленности, широко используется в качестве растворителя или сорастворителя различных гидрофобных органических соединений [28], в том числе соединений, обладающих антиоксидантной активностью. Внесение антиоксидантов в базовые криозащитные среды в виде растворов в ДМСО представляет собой проблему, поскольку при этом возрастает концентрация данного криозащитного агента, что ведет к повышению его токсичности.
Развитие окислительного стресса при криоконсервации может быть обусловлено как гиперпродукцией АФК на стадиях замораживания и оттаивания [29], а также на стадии уравновешивания, необходимой для проникновения криопротектора в клетки [30], так и неспособностью системы антиоксидантной защиты клетки их утилизировать. В данной работе оценено влияние шести концентраций ДМСО (10; 11,1; 15,5; 21; 26,5; 32 %) в составе базовой криосреды на активность дефростированной спермы белуги в отношении биогенных метаболитов кислорода О2–•, H2O2 и NO, которые постоянно образуются в сперме рыб [31–33] и при физиологических концентрациях выполняют сигнальную функцию [34, 35], но в высоких концентрациях оказывают токсическое действие. Так, с использованием модельной системы ксантин/ксантиноксидаза, генерирующей О2–• и H2O2 [36], установлено снижение подвижности дефростированной спермы стерляди (Acipenser ruthenus, Linnaeus, 1758), возрастание фрагментации ДНК и повышение активности антиоксидантных ферментов спермы рыб: супероксиддисмутазы (СОД), катализирующей диспропорционирование О2–• в Н2О2, и О2, а также глутатионредуктазы, ускоряющей реакцию образования важного антиоксиданта – восстановленной формы глутатиона; повышение уровня ПОЛ и интенсификация окисления белков спермы [37]. Особенно важную роль в физиологии спермы рыб играет NO, оказывая влияние на подвижность спермы и ее способность к оплодотворению [31, 38, 39].
Нами установлено стимулирование способности дефростированной спермы белуги утилизировать О2–• при повышении концентрации ДМСО в криосреде, что согласуется с литературными данными
о возрастании ингибирования стимулированной продукции данной АФК лейкоцитами и различными клетками, выделенными из крови человека (нейтрофилы, эозинофилы, лимфоциты и моноциты) при повышении концентрации ДМСО (2; 4; 6; 8; 10 % (по объему)) [40]. В отличие от нашего исследования, в котором наблюдается немонотонная зависимость О2–•-перехватывающей активности половых клеток рыб от концентрации криозащитного агента, в приведенном литературном источнике для всех клеток установленные зависимости были монотонными, за исключением моноцитов при относительно низкой стимуляции продукции О2–•. Супероксид-перехватывающая активность дефростированной спермы белуги, по-видимому, связана в основном с активностью фермента СОД, который является основным антиоксидантным ферментом, ответственным за утилизацию О2–•. Стимулирование ДМСО способности дефростированной спермы белуги утилизировать О2–• и Н2О2 (см. табл.) может быть обусловлено антирадикальной активностью данного криопротектора в отношении О2–• [41] и способностью ДМСО повышать активность антиоксидантных ферментов [42].
Известно, что в ходе криоконсервации спермы рыб изменяется концентрация АФК, при этом концентрация О2–• и Н2О2, как и в сперме млекопитающих [43, 44], повышается. Так, недавно сообща-
лось [14] об увеличении при криоконсервации спермы сибирского осетра процента «АФК-положительных (АФК+) сперматозоидов», т. е. репродуктивных клеток, в которых наблюдается развитие окислительного стресса вследствие повышения концентрации О2–•. При этом в качестве положительного контроля (100 % АФК+-клеток) выступали сперматозоиды, инкубированные при 37 °C в течение 30 мин в 3 % H2O2. Повышение концентрации О2–• в дефростированной сперме рыб, инкубированной с H2O2, может быть связано с ингибированием H2O2 фермента СОД [45]. В отличие от О2–•, H2O2, являясь нейтральной молекулой, легко проникает через клеточную мембрану, поэтому данный вид АФК может быть очень токсичным для клетки, вызывая повреждение ДНК и потерю фертильности [46].
В работе установлена способность ДМСО промотировать генерирование NO из нитропруссида натрия. В сперме рыб, как и в сперме млекопитающих, обнаружены ферменты, ускоряющие реакцию биосинтеза NO из протеиногенной аминокислоты L-аргинина – семейство изоферментов NO-синтаз (NOS) [47]. В отличие от спермы млекопитающих, концентрация NO в сперматозоидах рыб при криоконсервации, по-видимому, снижается. Так, значительное снижение уровня NO было обнаружено в сперме Heteropneustes fossilis (Bloch.) после низкотемпературного замораживания (–196 °С) в течение 48 ч [38]. Согласно полученным в работе результатам, в присутствии ДМСО наблюдается модулирование уровня АФК при криоконсервации спермы белуги – снижение для О2–• и Н2О2, концентрация которых повышается в процессе криосохранения, повышение для NO, уровень которого снижается при замораживании. Наибольшее повышение способности спермы рыб утилизировать О2–• и Н2О2 установлено при концентрациях 15,5 и 26,5 % ДМСО соответственно. Наибольшее промотирование генерирования NO отмечено при концентрации 10 % ДМСО.
Как уже упоминалось выше, высокое содержание полиненасыщенных жирных кислот, которые являются субстратом для реакций свободнорадикального окисления [48], обуславливает особую чувствительность сперматозоидов осетровых к окислительному повреждению. В нашей работе установлено незначительное промотирование ПОЛ дефростированной спермы белуги при повышении концентрации криопротектора (см. табл.) по сравнению с уровнем ПОЛ в присутствии криосреды с концентрацией ДМСО 10 %. В ранее проведенном исследовании со спермой африканского сома (Clarias gariepinus Burchell, 1822) уровень ТБК-АП в присутствии ДМСО также повышался при увеличении концентрации ДМСО с 3 до 10 % [49].
Согласно литературным данным, с повышением
концентрации ДМСО (2,5; 5; 10 %) улучшается защита плазматической мембраны спермы полосатого окуня (Morone saxatilis) при криоконсервации [50], однако снижается функция митохондрий. В нашей работе снижение уровня накопления вторичных карбонильных продуктов ПОЛ в дефростированной сперме белуги наблюдается в интервале концентраций 21–32 % ДМСО. Способность ДМСО снижать интенсивность ПОЛ спермы может быть обусловлена его антирадикальной активностью в отношении наиболее активной формы АФК – гидроксильного радикала [26].
Таким образом, зависимость интенсивности процесса ПОЛ от концентрации ДМСО, как и зависимость активности спермы белуги в отношении О2–•, H2O2 и NO, является немонотонной. Данный факт может быть связан со способностью соединения оказывать влияние на различные этапы и звенья окислительного стресса в дефростированной сперме рыб.
Заключение
Изучено влияние различных концентраций криопротектора ДМСО в составе криосреды на активности дефростированной спермы белуги после низкотемпературного замораживания (–196 °С)
в течение 3-х суток в отношении О2–•, Н2О2- и NO, а также на уровень пероксидации липидов. Установлено, что с возрастанием концентрации криопротектора повышается способность спермиев утилизировать О2–•, промотировать генерирование оксида азота из нитропруссида натрия и незначительно – уровень ПОЛ, при этом Н2О2-перехватывающая активность изменяется неоднозначно. Для каждого вида активности дефростированной спермы белуги установлены оптимальные концентрации ДМСО в составе криосреды. Для стимуляции О2–•- и Н2О2-утилизирующей активности спермы белуги оптимальные концентрации составляют 15,5 и 26,5 % соответственно; для промотирования генерирования NO и снижения уровня пероксидации липидов спермы оптимальной концентрацией является исходная концентрация криопротектора в криосреде – 10 %. Установленная немонотонная зависимость данных активностей от концентрации криопротектора, предположительно, может быть обусловлена мультимодальностью данного соединения, что указывает на необходимость проведения дальнейших исследований по оптимизации протоколов криоконсервации с использованием ДМСО в качестве основного криопротекторного компонента.
1. Докина О. Б., Ковалев К. В., Пронина Н. Д. Криоконсервация спермы осетрообразных рыб: современное состояние и перспективы // Рыбное хозяйство. 2024. № 2. С. 110–122. https://doi.org/10.36038/0131-6184-2024-2-110-122.
2. Kolyada M. N., Osipova V. P., Pimenov Yu. T. Oxidative stress and cryoresistance of sturgeon sperm: a review // Cryobiology. 2023. V. 113. P. 104594. https://doi.org/10.1016/.cryobiol.2023.104594.
3. Cabrita Е., Sarasquete C., Martinez-Paramo S., Robles V., Beirao J., Perez-Cerezales S., Herraez M. P. Cryopreservation of fish sperm: applications and perspectives // J. Appl. Ichthyol. 2010. V. 26. Р. 623–635. https://doi.org/10.1111/j.1439-0426.2010.01556.x.
4. Cherepanov V. V., Kopeika E. F. Cryopreservation and low temperature storage of sturgeon sperm // J. Appl. Ichthyol. 1999. V. 15 (4-5). P. 310–311.
5. Sieme H., Oldenhof H., Wolkers W. F. Mode of action of cryoprotectants for sperm preservation // Anim. Reprod. Sci. 2016. N. 169. P. 2–5. ttps://doi.org/10.1016/j.anireprosci.2016.02.004.
6. Fahy G. M., Lilley T. H., Linsdell H., Douglas M. S. J., Maryman H. T. Cryoprotectant toxicity and cryoprotectant toxicity reduction: in search of molecular mechanisms // Cryobiology. 1990. V. 27. P. 247–268. https://doi.org/https://doi.org/10.1016/0011-2240(90)90025-y.
7. Psenicka M., Dietrich G. J., Wojtczak M., Nynca J., Rodina M., Linhart O., Cosson J., Ciereszko A. Acrosome staining and motility characteristics of sterlet spermatozoa after cryopreservation with use of methanol and DMSO // Cryobiology. 2008. V. 56 (3). P. 251–253. https://doi.org/10.1016/j.cryobiol.2008.03.006.
8. Gurtovenko A. A., Anwar J. Modulating the structure and properties of cell membranes: the molecular mechanism of action of dimethyl sulfoxide // J. Phys. Chem. B. 2007. V. 111 (35). P. 10453–10460. https://doi.org/https://doi.org/10.1021/jp073113.
9. Arakawa T., Carpenter J. F., Kita Y. A., Crowe J. H. The basis for toxicity of certain cryoprotectants: A hypothesis // Cryobiology. 1990. V. 27. P. 401–415. https://doi.org/10.1016/0011-2240(90)90017-X.
10. Красильникова А. А., Тихомиров А. М. Корреляция объемов внутриклеточной жидкости сперматозоидов и эндоцеллюлярного протектора в криозащитных средах для осетровых // Естественные науки. Астрахань: Изд. дом «Астраханский университет», 2015. № 3 (52). С. 96–102.
11. Пономарева Е. Н., Красильникова А. А., Тихомиров А. М., Фирсова А. В. Новые биотехнологические методы криоконсервации репродуктивных клеток осетровых видов рыб // Юг России: экология, развитие. 2016. Т. 11. № 1. С. 59–68.
12. Sadeghi A., Imanpoor M. R., Taghizadeh V., Shaluei F. Cryopreservation of beluga (Huso huso) sperm: Effect of different concentrations of DMSO and dilution rates on sperm mobility and motility duration after short-term storage // Global Veterinaria. 2013. V. 10. P. 46–50. https://doi.org/https://doi.org/10.5829/idosi.gv.2013.10.1.66229.
13. Пономарева E. Н., Богатырева M. M., Антонова Н. A., Осипова В. П. Оптимизация процесса криоконсервации спермы осетровых рыб при использовании различных сред // Изв. Самар. науч. центра РАН. 2009. Т. 11. С. 132–134.
14. Kodzik N., Ciereszko A., Judycka S., Słowińska М., Szczepkowska B., Świderska B., Dietrich M. A. Cryoprotectant-specific alterations in the proteome of Siberian sturgeon spermatozoa induced by cryopreservation // Sci. Rep. 2024. V. 14. P. 17707. https://doi.org/10.1038/s41598-024-68395-7.
15. Sandoval-Vargas L., Silva Jiménez M., Risopatrón González J., Villalobos E. F., Cabrita E., Valdebenito Isler I. Oxidative stress and use of antioxidants in fish semen cryopreservation // Reviews in Aquaculture. 2020. P. 1–23. https://doi.org/10.1111/raq.12479.
16. Пономарева E. Н., Богатырева M. M., Антонова Н. A., Осипова В. П. Оптимизация процесса криоконсервации спермы осетровых рыб при использовании различных сред // Изв. Самар. науч. центра РАН. 2009. Т. 11. С. 132–134.
17. Цветкова Л. И., Пронина Н. Д., Докина О. Б., Ре-кубратский А. В., Парнышков В. А. Формирование низкотемпературного генного банка спермы рыб (состояние, развитие, перспективы) // Вопр. рыболовства. 2012. Т. 13 (3-51). С. 538–545.
18. Сирота Т. В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы // Вопр. мед. химии. 1999. Т. 45. № 3. С. 263–272.
19. Volkov V., Lobanov A., Voronkov M., Baygildiev T., Misin V., Tsivileva O. Kinetics and Mechanism of Epinephrine Autoxidation in the Presence of Plant Superoxide Inhibitors: A New Look at the Methodology of Using a Model System in Biological and Chemical Research // Antioxidants. 2023. V. 12. P. 1530. https://doi.org/https://doi.org/10.3390/antiox12081530.
20. Aebi H. Catalase in vitro // Methods in enzymology. 1984. V. 105. P. 121–126.
21. Sadeer N. B., Montesano D., Albrizio S., Zengin G., Mahomoodally M. F. The Versatility of Antioxidant Assays in Food Science and Safety–Chemistry, Applications, Strengths, and Limitations // Antioxidants. 2020. V. 9. P. 709. https://doi.org/10.3390/antiox9080709.
22. Строев Е. А., Макарова В. Г., Матвеева И. В. Практикум по биологической химии: учеб. пособие. М.: ООО Изд-во «Медицинское информационное агентство», 2012. 351 c.
23. Tsai S., Lin C. Advantages and applications of cryopreservation in fisheries science // Braz. Arch. Biol. Technol. 2012. V. 55. P. 425–433. htts://doi:org/10.1590/S151689132012000300014.
24. Ghomi M. R., Nikoo M., Pourshamsian K. Omega-6/omega-3 essential fatty acid ratio in cultured beluga sturgeon // Comp. Clin. Pathol. 2012. V. 21. P. 479–483. Https://doi.org/10.1007/s00580-012-1495-5.
25. Kharasch N., Thyagarajan B. S. Structural basis for biological activities of dimethyl sulfoxide // Ann. N. Y. Acad. Sci. 1983. V. 411. P. 391–402.
26. Bektasoglu B., Celik S. E., Özyërk M., Güklü K., Apak R. Novel hydroxyl radical scavenging antioxidant activity assay for water-soluble antioxidants using a modi-fied CUPRAC method // Biochem. Biophys. Res. Commun. 2006. V. 345. P. 1194−1200. https://doi.org/10.1016/j.bbrc.2006.05.038.
27. Sanmartín-Suárez C., Soto-Otero R., Sánchez-Sellero I., Méndez-Álvarez E. Antioxidant properties of dimethyl sulfoxide and its viability as a solvent in the evaluation of neuroprotective antioxidants // J. Pharmacol. Toxicol. Methods. 2011. V. 63 (2). P. 209–215. https://doi.org/10.1016/j.vascn.2010.10.004.
28. Shulyak A. V., Goydyk V. S., Gusakovsky S. S., Grygorenko V. N., Mytsik Y. O., Badiuk N. S. Archives Modern aspects of the use of dimethyl sulfoxide (DMSO) // Pharmacologyonline. 2021. V. 1. P. 82–89.
29. Li P., Li Z. H., Dzyuba B., Hulak M., Rodina M., Linhart O. Evaluating the impacts of osmotic and oxidative stress on common carp (Cyprinus carpio, L.) sperm caused by cryopreservation techniques // Biol. Reprod. 2010. V. 83. P. 852–858. https://doi.org/https://doi.org/10.1095/biolreprod.110.085852.
30. Judycka S., Słowi´nska M., Nynca J., Liszewska E., Dobosz S., Ciereszko A. Oxidative stress in cryopreserved semen of sex-reversed female and normal male rainbow trout // Aquaculture. 2020. V. 528 (6). P. 735531. https://doi.org/10.1016/j.aquaculture.2020.735531.
31. Wilson-Leedy J. G., Ingermann R. L. Production of nitric oxide by sperm of the steelhead (Oncorhynchus mykiss) and its actions on motility and respiration // Theri-ogenology. 2011. V. 75 (1). P. 144–154. https://doi.org/10.1016/j.theriogenology.2010.07.020.
32. Rivlin J., Mendel J., Rubinstein S., Etkovitz N., Breitbart H. Role of Hydrogen Peroxide in Sperm Capacitation and Acrosome Reaction // Biol. Reprod. 2004. V. 70. P. 518–522. https://doi.org/10.1095/biolreprod.103.020487.
33. Valcarce D. G., Robles V. Effect of captivity and cryopreservation on ROS production in Solea senegalensis spermatozoa // Reproduction. 2016. V. 152 (5). P. 439–446. https://doi.org/10.1530/REP-16-0270.
34. Ray P. D., Huang B.-W., Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling // Cell. Signal. 2012. V. 24. P. 981–990. https://doi.org/10.1016/j.cellsig.2012.01.008.
35. Morita M., Nakajima A., Takemura A., Okuno M. Involvement of redox- and phosphorylation-dependent pathways in osmotic adaptation in sperm cells of euryhaline tilapia // J. Exp. Biol. 2011. V. 214. P. 2096–2104. https://doi.org/10.1242/jeb.053405.
36. Gulcin İ. Antioxidants and antioxidant methods: an updated overview // Arch. Toxicol. 2020. V. 94. P. 651–715. https://doi.org/10.1007/s00204-020-02689-3.
37. Shaliutina-Koleˇsová A., Cosson J., Lebeda I., Gazo I., Shaliutina O., Dzyuba B., Linhart O. The influence of cryoprotectants on sturgeon (Acipenser ruthenus) sperm quality, DNA integrity, antioxidant responses, and resistance to oxidative stress // Anim. Reprod. Sci. 2015. V. 159 (6). P. 66–76. http://dx.doi.org/10.1016/j.anireprosci.2015.05.014.
38. Barman A. S., Kumar P., Mariahabib, Lal K. K, Lal B. Role of nitric oxide in motility and fertilizing ability of sperm of Heteropneustes fossilis (Bloch.) // Anim. Reprod. Sci. 2013. V. 137 (1-2). P. 119–127. https://doi.org/10.1016/j.anireprosci.2012.12.001.
39. Creech M. M., Arnold E. V., Boyle B., Muzinich M. C., Montville C., Bohle D. S., Atherton R. W. Sperm motility enhancement by nitric oxide produced by the oocytes of fathead minnows, Pimephelas promelas // J. Androl. 1998. V. 19. P. 667–674.
40. Kahler C. P. Evaluation of the Use of the Solvent Dimethyl Sulfoxide in Chemiluminescent Studies // Blood Cells Mol. Dis. 2000. V. 26 (6). P. 626–633. https://doi.org/10.1006/bcmd.2000.0340.
41. Herscu-Kluska R., Masarwa A., Saphier M., Cohen H., Meyerstein D. Mechanism of the reaction of radicals with peroxides and dimethyl sulfoxide in aqueous solution // Chem. Eur. J. 2008. V. 14. P. 5880−5889. https://doi.org/10.1002/chem.200800218.
42. Hossen S., Sukhan Z. P., Cho Y., Lee W. K., Kho K. H. Antioxidant Activity and Oxidative Stress-Oriented Apoptosis Pathway in Saccharides Supplemented Cryopreserved Sperm of Pacific Abalone, Haliotis discus hannai // Antioxidants (Basel). 2022. V. 11. P. 1303. https://doi.org/10.3390/antiox11071303.
43. Aitken R. J., Jones K. T., Robertson S. A. Reactive oxygen species and sperm function – in sickness and in health // J. Androl. 2012. V. 33. P. 1096–1106. https://doi.org/10.2164/jandrol.112.016535.
44. Evangelista-Vargas S., Santiani A. Detection of intracellular reactive oxygen species (superoxide anion and hydrogen peroxide) and lipid peroxidation during cryopreservation of alpaca spermatozoa // Reprod. Domest. Anim. 2017. V. 52 (5). P. 819–824. https://doi.org/10.1111/rda.12984.
45. Bray R. C., Cockle S. A., Fielden E. M., Roberts P. B., Rotilio G., Calabrese L. Reduction and inactivation of superoxide dismutase by hydrogen peroxide // Biochem. J. 1974. V. 139 (1). P. 43–48. https://doi.org/https://doi.org/10.1042/bj1390043.
46. Sadeghi S., Pertusa J., Yaniz J. L., Nuñez J., Soler C., Silvestre M. A. Effect of different oxidative stress degrees generated by hydrogen peroxide on motility and DNA fragmentation of zebrafish (Danio rerio) spermatozoa // Reprod. Domest. Anim. 2018. V. 53 (6). P. 1498–1505. https://doi.org/10.1111/rda.13296.
47. Zhang W., Chen S. J., Guo L. Y., Zhang Z., Zhang J. B., Wang X. M., Meng X. B., Zhang M. Y., Zhang K. K., Chen L. L., Li Y. W., Wen Y., Wang L., Hu J. H., Bai Y. Y., Zhang X. J. Nitric oxide synthase and its function in animal reproduction: an update // Front. Physiol. 2023. V. 14. P. 1288669. https://doi.org/10.3389/fphys.2023.1288669.
48. Kowalski R. K., Cejko B. I. Sperm quality in fish: Determinants and affecting factors // Theriogenology. 2019. V. 135. P. 94–108. https://doi.org/10.1016/j.theriogenology.2019.06.009.
49. Firsova A. V., Polovinkina M. A., Osipova V. P., Ponomareva E. N. Optimization of the cryoprotector composition for the preservation of African catfish reproductive cells // Vestnik of Astrakhan State Technical University. Series: Fishing industry. 2023. N. 3. P. 47–56. https://doi.org/10.24143/2073-5529-2023-3-47-56.
50. He S., Woods L. C. Effects of dimethyl sulfoxide and glycine on cryopreservation induced damage of plasma membranes and mitochondria to striped bass (Morone saxatilis) sperm // Cryobiology. 2004. V. 48 (3). P. 254–262. https://doi.org/10.1016/j.cryobiol.2004.01.009.
















