Россия
Россия
Россия
Научно-технический прогресс в промышленности органического синтеза в значительной степени основывается как на совершенствовании действующих производств, так и на разработке и внедрении новых более эффективных процессов получения углеводородных соединений, удовлетворяющих современным требованиям потребителей. Открытие реакции метатезиса стало значительным событием в химии, поскольку появилась возможность селективно преобразовывать одни олефины в другие большей или меньшей молекулярной массы. Интенсивное исследование возможностей метатезиса сопровождалось не только наработкой серьезных теоретических и практических результатов, но и стимулировало развитие работ в области каталитических реакций различных углеводородов. Кроме того, реакция метатезиса высших олефинов является высокоэффективным механизмом при синтезе различных углеводородов, в т. ч. и таких, которые синтезировать классическими методами весьма проблематично. Проблемы, связанные с разработкой эффективных методов изомеризации и диспропорционирования олефинов, являются актуальными. Ранее проведенный термодинамический расчет позволил значительно сузить область поиска оптимальных условий проведения метатезиса гексена-1, ограничив ее интервалами температуры 110–160 °С и давления 0,7–1,0 МПа. Для выбора оптимальных условий проведения реакции метатезиса гексена-1 проведено исследование зависимости показателей процесса от температуры реакции и массовой скорости по сырью. Влияние температуры на основные показатели процесса жидкофазного метатезиса гексена-1 исследовалось на различных алюмомолибденовых катализаторах. Выбраны оптимальные условия процесса: температура – 120–130 °С, массовая скорость подачи сырья – 4–4,5 ч–1, давление – 0,7–1,0 МПа. При этом суммарная конверсия гексена-1 в олефины составляет около 65 % при селективности, близкой к 70 %.
метатезис, скорость по сырью, катализатор, температура, высшие линейные олефины
Введение
В последние годы в решении проблемы получения высших линейных олефинов наблюдается значительный прогресс, благодаря чему получен мощный импульс для дальнейшего развития и совершенствования в химической и нефтехимической промышленности. Реакция метатезиса высших олефинов является высокоэффективным механизмом при синтезе различных углеводородов, в т. ч. и таких, которые синтезировать классическими методами весьма проблематично [1–6].
По мере развития метатезиса практически каждый год знаменовался значительным событием, расширявшим представления об этой реакции и пополнявшим знания в области гомо- и гетерогенного катализа [5, 7]. В работах [8–13] сообщается о процессе метатезиса при участии различных катализаторов. В статье [8] отмечается, что в реакциях метатезиса олефинов широко используются различные катализаторы, особое место среди которых занимают рутениевые катализаторы типа Ховейда – Граббса.
Авторами статьи [9] указывается, что метатезис углерод-углеродных двойных связей – «перетасовка» составляющих их карбеновых фрагментов – чрезвычайно важный подготовительный инструмент в промышленности и научных кругах.
Метатезис более тяжелых гомологов алкенов ограничен случайными непродуктивными примерами в химии фосфора и перекрестным метатезисом со смешанными более тяжелыми алкинами. Сообщается о термически индуцированном метатезисе специально созданных несимметрично замещенных дигерменов без использования переходных металлов.
Линейные олефины относятся к одним из наиболее употребляемых продуктов, интерес к которым неуклонно возрастает. Особо крупной областью потребления высших олефинов является производство ПАВ различных классов, используемых в качестве действующего начала синтетических моющих средств, присадок к маслам, реагентов для интенсификации нефтедобычи, ингибиторов коррозии и т. д. [14]. В зависимости от целей и областей применения продуктов диспропорционирования может быть рекомендована определенная каталитическая система [15–17].
Выбранные оптимальные условия протекания процесса, результаты исследования кинетических закономерностей могут быть использованы для решения вопросов практической реализации процесса.
Целью работы является исследование зависимости показателей процесса метасинтеза гексена-1 от температуры реакции и массовой скорости по сырью.
Экспериментальная часть
Подготовка сырья
В опытах по метатезису гексена-1 в качестве сырья использовали гексен-1 (или гексан-гексеновую фракцию, выделенную из продуктов термокаталитической олигомеризации этилена в присутствии триэтилалюминия). Гексен-1 предварительно засыпали прокаленным при 350–400 °C гамма-оксидом алюминия примерно на 1/10 часть объема жидкости и оставляли в течение суток. Эту операцию повторяли три раза. После такой очистки анализ сырья на содержание «перекисных» соединений показал отсутствие последних. Гексен-1 (или гексан-гексе-
новую фракцию) и газообразные продукты реакции анализировали с помощью хроматографа ЛХМ-72 на капиллярной колонке. Анализ проводили при температуре 50 °C, используя в качестве газа-носителя азот.
Содержание компонентов в смеси рассчитывалось по площадям пиков S = HB, где H – высота пика; B – ширина пика, измеренная на середине его высоты.
Проведение реакции метатезиса гексена-1 осуществлялось, согласно следующей методике.
Свежеперегнанный гексен-1 загружали под азотом в сырьевую емкость, из которой он забирался насосом и прокачивался через адсорбер, заполненный силикагелем в реактор.
Реактор представляет собой трубку из нержавеющей стали диаметром 40 мм длиной 500 мм, снабженную электрообмоткой, карманом для термопары, на который крепится сетка для поддержания катализаторного слоя. Для уменьшения «мертвого» объема реактор до и после катализаторного слоя заполнялся кварцевой насадкой. Давление в реакторе создавалось дозировочным насосом и регулировалось вентилем тонкой регулировки на выходе из реактора. Расход сырья устанавливался с помощью дозировочной головки насоса. Газообразные продукты реакции собирались в сосуд Мариотта, жидкие продукты – во взвешиваемые приемники.
Приготовление, активация катализатора
Алюмомолибденовый катализатор готовили импрегнированием промышленного оксида алюминия 15 %-м раствором парамолибдата аммония, затем его сушили при 120 °С до воздушно-сухого состояния и прокаливали 5 ч при 480 °С. Активацию полученного катализатора проводили при 580 °С сухим воздухом в течение 1,5 ч, затем сухим обескислороженным азотом при 580 °С в течение 1,5 ч, объемной скорости подачи газов активации 5 000–10 000 ч–1. Далее катализатор охлаждали в токе азота до температуры реакции. После проведения опытов охлаждения до комнатной температуры, промывали гексан-гексеновой (или пентан-пентеновой) фракцией, продували азотом и нагревали в токе азота до 350 °С. Затем постепенно азот заменяли на воздух (во избежание разогрева катализатора) и при температуре 350–450 °С проводили выжиг кокса в течение примерно 30 мин. Далее температура поднималась до 580 °С, и проводилась активация катализатора по вышеописанной методике.
Введение модификаторов в состав катализаторов осуществляли их пропиткой водными растворами соответствующих солей заданной концентрации. В исследовании было использовано два катализатора: алюмомолибденкалиевый и алюмоникельмолибденсиликатный.
Результаты и их обсуждение
Основными параметрами, оказывающими влияние на протекание реакции диспропорционирования, являются температура и время контакта. В установившемся состоянии, когда реакция достигает равновесия, давление не должно оказывать влияние на процесс. С другой стороны, изменение давления воздействует на фазовое равновесие и в конечном итоге может привести к изменению соотношения между образовавшимися продуктами реакции.
Рассмотрим зависимость показателей процесса от температуры реакции. Влияние температуры на основные показатели процесса жидкофазного метатезиса гексена-1 исследовалось в алюмомолибденкалиевом катализаторе в интервале 110–160 °C, в жидкой фазе, массовой скорости по сырью 4–4,5 ч–1. Из таблицы видно, что полученные нами ранее результаты по влиянию температуры на диспропорционирование гексена-1 (P = 0,7 MПa, V = 4,5 ч–1) показали, что максимальная конверсия гексена-1 была получена при температуре 120 °С. Выше этой температуры конверсия падает с 64,9 до 39,3 %. В интервале 130–160 °С изменение температуры не оказывает существенного влияния на этот показатель.
Влияние температуры на диспропорционирование гексена-1
(Р = 0,7 МПа, V = 4,5 ч–1, алюмомолибденкалиевый катализатор)
Effect of temperature on the disproportionation of hexene-1
(P = 0.7 MPa, V = 4.5 h–1, aluminum-molybdenum-potassium catalyst)
|
Температура, °С |
Суммарная |
Селективность |
Выход фракции |
||||||||
|
С2–С5 |
С7 –С10 |
С11–С18 |
|||||||||
|
110 |
11,0 |
70,0 |
3,3 |
7,7 |
– |
||||||
|
120 |
64,9 |
69,9 |
14,3 |
43,9 |
1,5 |
||||||
|
130 |
39,3 |
76,1 |
9,4 |
23.6 |
6,3 |
||||||
|
160 |
41,4 |
41,0 |
24,6 |
13,5 |
3,5 |
||||||
|
Состав полученного продукта, % масс. |
|||||||||||
|
Температура, °С |
С2 |
С3 |
С4 |
С5 |
С7 |
С8 |
С9 |
С10 |
С11–С18 |
||
|
110 |
15,0 |
9,0 |
6,0 |
– |
– |
6,6 |
21,7 |
41, 7 |
– |
||
|
120 |
5,7 |
5,2 |
5,2 |
7,7 |
12,7 |
8,0 |
14,3 |
40, 7 |
2,3 |
||
|
130 |
5,7 |
3,6 |
5,7 |
8,9 |
13,0 |
4,2 |
10,0 |
32,8 |
16,1 |
||
|
140 |
5,2 |
2,8 |
19,8 |
31,6 |
10,4 |
4,2 |
7,1 |
10,4 |
8,5 |
||
Наиболее высокая селективность образования углеводородов С7–С14 приходится на 130 °С. Дальнейший рост температуры приводит к значительному ее падению, и при 160 °С она составляет всего 41 %. При этом увеличивается выход газообразных продуктов С2–С5 на пропущенный гексен-1, что позволяет предположить усиление реакций деструкции. Существенное влияние повышение температуры оказывает на состав полученного продукта.
Концентрация этилена и децена-5 уменьшается с повышением температуры. Суммарная концентрация продуктов кросс-метатезиса гексена-1, а именно пар С3–С9, С4–С8, С5–С7, с ростом температуры увеличивается. Вполне вероятно, что повышение температуры увеличивает скорость изомеризации гексена-1 в позиционные изомеры. Как показали исследования [3], при диспропорционировании смесей углеводородов скорость кросс-метатезиса значительно превышает скорость гомо-метатезиса-олефинов.
Кривые зависимости концентраций продуктов метатезиса гексена-1 от времени при различных температурах представлены на рис. 1, из которого видно, что содержание этилена и децена-5 проходит через максимум.

Риc. 1. Зависимость концентрации продуктов гомо- (сплошная линия) и кросс-метатезиса (пунктирная линия)
гексена-1 от продолжительности реакции при различных температурах
(P = 0,7 МПа, V = 4,5 ч–1, алюмомолибденкалиевый катализатор)
Fig. 1. Dependence of the concentration of gmo products (solid line) and cross-metathesis (dotted line)
of hexene-1 on the duration of the reaction at different temperatures
(P = 0.7 MPa, V = 4.5 h–1, aluminum-molybdenum-potassium catalyst)
При относительно низких температурах (110 °C) он достигается через 1 ч от начала эксперимента, а при более высоких температурах смещается до 30 мин. При температурах 130 и 160 °С содержание продуктов сометатезиса первые 30 мин не меняется, затем начинает линейно расти. При 110 и 120 °С первые 30 мин оно увеличивается, но затем наблюдается снижение. Через 2 ч содержание продуктов стабилизируется.
Этим стабилизированным отрезкам соответствуют также стационарные участки кривых гомо-метатезиса, на которых концентрация С2–С10 составляет 54–55 % при 120 °С и 64–65 % при 110 °С. Это говорит о наличии индукционного периода в работе катализатора, длительность которого увеличивается при снижении температуры реакции.
Известно, что в некоторых каталитических реакциях предварительный катализатор должен претерпеть преобразование с образованием активного катализатора прежде, чем катализатор сможет подействовать.
Таким образом, анализ полученных результатов показывает, что оптимальная температура процесса метатезиса гексена-1 в присутствии алюмомолибденкалиевого катализатора при массовой скорости по сырью 4,5 ч–1 близка к 120 °C.
Влияние температуры на метатезис гексена-1 в присутствии алюмоникельмолиб-денсиликатного катализатора, содержащего 0,5 % оксида калия, определяли в интервале 100–200 °С, давлении 0,7 МПа и массовой скорости по гексену-1 4,5 ч–1.
При сопоставлении данных, приведенных на рис. 2, с результатами изучения влияния температуры на поведение алюмомолибденкалиевого катализатора видно, что характер кривых несколько изменился.

Рис. 2. Зависимость основных показателей процесса от температуры (катализатор АНМС) (Р = 0,7 МПа, V = 4,5 ч–1)
Fig. 2. The dependence of the main process parameters on temperature (ANMS catalyst) (P = 0.7 MPa, V = 4.5 h–1)
При постановке исследования, прежде всего, необходимо было выбрать каталитические системы, которые позволили бы варьировать молекулярно-массовое распределение получаемых продуктов в зависимости от потребности в тех или иных алкенах.
Известно, что с целью повышения активности базовой каталитической системы в ее состав вводят модифицирующие добавки. Именно под влиянием модификаторов одни катализаторы работают лучше других. Так как модификаторы отличаются по своей природе от базовой каталитической системы, они и изменяют характер и соотношение продуктов метатезиса. Кроме того, при промотированном катализаторе может иметь место и синергетический эффект. Следует учитывать и время деактивации катализатора.
Для обоих катализаторов наилучшие показатели были получены при 120 °С. Однако дальнейшее повышение температуры в присутствии катализатора АНМС не вызывает столь резкого падения конверсии, которое наблюдалось для Аl-Мо катализатора. Можно предположить, что дополнительное содержание оксида металла делает его более стойким к температурным воздействиям. Также следует учитывать и время его деактивации.
Выход фракции С7–С10 и селективность их образования значительно снижаются при температурах выше 120 °С.
В интервале температур 120–160 °С примерно вдвое увеличивается образование газообразных углеводородов. Выше 160 °С концентрация «легких» продуктов С2–С5 снижается. Вероятно, снижение показателей выше 160 °С связано с необратимой дезактивацией катализатора.
На рис. 3 показано как изменяется соотношение между выходами продуктов гомо- и кросс-метатезиса при изменении относительного содержания изомеров гексена-1 во фракции С6.
Как видно, уменьшение содержания «внутренних» изомеров гексена при снижении температуры реакции от 200 до 100 °С приводит к увеличению концентрации продуктов гомо-метатезиса. При повышении температуры, наоборот, растет относительное содержание продуктов кросс-метатезиса.
Можно предположить, что с ростом температуры скорости реакции изомеризации и сометатезиса изомеров гексена растут быстрее, чем скорость гомо-метатезиса гексена-1.
Таким образом, проведенные исследования показали, что оптимальная температура реакции метатезиса гексена-1 как в присутствии алюмомолибденкалиевого, так и в присутствии алюмоникельмолибденсиликатного катализатора близка к 120 °С. Однако катализатор АНМС обладает большей термической стабильностью. Поэтому в промышленности процесс целесообразнее проводить в присутствии алюмоникельмолибденсиликатного катализатора.

Рис. 3. Зависимость основных показателей процесса от температуры (катализатор АНМС):
1 – массовое отношение концентрации гексена-1 к его изомерам;
2 – массовое отношение концентрации продуктов кросс-метатезиса к гомо-метатезису (P = 0,7 МПа, V = 4,5 ч–1)
Fig. 3. The dependence of the main process parameters on temperature (ANMS catalyst):
1 – is the mass ratio of hexene-1 concentration to its isomers;
2 – is the mass ratio of the concentration of cross-metathesis products to homo-metathesis (P = 0.7 MPa, V = 4.5 h–1)
Рассмотрим зависимость показателей процесса метатезиса гексена-1 от массовой скорости по сырью. Влияние массовой скорости на диспропорционирование гексена-1 изучалось в интервале 2,5–8 ч–1 при температуре 120 °С и давлении 0,7 МПа в присутствии алюмомолибденкалиевого катализатора.
При исследовании влияния массовой скорости на диспропорционирование гексена-1 показано, что в изученных условиях (Р = 0,7 МПа, T = 120 °C) оптимальные скорости близки к 4,5 ч–1.
Из таблицы видно, что в этих условиях конверсия составила 64,9 % при селективности образования углеводородов C7–С10 – 69,9 %.
Повышение массовой скорости подачи сырья и, соответственно, уменьшение времени контакта привело к снижению суммарной конверсии, селективность же практически не изменилась. Наоборот, уменьшение массовой скорости привело к росту селективности по С7–С18.
Обращает на себя внимание резкое падение конверсии гексена-1 при уменьшении массовой скорости подачи сырья от 3,5 до 2,5 ч–1. До настоящего времени не найдено удовлетворительного объяснения такой аномалии в поведении катализаторов метатезиса. По-видимому, это связано с явлениями массопереноса.
Образование углеводородов выше С11 наблюдалось при массовой скорости 4,5 ч–1, выше и ниже этого значения указанные углеводороды не были обнаружены в продуктах реакции.
Вероятно, при низких массовых скоростях протекают вторичные реакции диспропорционирования C11+ с легкими углеводородами с образованием С7–С10. При больших же массовых скоростях время контакта оказывается недостаточным для протекания вторичных реакций. Концентрация деценов во фракции С7–С10 растет с увеличением массовой скорости подачи гексена-1, достигая 60 % при
V = 4,5 ч–1, а затем снижается до 47 % при 8 ч–1.
Для наглядности и легкого сравнения полученных результатов показана зависимость концентрации продуктов метатезиса гексена-1 от продолжительности процесса при массовых скоростях подачи сырья в пределах 2,5–8 ч–1. Зависимость концентрации продуктов от продолжительности реакции при различных массовых скоростях показана на рис. 4.
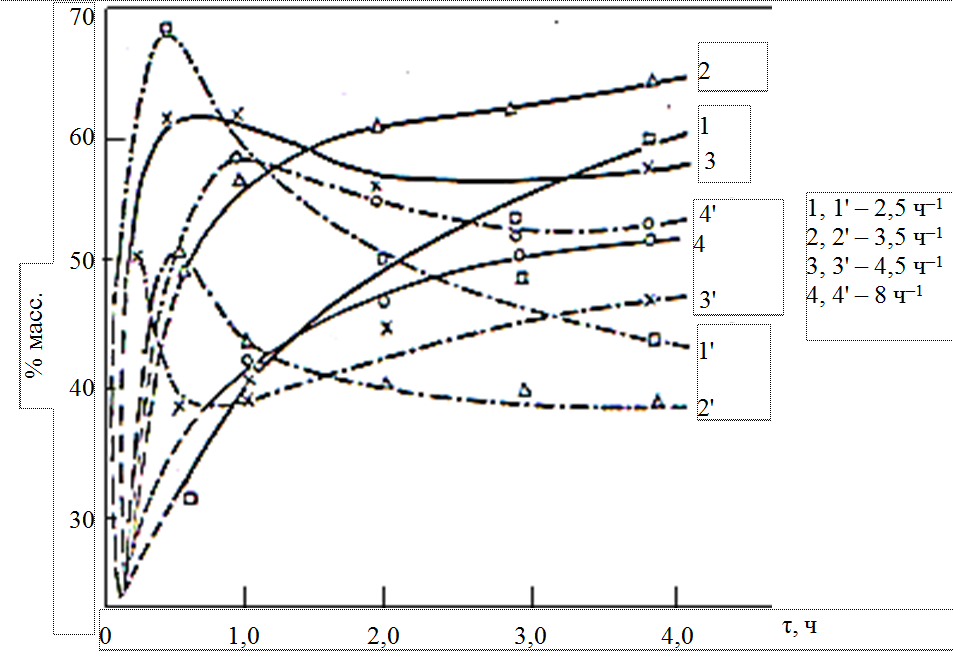
Рис. 4. Зависимость концентрации продуктов гомо- (сплошная линия)
и кросс-метатезиса (пунктирная линия) гексена-1 от продолжительности реакции
при различных массовых скоростях (Р = 0,7 МПа, Т = 120 °С, алюмомолибденкалиевый катализатор)
Fig. 4. Dependence of the concentration of gmo products (solid line)
and cross-metathesis (dotted line) of hexene-1 on the reaction duration
at various mass rates (P = 0.7 MPa, T = 120 °C, aluminum-molybdenum-potassium catalyst)
Как видно из рис. 4, при массовой скорости 2,5–3,5 и 8 ч–1 концентрация продуктов гомо-метатезиса плавно растет с увеличением длительности работы алюмомолибденкалиевого катализатора. Через 30 мин после начала опыта при 120 °С концентрации продуктов гомо-метатезиса достигает своего максимального значения.
Изменение концентрации продуктов сометатезиса гексена-1 с его изомерами также проходит через максимум при 30 мин (массовые скорости – 2,5–3,5 ч–1).
При уменьшении времени контакта (увеличение массовой скорости до 8 ч–1) максимум концентрации продуктов кросс-метатезиса достигается через 1 ч. При массовой скорости 4,5 ч–1 точка смещается к 15 мин, а через 2 ч от начала работы катализатора концентрация продуктов как гомо-, так и кросс-метатезиса стабилизируется.
Следует отметить, что в статье основное внимание уделено изучению зависимости показателей процесса от температуры реакции и массовой скорости подачи сырья. Выбор оптимальных условий определен лишь на основе результатов эксперимента (а не на основе математической модели), т. е. исследована зависимость показателей процесса от температуры реакции и массовой скорости по сырью. Следовательно, оптимальными условиями процесса являются: температура – 120–130 °С, массовая скорость подачи сырья – 4–4,5 ч–1, давление – 0,7–1,0 МПа.
Заключение
Исследована зависимость показателей процесса метасинтеза гексена-1 от температуры реакции и массовой скорости по сырью. Выявлено влияние основных технологических факторов на показатели процесса получения высших линейных олефинов метатезисом гексена-1 в присутствии алюмомолибденкалиевого и алюмоникельмолибденсиликатного катализаторов.
Проведенные исследования показали, что оптимальная температура реакции метатезиса гексена как в присутствии алюмомолибденкалиевого, так и в присутствии алюмоникельмолибденсиликатного катализатора близка к 120 °С. Выбраны оптимальные условия процесса: температура – 120–130 °С, массовая скорость подачи сырья – 4–4,5 ч–1, давление – 0,7–1,0 МПа. При этом суммарная конверсия гексена-1 в олефины составляет около 65 % при селективности, близкой к 70 %.
1. Харлампии Х. Э., Черкунов Э. В., Пласкунов Т. К. Ефанова Э. А. Лаптев Т. Ю. Синтез и применение продуктов на основе высших олефинов // Рос. хим. журн. 2009. Т. 53, № 2. С. 142–150.
2. Кашковский В. М., Григорьев А. А. Метатезис олефинов прошлое, настоящее, будущее // Катализ и нефтехимия. 2006. № 14. С. 1–10.
3. Engelhard J., Golvaseer J., Hall W. L. A trace study of the metathesis of simple olefins over molybdenum – aluminscatalists // Journal of Catalysis. 1981. Vol. 70, N. 2. P. 364–374.
4. Финкельштейн Е. Ш., Грингольц М. Л. Олефиновый метатезис и родственные реакции в синтезе новых полимерных материалов // Высокомолекулярные соединения. Сер. С. 2019. T. 61, № 1. С. 3.
5. Rouhi А. М. Olefin metathesis: the early days // Chemical and Engineering News. 2002. Vol. 80, N. 51. P. 34–38.
6. Rouhi А. М. Olefin metathesis: big-deal reaction // Chemical and Engineering News. 2002. Vol. 80, N. 51. P. 29–33.
7. Moll J. C. Industrial application of olefin metathesis // Journal of Molecular Catalysis A: Chemical. 2004. Vol. 213. P. 39–45.
8. Кумадин П. А., Полянский К. Б., Антонов А. С., Алексеев К. А., Зубков Ф. И. Синтез стабильных, высокоэффективных рутениевых катализаторов реакции метатезиса олефинов с координационными связами N-Ru в шестичленном цикле // Актуальные вопросы органической химии и биотехнологии: материалы очных докл. международ. науч. конф. (Екатеринбург, 18–21 ноября 2020 г.). Екатеринбург: АМБ, 2020. С. 226–228.
9. Klemmer L., Thommes A., Zimmer M., Scheschewitz D. Metathesis of Ge=Ge double bonds // Nature Chemistry. 2021. Vol. 13 (4). P. 373–377.
10. Такебаяши С., Айрон М., Мильштейн Д. Катализируемая железом метатезисная полимеризация олефинов с раскрытием кольцо и механические исследования // Природ. катализ. 2022. № 5. С. 194–502.
11. Бабаев Р. К. Исследование кинетики и механизма реакции метатезиса изобутилена в паровой фазе в присутствии промышленного кремневольфрамового катализатора // Universum: технические науки. 2017. № 11 (44). URL: http://7universum.com/ru/tech/archive/item/5268 (дата обращения: 23.04.2023).
12. Derun Hua, Zheng Zhou, Qianqian Hua, Jian Li, Xinning Lu, Yongrong Xie, Hong Xiao, Mei Li, Jin Yang. Transformation of 2-Butene into Propene on WО3/MCM-48: Metathesis and Isomerization of n-Butene // Catalysts. 2018. Vol. 5 (12). Р. 585. https://doi.Org/l0.3390/cata18120585.
13. Otroshchenko T., Zhang Q., Kondratenko E. V. Room-Temperature Metathesis of Ethylene with 2-Butene to Propene Over MoOx-Based Catalysts: Mixed Oxides as Perspective Support Materials // Catalysis Letters. 2022. Vol. 152. P. 2366–2374.
14. Mol J. C. Application of olefin metathesis on oleo chemistry: an example of green chemistry // Green Chemistry. 2002. Vol. 4. P. 5–13.
15. Брейтер Ю. Л., Жовнер Т. П., Пелина С. В. Исследование эффективности катализаторов при производстве пропилена методом метатезиса // Нефтепереработка и нефтехимия. 2008. № 7. С. 31–33.
16. Лоренгель В. С., Брейтер Ю. Л. Анализ состояния разработок катализаторов по получению мономеров методом метатезиса // Международ. журн. эксперимент. образования. 2010. № 8. С. 150–153.
17. Быков В. И., Беляев Б. А., Бутенко Т. А., Финкельштейн Е. Ш. Каталитические системы метатезиса олефинов на основе галогенидов молибдена и крем-нийорганических соединений // Нефтехимия. 2016. Т. 56, № 2. С. 140–143.










