Russian Federation
Russian Federation
Russian Federation
Russian Federation
from 01.01.2020 to 01.01.2023
Russian Federation
The effect of grape seed extract (GSE), containing 95% proanthocyanidins, on the physiological state of sterlet grown in conditions of closed water supply system is investigated. Additionally, the changes in the antioxidant activity of compound feed with the introduction of GSE (in dry and water-dissolved) after 1, 3 and 24 hours are analyzed. It is established that the greatest total amount of water-soluble antioxidants (TAWSA) is observed in the Russian compound feed with introduction of water solution of GSE (95% proanthocyanidins). The introduction of 50 mg of GSE per 1 kg of compound feed for 63 days promotes changes in the biochemical parameters of blood and organs of the experimental sterlet group. The total amount of water-soluble antioxidants in the liver increases by 25% (p < 0.05) compared to the control group. There is a tendency to increase the level of total protein (0.05 ≤ p ≤ 0.1), increase in albumin level by 36.47% (p ≤ 0.01) and the alkaline phosphatase enzyme activity by 25.45% (p ≤ 0.01) in serum. There is also a significant decrease in glucose levels in the experimental group of 60.22% (p < 0.01). There are no differences in the chemical and mineral composition of meat (p ≥ 0.1). It is assumed that in sterlet of the experimental group metabolism is intensified and oxidative processes in the liver are reduced. It is proposed to use GSE containing 95% proanthocyanidins in a dosage of 50 mg/kg as an additive in compound feed for juvenile sterlet to prevent oxidative stress and stimulate metabolic processes in the body.
sterlet, sturgeon, grape seed extract, proanthocyanidins, antioxidant
Введение
Стерлядь Acipenser ruthenus является высокоценным объектом аквакультуры, мясо и икра стерляди отличаются питательностью и своими органолептическими свойствами. К лимитирующим факторам, которые поспособствовали сокращению данного представителя осетровых, относятся интенсивный и незаконный вылов, загрязнение рек сельскохозяйственными, промышленными и бытовыми стоками, перекрытие рек плотинами ГЭС [1, 2].
Разведение рыб в условиях установок замкнутого водоснабжения (УЗВ) является перспективным методом сохранения и разведения ценных пород осетровых. Установка замкнутого водоснабжения представляет собой закрытую систему, которая легко контролируется. Однако она имеет ряд недостатков, связанных с изолированным характером системы. Изолированность системы приводит к ограничению движения рыбы, применению не свойственных рыбе кормов, органическому загрязнению воды, перепадам концентрации кислорода (известно, что стерлядь весьма чувствительна к загрязнению воды и содержанию в ней кислорода). Также рыба подвергается воздействию различных рыбоводных манипуляций, что может вызывать стресс [2–4].
Постоянное воздействие стресс-факторов может привести к истощению организма и окислительному стрессу, широко распространенному в животноводстве и аквакультуре [5]. Окислительный стресс – это состояние, при котором возникает дисбаланс между выработкой и инактивацией активных форм кислорода в организме. Их избыток запускает самоподдерживающиеся цепные реакции, вызывающие окислительные повреждения некоторых молекул, разрывы нитей ДНК и повреждения структуры белков. Также избыток активных форм кислорода вызывает перекисное окисление липидов клеточных мембран. В совокупности стресс может привести к ослаблению общей резистентности организма рыбы, что на практике выражается в высокой подверженности рыб заболеваниям, снижении темпов роста и репродуктивного потенциала [4, 6–8].
Кроме того, в осетроводстве становится все более важным использование новых профилактических подходов для улучшения врожденной защиты рыб и устойчивости к болезням, т. к. использование ветеринарных препаратов в аквакультуре имеет ряд побочных эффектов, а в некоторых случаях и ограниченную эффективность. Альтернативными решениями являются использование натуральных продуктов, например растительных экстрактов, поскольку они обладают широким спектром полезных свойств и являются экологически чистой продукцией [4, 9, 10].
Виноград Vitis vinifera занимает ведущую позицию среди популярных плодовых культур. Ежегодно производится примерно 75 млн т винограда [11]. При производстве вина остается большое количество отходов в виде виноградной кожуры и косточек, которые содержат полифенолы и имеют потенциал для экономической переработки и использования [12, 13].
Виноградные косточки представляют собой сложную матрицу, содержащую примерно 40 % клетчатки, 16 % масла, 11 % белков и 7 % сложных фенолов, включая танины (гидролизуемые и конденсированные), в дополнение к сахарам, минеральным солям и другим веществам [14]. Экстракт виноградной косточки (ЭВК) содержит фенольные соединения в концентрациях, доля которых составляет от 50 до 90 % экстракта. Основными фенольными соединениями являются проантоцианидины, их мономеры и сложные эфиры галловой кислоты. Косточки Vitis vinifera содержат преимущественно проантоцианидины В-типа со степенью полимеризации 2–12, состоящие из мономеров катехина и эпикатехина. Биологическая активность проантоцианидинов обусловлена наличием фенольной группы, и от числа этих групп зависят физико-химические свойства данного соединения. Проантоцианидины способны связывать белки, образовывать комплексы с металлами, обладают антиоксидантной активностью [15–17].
По большей части проантоцианидины ЭВК известны своими антиоксидантными свойствами. Они способны эффективно инактивировать гидроксил-радикал и супероксид-анион, защищая организм от окислительного стресса, молекулярных и клеточных повреждений [16, 18]. Антиоксидантная активность ЭВК зависит от различных факторов, таких как химический состав экстракта и условия нагревания, включая температуру и время [17, 19]. В исследовании in vitro, посвященном изучению антиоксидантных свойств комбикормов для осетровых рыб, было установлено, что добавление в корм водного раствора ЭВК (95 % проантоцианидинов) повышает антиоксидантную активность комбикорма на 42,13 % [20].
Известно, что ЭВК может оказывать противовоспалительный, противоаллергический, противомикробный и иммуномодулирующий эффекты [16, 21]. В последние годы наблюдается растущий интерес к потенциальному использованию ЭВК у гидробионтов [22]. Существует ряд работ, где оценивается влияние экстракта на рыб. Например, у радужной форели Oncorhynchus mykiss улучшались параметры роста, а гистологическое исследование кожи рыб показало более высокую толщину эпидермиса [23]; повышалась экспрессия генов, связанных с антиоксидантными ферментами [11]. Кормление экстрактом обыкновенного карпа Cyprinus carpio улучшило показатели роста, иммунные реакции, устойчивость к заболеваниям, которые вызваны Aeromonas hydrophila [24]. Результаты другого исследования показали, что включение ЭВК в разных дозах в рацион карпа оказывало положительное воздействие на показатели роста, уровни биохимических показателей сыворотки крови, содержание белка в филе и антиоксидантную способность печени [25]. Показатели роста золотых рыбок Carassius auratus были улучшены при добавлении в рацион экстракта виноградной косточки, что было связано с повышением активности антиоксидантных ферментов в печени, увеличением активности лизоцима слизистых оболочек кожи и общего содержания белка в слизистых оболочках кожи [22]. Проантоцианидины виноградной косточки в рационе гибридного осетра (Acipenser baerii ♀ × A. schrenckii ♂), помимо увеличения роста, повысили неспецифический иммунитет, антиоксидантную активность, активность пищеварительных ферментов, улучшились биохимические показатели печени и разнообразие кишечной микробиоты [9].
Экстракт виноградной косточки является перспективным натуральным продуктом, который может использоваться для улучшения здоровья осетровых рыб в УЗВ, в том числе стерляди. Таким образом, цель работы – изучить действие ЭВК, содержащего 95 % проантоцианидинов, на физиологическое состояние стерляди в условиях УЗВ и оп-ределить изменения суммарного количества водорастворимых антиоксидантов в комбикорме при добавлении ЭВК с течением времени.
Материалы и методы
Исследования по изучению влияния ЭВК (95 % проантоцианидинов на физиологическое состояние стерляди были проведены в контролируемых условиях (УЗВ) на базе Федерального исследовательского центра животноводства – ВИЖ имени академика Л. К. Эрнста.
Годовики стерляди (n = 136) были распределены на две группы по 68 особей в каждой. Продолжительность опыта составила 63 дня. Согласно схеме опыта (табл. 1) контрольная группа получала полнорационный комбикорм для осетровых рыб российского производства, а опытной группе в состав полнорационного комбикорма добавляли 50 мг/кг ЭВК; отбор проб проводили по окончании опыта в утреннее время в каждой группе (N = 10, n = 5).
Таблица 1
Table 1
Схема проведения исследований
Research scheme
|
Группа |
Количество особей |
Условия кормления |
|
Контрольная |
68 |
Полнорационный комбикорм (ПК) |
|
Опытная |
68 |
ПК + 50 мг/кг/кк ЭВК (95 % проантоцианидинов) |
Осетровые рыбы обеих групп содержались в одинаковых условиях. Температурный режим составлял 21–22 ºС, кислородный 10–11 мг/л.
Биохимические исследования сыворотки крови проводили в отделе физиологии и биохимии сельскохозяйственных животных на автоматическом биохимическом анализаторе Erba Mannheim auto-
matic XL-640 (Lachema s.r.o., Чехия) с определением:
– аланинаминотрансферазы (АЛТ) УФ-кинетическим методом без пиридоксальфосфата, IFCC;
– аспартатаминотрансферазы (АСТ) УФ-кинетическим методом без пиридоксальфосфата, IFCC;
– щелочной фосфатазы (ЩФ) – IFCC АМ буфер;
– общего белка биуретовым методом;
– альбумина – методом БКЗ;
– креатинина – кинетическим методом Яффе;
– билирубина – количественное определение методом Walters и Gerarde.
Лабораторное исследование химического и минерального состава мяса проводилось в лаборатории химико-аналитических исследований в животноводстве. Образцы высушивали при температуре 60–70 °С до постоянной массы и определяли первоначальную влагу; для определения гигроскопической – при 100–105 °С (ГОСТ Р 54951–2012; ГОСТ 31640–2012). В пробах образцов в воздушно-сухом состоянии определяли содержание сырой золы сжиганием навески в муфельной печи при температуре 600–700 °С (ГОСТ 32933–2014); общего азота – методом Къельдаля (ГОСТ 13496.4–2019); содержание сырого протеина – путем умножения процентного содержания азота на коэффициент 6,25; сырого жира – экстрагированием серным эфиром в аппарате Сокслета по методу С. В. Рушковского (ГОСТ 32905–2014); сырой клетчатки – кипячением в слабых растворах кислот и щелочей по методу Геннеберга и Штомана (ГОСТ 31675–2012); безазотистых экстрактивных веществ – расчетным путем, по разности между количеством органического вещества и содержанием в нем сырых протеина, жира, клетчатки, золы и гигровлаги; кальция – комплексным методом, кипячением в растворе соляной кислоты и дальнейшим титрованием раствора трилоном Б (ГОСТ 32904–2014); фосфора – колориметрическим методом (по Фиске – Суббороу) (ГОСТ Р 51420–99).
Антиоксидантную активность печени, сердца и мышц оценивали путем измерения суммарного количества водорастворимых антиоксидантов (СКВА) амперометрическим методом с помощью прибора ЦветЯуза-01-АА в диапазоне от 0,2 до 4 000 мг галловой кислоты. Массовую концентрацию водорастворимых антиоксидантов вычисляли по градуировочной кривой зависимости выходного сигнала от концентрации галловой кислоты.
В лаборатории фундаментальных основ питания сельскохозяйственных животных и рыб был поставлен эксперимент, направленный на изучение влияния ЭВК (95 % проантоцианидинов) на антиоксидантную активность комбикорма, с целью определить оптимальный метод введения ЭВК в комбикорм и отследить динамику его антиоксидантных свойств с течением времени. В ходе эксперимента ЭВК в двух формах – сухой и водный раствор – добавляли в комбикорм в количестве 50 мг/кг комбикорма. Далее комбикорм с ЭВК выдерживали в дистиллированной воде в течение 1, 3 и 24 ч. Затем воду фильтровали и измеряли СКВА в полученном растворе.
Полученные в опыте данные обработаны биометрически посредством программ STATISTICA (version 12) и Microsoft Excel 2019. Вычисление уровня значимости (р) проводилось с помощью U-критерия Манна – Уитни. Результаты исследований считали достоверными при р < 0,01 и р < 0,05; при р < 0,1 до р > 0,05 – тенденция к достоверности полученных данных; при р > 0,1 разницу считали недостоверной.
Результаты и обсуждение
Данные о содержании СКВА в опытных образцах комбикорма (через 1, 3 и 24 ч) представлены на рис. 1.
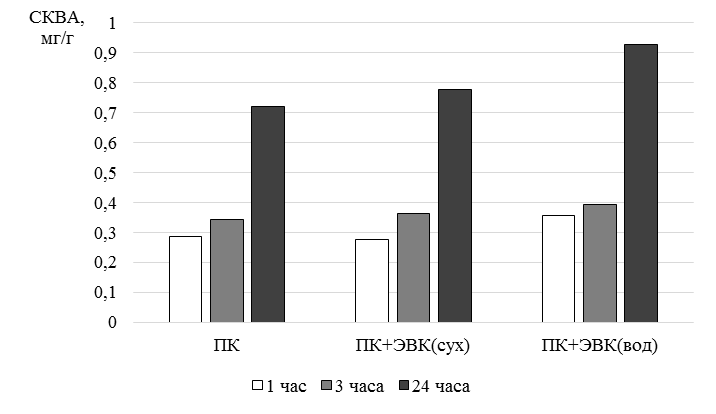
Рис. 1. СКВА в образцах
Fig. 1. TAWSA in samples
Наибольшее количество водорастворимых антиоксидантов во всех временных точках (1, 3 и 24 ч) было зарегистрировано в комбикорме с добавлением водного ЭВК (ПК + ЭВКвод): 0,356, 0,394 и 0,928 мг/г соответственно. Эти значения на 0,08, 0,03 и 0,15 мг/г выше, чем при использовании сухого экстракта (ПК + ЭВКсух). Более высокая антиоксидантная активность при водном нанесении экстракта на комбикорм может быть объяснена более равномерным распределением раствора ЭВК по всей поверхности гранул. Следует отметить, что удержание водорастворимых антиоксидантов было выше в первые 3 часа по сравнению с последующим периодом. С течением времени комбикорм набухает, что приводит к повышению растворимости и отдаче водорастворимых антиоксидантов во внешнюю среду.
Дополнительный ввод 95 % проантоцианидинов из ЭВК способствовал повышению СКВА в российском комбикорме для осетровых рыб.
Влияние применения 95 % проантоцианидинов ЭВК на СКВА на различные ткани стерляди представлено на рис. 2.

Рис. 2. СКВА органов стерляди (Median, n = 5): *p ≤ 0,05
Fig. 2. TAWSA in sterlet organs (Median, n = 5): *p ≤ 0.05
Количество антиоксидантов в печени увеличивалось у опытной группы на 25 % в сравнении с контрольной (р ≤ 0,05).
Полимерные танины виноградных косточек снижают перекисное окисление так же эффективно, как витамин Е [2]. Печень метаболизирует различные соединения, которые могут образовывать свободные радикалы, повреждающие клетки печени. Антиоксиданты способны их нейтрализовать, поддерживая окислительно-восстановительный баланс в печени [26, 27].
Физиологическое состояние рыб можно определить по показателям крови, поскольку это лабильная ткань, которая быстро реагирует на изменения окружающей среды и качество корма [1]. В табл. 2 представлены показатели крови стерляди на конец опыта у двух групп.
Таблица 2
Table 2
Биохимические показатели крови стерляди (Median, n = 5)
Biochemical parameters of sterlet blood (Median, n = 5)
|
Показатель |
Группа |
|
|
Контрольная |
Опытная |
|
|
Белок общий, г/л |
21,2 |
25,2* |
|
Альбумины, г/л |
8,5 |
11,6** |
|
Глобулины, г/л |
12,5 |
14,3 |
|
Альбуминглобулиновый коэффициент |
0,70 |
0,78* |
|
Креатинин, мкмоль/л |
20,12 |
16,1 |
|
Глюкоза, ммоль/л |
3,67 |
1,46** |
|
Билирубин общий, мкмоль/л |
0,47 |
0,38 |
|
Триглицериды, ммоль/л |
4,71 |
5,24 |
|
Холестерин, ммоль/л |
1,69 |
2,14 |
|
АЛТ, МЕ/л |
4,1 |
6,3 |
|
АСТ, МЕ/л |
244,8 |
276,3 |
|
ACТ / AЛТ |
54 |
56,39 |
|
ЩФ, МЕ/л |
55 |
69** |
* 0,05 ≤ p ≤0,1; ** р ≤ 0,01.
Содержание белка в сыворотке крови является значимым показателем состояния рыб, интенсивности питания и обменных процессов [28]. В ходе эксперимента было установлено, что количество общего белка в сыворотке крови опытной группы рыб выше, чем в контрольной, на 18,87 % (0,05 ≤ p ≤ 0,1). Увеличение общего белка также отмечают в исследовании на обыкновенном карпе [24].
Альбумины играют важную роль в адаптации и жизнестойкости организма. Они помогают транспортировать метаболиты, такие как жирные кислоты, гормоны и билирубин, регулируют коллоидно-осмотическое давление крови и процессы осморегуляции, а также фильтруют жидкости в тканях организма [29, 30]. Количество альбуминов в крови опытной группы выше контрольной на 36,47 % (р ≤ 0,01).
Уровень глюкозы в крови поддерживается на относительно постоянном уровне, но может повышаться или понижаться в ответ на различные внешние воздействия. Повышение уровня глюкозы в крови может быть вызвано интенсивным распадом гликогена печени или относительно небольшим использованием глюкозы тканями. Часто стресс вызывает относительную гипергликемию различной степени и продолжительности. Гипогликемия может быть вызвана исчерпанием запасов гликогена печени или интенсивным использованием глюкозы тканями организма [31]. По некоторым данным [29], глюкоза в крови стерляди находится в диапазоне 2–4 мМ/л. В исследовании произошло снижение концентрации глюкозы в опытной группе на 60,22 % (р ≤ 0,01), и, следовательно, она была чуть ниже диапазона, указанного выше. В научной литературе неоднократно описано, что ЭВК способен понижать уровень глюкозы [11, 25, 22]. Хотя точный механизм снижения глюкозы у рыб неизвестен, исследования показывают, что он может быть связан с модуляцией функций β-клеток поджелудочной железы и метаболизмом глюкозы в печени [22].
Щелочная фосфатаза – видоспецифичный фермент, который участвует в расщеплении фосфорорганических соединений. Ее уровень в крови может повышаться не только из-за разрушения клеток, но и за счет нейрогенной или хронической активации синтеза фермента [29]. В ходе исследования было обнаружено, что в опытной группе концентрация ЩФ повысилась на 25,45 % (p ≤ 0,01). Это противоречит результатам других исследований, в которых при скармливании экстракта активность ЩФ либо понижалась [9, 22], либо не менялась [11]. Однако следует отметить, что повышение концентрации ЩФ может быть вызвано не только действием экстракта, но и другими факторами. Известно, что некоторые физиологические состояния, такие как заболевания печени и скелета, приводят к появлению
в крови большого количества ЩФ [32], поэтому для более точных выводов необходимо провести дополнительные исследования.
На рис. 3, 4 представлен химический и минеральный состав мяса стерляди. Достоверных различий между контрольной и опытной группами не обнаружено, и в целом химический состав мяса у обеих групп сохраняется примерно на одном уровне.

Рис. 3. Химический состав мяса стерляди
Fig. 3. Chemical composition of starlet meat
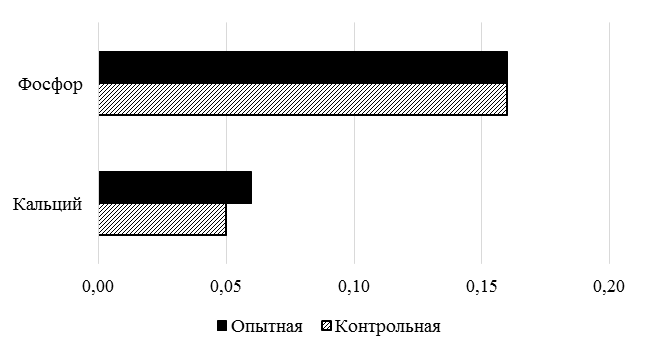
Рис. 4. Минеральный состав мяса стерляди
Fig. 4. Mineral composition of starlet meat
Также существенных различий в составе тела выявлено не было в работе [9], однако другие исследователи наблюдают увеличение содержания белка в филе на примере радужной форели [19], в том числе по мере увеличения концентрации ЭВК [22].
Заключение
В результате исследований было установлено, что добавление экстракта виноградной косточки (ЭВК) (95 % проантоцианидинов) в комбикорм для молоди стерляди в дозе 50 мг/кг комбикорма в течение 63 дней приводит к изменению ряда физиологических показателей. У рыб опытной группы наблюдалось повышение уровня водорастворимых антиоксидантов в печени, общего белка и альбуминов
в сыворотке крови, а также снижение концентрации глюкозы в крови. Эти результаты позволяют предположить, что введение ЭВК в комбикорм для стерляди может положительно влиять на процессы метаболизма и способствовать профилактике окислительного стресса. Также было установлено, что водный ЭВК обеспечивает более высокое суммарное количество водорастворимых антиоксидантов в ком-
бикорме для осетровых. В дальнейшем рекомендуется провести дополнительные исследования для разработки оптимальных дозировок и способов применения ЭВК в осетроводстве.
1. Akhmedzhanova A. B., Ponomarev S. V., Viatchin V. V., Fedorovykh Iu. V., Levina O. A., Dutikov E. A. Otsenka bioindikatorov fiziologo-biokhimicheskikh pokazatelei remontno-matochnogo stada osetrovykh ryb [Evaluation of bioindicators of physiological and biochemical parameters of the repair and brood stock of sturgeon fish]. Rybnoe khoziaistvo, 2021, no. 5, pp. 97-100.
2. Krasnaia kniga Rossiiskoi Federatsii [The Red Book of the Russian Federation]. Moscow, FGBU «VNII Ekologiia», 2021. Vol. «Zhivotnye». 1128 p.
3. Sergaliev N. K., Andronov E. E., Pinaev A. G., Tumenov A. N., Kakishev M. G. Genetic and Morphometric As-sessment of Sturgeon Species Bred in Closed Water Supply. J. Pharm. Sci. & Res., 2017, vol. 9, no. 11, pp. 2296-2300.
4. Kol'man R. V. Ustanovki s zamknutym vodoobme-nom v osetrovodstve [Installations with closed water ex-change in sturgeon breeding]. Strategiia razvitiia ak-vakul'tury v usloviiakh XXI veka: materialy Mezhdunarodnoi nauchno-prakticheskoi konferentsii (Minsk, 2004 g.). Minsk, Tonpik Publ., 2004. Pp. 53-58.
5. Riva G. A. D. L. R. D. L., Trujillo L. A. S., González-Hernández J. C. Assessment on Oxidative Stress in Animals: From Experimental Models to Animal Production. Importance of Oxidative Stress and Antioxidant System in Health and Disease. 2023. Available at: https://www.intechopen.com/chapters/85321 (accessed: 04.02.2024).
6. Shastak Y., Pelletier W. Captivating Colors, Crucial Roles: Astaxanthin’s Antioxidant Impact on Fish Oxidative Stress and Reproductive Performance. Animals, 2023, vol. 3, no. 21, p. 3357.
7. Panasenko V. V. Ispol'zovanie probiotikov v kormakh dlia ryb kompanii PROVIMI [The use of probiotics in PROVIMI fish feed]. Sostoianie i perspektivy razvitiia fermerskogo rybovodstva aridnoi zony: tezisy dokladov Mezhdunarodnoi nauchnoi konferentsii (Azov, 2006 g.). Rostov-on-Don, Izd-vo IuNTs RAN, 2006. Pp. 70-71.
8. Desbruslais A., Wealleans A. L. Oxidation in Poultry Feed: Impact on the Bird and the Efficacy of Dietary Antioxidant Mitigation Strategie. Poultry, 2020, vol. 1, no. 4, pp. 246-277.
9. Xu G., Xing W., Li T., Yu H., Wei S., Jiang N., Ma Z., Luo L. Dietary grape seed proanthocyanidins improved growth, immunity, antioxidant, digestive enzymes activities, and intestinal microbiota of juvenile hybrid sturgeon (Acipenser baeri Brandt ♀ × A. schrenckii Brandt ♂). Aquaculture Nutrition, 2021, pp. 1-13.
10. Reverter M., Bontemps N., Lecchini D., Banaigs B., Sasal P. Use of plant extracts in fish aquaculture as an alternative to chemotherapy: Current status and future perspectives. Aquaculture, 2014, vol. 433, pp. 50-61.
11. FAO-OIV Focus on Table and Dried Grapes. 2016. Available at: https://openknowledge.fao.org/handle/20.500.14283/i7042en (accessed: 13.01.2024 ).
12. Viveros A., Chamorro S., Pizarro M., Arija I., Cen-teno C., Brenes A. Effects of dietary polyphenolrich grape products on intestinal microflora and gut morphology in broiler chicks. Poult. Sci., 2011, vol. 90, no. 3, pp. 566-578.
13. Tang G., Zhao C., Liu Q., Feng X., Xu X., Cao S., Meng X., Li S., Gan R., Li H. Potential of Grape Wastes as Natural Source of Bioactive Compounds. Molecules, 2018, vol. 23, no. 10, p. 2598.
14. Kim So-Young, Jeong Seok-Moon, Park Woo-Po, Nam Ki-Chang, Ahn Dong Uk, Lee Seung-Cheol. Effect of heating of grape seeds on the antioxidant activity of grape seed extracts. Food Chemistry, 2006, vol. 97, pp. 472-479.
15. Kupina A., Kelm M., Monagas M. J. Scope Grape Seed Extract Laboratory Guidance Document; ABC-AHP-NCNPR Botanical Adulterants Prevention Program: Austin, TX, USA, 2019. DOI:https://doi.org/10.59520/bapp.lgd/DOzo2637.
16. Sprygin V. G., Kushnerova N. F. Prirodnye oligo-mernye proantotsianidiny – perspektivnye reguliatory metabolicheskikh narushenii [Natural oligomeric proanthocyanidins are promising regulators of metabolic disorders]. Vestnik DVO RAN, 2006, no. 2, pp. 81-90. Available at: https://cyberleninka.ru/article/n/prirodnye-oligomernye-proantotsianidiny-perspektivnye-regulyatory-metabolicheskih-narusheniy (accessed: 19.12.2023).
17. Ma Z. F., Zhang H. Phytochemical Constituents, Health Benefits, and Industrial Applications of Grape Seeds: A Mini-Review. Antioxidants, 2017, vol. 6, no. 3, p. 71.
18. Rauf A., Imran M., Abu-Izneid T., Iahtisham-Ul-Haq, Patel S., Pan X., Naz S., Sanches Silva A., Saeed F., Rasul Suleria H. A. Proanthocyanidins: A comprehensive review. Biomedicine & Pharmacotherapy, 2019, vol. 116, p. 108999.
19. Kesbic O., Yiğit M. Structural and chemical changes of grape seed extract after thermal processing and its use in rainbow trout (Oncorhynchus mykiss) diets as an organic feed supplement. Aquaculture, 2019, vol. 503, pp. 275-281.
20. Zelenchenkova A. A., Savina A. A., Avilov D. V. Vliianie sukhogo ekstrakta vinogradnoi kostochki na antioksidantnye svoistva kombikormov dlia ryb [The effect of dry grape seed extract on the antioxidant properties of fish feed]. Veterinariia, zootekhniia i biotekhnologiia, 2023, no. 7,pp. 10-12.
21. Cos P., De Bruyne T., Hermans N., Apers S., Berghe D. V., Vlietinck A. J. Proanthocyanidins in health care current and new trends. Curr. Med. Chem., 2003, vol. 11, pp. 1345-1359.
22. Jahanbakhshi A., Pourmzaffar S., Mozanzadeh M. T., Adeshina I., Zehra S., Vega-Heredia S. Dietary effect of grape seed proanthocyanidin extract on growth performance, serum biochemical parameters, skin mucosal immune response, and antioxidant capacity in goldfish (Carassius auratus). Annals of Animal Science, 2022, vol. 23. DOI:https://doi.org/10.2478/aoas-2022-0059.
23. Mousavi S., Sheikhzadeh N., Hamidian G., Mardani K., Oushani A., Firouzamandi M., Esteban M., Shohreh P. Changes in rainbow trout (Oncorhynchus mykiss) growth and mucosal immune parameters after dietary administration of grape (Vitis vinifera) seed extract. Fish Physiol. Biochem., 2021, vol. 47, pp. 547-563.
24. Mehrinakhi Z., Ahmadifar E., Sheikhzadeh N., Moghadam M. S., Dawood M. A. O. Extract of grape seed enhances the growth performance, humoral and mucosal immunity, and resistance of common carp (Cyprinus carpio) against Aeromonas hydrophila. Annals of Animal Science, 2020, vol. 21. DOI:https://doi.org/10.2478/aoas-2020-0049.
25. Mohammadi Y., Kamangar B., Zarei M. Effects of diets containing grape seed proanthocyanidin extract on the growth and oxidative capacity of common carp (Cyprinus carpio). Aquaculture, 2021, vol. 540. DOI:https://doi.org/10.1016/j.aquaculture.2021.736689.
26. Casas-Grajales S. Antioxidants in liver health. World Journal of Gastrointestinal Pharmacology and Therapeutics, 2015, vol. 6, p. 59.
27. Tebib K., Rouanet J.-M., Besançon P. Antioxidant effects of dietary polymeric grape seed tannins in tissues of rats fed a high cholesterol-vitamin E-deficient diet. Food Chemistry, 1997, vol. 59, pp. 135-141.
28. Serpunin G. G., Sementina E. V., Savina L. V. Kharakteristika krovi sterliadi raznogo vozrasta, vyrash-chivaemoi v ustanovke zamknutogo vodosnabzheniia [Characteristics of sterlet blood of different ages grown in a closed water supply system]. Osetrovoe khoziaistvo, 2009, no. 3, pp. 46-51.
29. Pronina G. I., Koriagina N. Iu. Referensnye znacheniia fiziologo-immunologicheskikh pokazatelei gidrobiontov raznykh vidov [Reference values of physiological and immunological parameters of hydrobionts of different species]. Vestnik Astrakhanskogo gosudarstvennogo tekhnicheskogo universiteta. Seriia: Rybnoe khoziaistvo, 2015, no. 4. pp. 103-108. Available at: https://cyberleninka.ru/article/n/referensnye-znacheniya-fiziologo-immunologicheskih-pokazateley-gidrobiontov-raznyh-vidov (accessed: 17.01.2024).
30. Nurfaidah Metusalach M., Sukarno Mahendradatta M. Protein and albumin contents in several freshwater fish spe-cies of Makassar, South Sulawesi, Indonesia. International Food Research Journal, 2021, vol. 28 (4), pp. 745-751.
31. McDonald D. G., Milligan C. L. Chemical Properties of the Blood. Fish Physiology. San Diego, Academic Press, 1992. Vol. 12. Part B: The Cardio-vascular System. Pp. 56-113.
32. Shahsavani D., Mohri M., Gholipour Kanani H. Determination of normal values of some blood serum enzymes in Acipenser stellates Pallas. Fish Physiol. Biochem., 2010, vol. 36, no. 3, pp. 39-43.
















