Kaliningrad, Kalinigrad, Russian Federation
Russian Federation
Russian Federation
from 01.01.2004 to 01.01.2007
Kalinigrad, Russian Federation
Kalinigrad, Russian Federation
Elasmoid scales of pike-perch (Sander lucioperca), white amur (Ctenopharyngodon idella), carp (Cyprinus carpio), freshwater bream (Abramis brama) and crucian carp (Carassius carassius) were processed without hydrolysis by “dry” method in order to study the characteristics of the obtained finished product, which determine its further use as additives for food and other purposes. The essence of the method consisted in washing the scales, its subsequent drying, grinding and separation, with obtaining two fractions enriched with both organic (cotton-like product) and inorganic (powder) components. FT-IR spectroscopy was used to characterize the scale samples and their enriched fractions. Characteristic bands known for collagen, in particular for Amide I, Amide II, Amide III, Amide A, were observed in the IR spectra of all the samples studied. The bands (inorganic part) at ~1022 cm–1 and at ~599 cm–1 indicate valence asymmetric vibrations of PO43– groups. Numerous bands for all experimental samples in the wavelength region 3900-3500 cm–1 can be caused by vibrations of OH groups, which is associated with the presence of water in the tested samples. Comparison of the absorption intensity in the region of characteristic frequencies of collagen and hydroxyapatite calculated by the IR method can be one of the approaches for the development of a rapid method for the determination of their quantitative content in fractions obtained from fish scales. Organic and mineral additives from fish scales can be recommended as components of formulations of various food products, as well as raw materials in tissue engineering, orthopedics and dentistry.
fish scales, collagen, calcium hydroxyapatite, fraction, FT-IR spectroscopy
Введение
Основная часть вылавливаемых в мире гидробионтов относится к самому многочисленному классу позвоночных животных – костистых рыб, покрытых эласмоидной (костной – разделяющейся на циклоидную и ктеноидную) чешуей, представляющей собой плоские пластинки округлой формы. Ежегодное количество рыбьей чешуи, образующейся в мире в процессе разделки рыбы, оценивается в 8,0 млн т [1]. Органическая часть чешуи (40–84 % от общей массы сухого вещества) представлена в основном коллагеном, а основу минеральной части (15–59 %) составляет гидроксиапатит кальция [2]. Иерархическая структура рыбьей чешуи, имеющая повышенную жесткость, не позволяет использовать ее в качестве пищевого сырья без предварительного гидролиза (с применением кислот, щелочей, ферментов, органических растворителей и пр.) с последующим выделением основных фракций из жидкости, их концентрированием и сушкой [3–8]. Значительные объемы применяемых жидкостей и энергозатраты при сушке, длительность и многооперационность технологических процессов, а также потери сырья, приводящие к высокой себестоимости конечной продукции, ограничивают использование процесса гидролиза рыбьей чешуи в промышленных масштабах.
Отсутствие экономически приемлемых технологий переработки чешуи и, соответственно, промышленного спроса на данное сырье приводит к его несанкционированным выбросам или утилизации на специальных полигонах и способствует загрязнению окружающей среды.Предложен экономически приемлемый «сухой» способ переработки рыбьей чешуи (без ее предварительного гидролиза), основанный на простых физических методах (измельчение и сепарирование), позволяющий получить ее обогащенные органическими (коллаген) и минеральными (гидроксиапатит) компонентами фракции, при значительном сокращении продолжительности технологического процесса, энергозатрат и потерь сырья [9].
Полученные согласно «сухому» способу переработки рыбьей чешуи ее обогащенные фракции были использованы в качестве компонентов рецептур в составе хлеба и мелкоштучных хлебобулочных изделий [10].
Обогащенные фракции рыбьей чешуи с учетом их технологических характеристик могут быть рекомендованы к использованию в качестве компонентов рецептур различной пищевой продукции,
а также в качестве исходного сырья в тканевой инженерии, ортопедии и стоматологии.
Цель работы заключалась в исследовании характеристик эласмоидной чешуи рыб и ее фракций, получаемых «сухим» способом, согласно методу инфракрасного спектроскопического анализа.
Материалы и методы
Исходным сырьем при получении образцов, используемых для проведения инфракрасного спектроскопического анализа с преобразованием Фурье, являлась чешуя рыб судака (Sander lucioperca), белого амура (Ctenopharyngodon idella), сазана (Cyprinus carpio), пресноводного леща (Abramis brama) и карася (Carassius carassius), выращенных и выловленных в акватории Калининградской области. Чешую получали при их разделке ручным способом (рис. 1).
Рис. 1. Фото сырой чешуи (слева направо)
пресноводного леща (Abramis brama), белого амура (Ctenopharyngodon idella), судака (Sander lucioperca), сазана (Cyprinus carpio), карася (Carassius carassius)
Fig. 1. Photo of raw scales (from left to right) of freshwater bream (Abramis brama),
white cupid (Ctenopharyngodon idella), pike-perch (Sander lucioperca), carp (Cyprinus carpio), crucian carp (Carassius carassius)
Процесс приготовления образцов рыбьей чешуи и ее обогащенных фракций осуществляли согласно ранее описанному «сухому» способу их получения с некоторыми изменениями [9]. Чешую каждого вида рыбы по отдельности помещали в сетчатый мешок с размером ячеек 3 × 3 мм, загружали в перфорированный барабан стиральной машины (модель LG F2WN2S6S3E; LG, Вроцлав, Польша)
и обрабатывали перемешиванием в воде при температуре 20 °С в течение 20 мин. Далее жидкость сливали, а чешую промывали водой и отжимали при 800 об/мин. Затем чешую порциями по 400 г помещали в чашу кухонного комбайна (Moulinex Delico FP203 500 Вт, SEB Group, Лондон, Великобритания) с добавлением 20 г хлорида натрия (NaCl), 4 г гидрокарбоната натрия (NaHCO3) и 80 г дробленого льда, обрабатывали при 1 000 об/мин в течение 10 мин и промывали водой с целью удаления соли и органических примесей. Промытую чешую помещали в емкость с водным раствором хлорида натрия (NaCl) и гидрокарбоната натрия (NaHCO3), взятых в массовом соотношении «чешуя: Н2O : NaCl : NaHCO3» как 100 : 400 : 5 : 1 соответственно, перемешивали образовавшуюся смесь и выдерживали в течение 30 мин при комнатной температуре. Далее при помощи сита (размер ячеек 2 × 2 мм) отделяли рыбью чешую от жидкости и промывали водой для удаления соли и рыбного запаха. Промытую чешую после стекания жидкости обезвоживали в электросушилке с вентилятором («Спектр-Прибор ЭСОФ-2-0,6/220 Ветерок-2» с 6 поддонами, ООО «Спектр-Прибор», г. Курск, Россия) теплым воздухом при температуре ≤ 50 °С до остаточной влажности не более 10 % (рис. 2).
Рис. 2. Фото высушенной чешуи (слева направо):
верхний ряд – белый амур (Ctenopharyngodon idella), судак (Sander lucioperca), сазан (Cyprinus carpio);
нижний ряд – пресноводный лещ (Abramis brama), карась (Carassius carassius)
Fig. 2. Photo of dried scales (from left to right):
upper row – white cupid (Ctenopharyngodon idella), pike-perch (Sander lucioperca), carp (Cyprinus carpio);
lower row – freshwater bream (Abramis brama), crucian carp (Carassius carassius)
Высушенную рыбью чешую каждого вида рыбы по отдельности измельчали в высокоскоростном пищевом измельчителе (20 000 об/мин) молоткового типа (модель DF-15, сито – 100 меш, Shanghai Ruolin Machinery Equipment, Китай).
Измельченную рыбью чешую разделяли с помощью пищевого электрического вибросита со сменными ситами (модель PS-300B, Yonkang WD Industry and Trade Ltd., Юнкан, Китай) на фракции.
При разделении на две фракции использовали сито 300 меш (ячея сетки размером 0,05 мм), при этом получали обогащенную неорганическими компонентами фракцию в виде порошка с размером частиц 0,05 мм и менее и обогащенную органическими компонентами фракцию ватообразной структуры с размером частиц более 0,05 мм (рис. 3).

Рис. 3. Фото фракций рыбьей чешуи (слева направо) судака (Sander lucioperca), пресноводного леща (Abramis brama):
верхний ряд – обогащенных органическими компонентами с размером частиц 0,05 мм и более;
нижний ряд – обогащенных неорганическими компонентами с размером части 0,05 мм и менее
Fig. 3. Photos of fish scale fractions (from left to right) ьof pike-perch (Sander lucioperca),
freshwater bream (Abramis brama): the upper row is enriched with organic components
with a particle size of 0.05 mm or more; the lower row is enriched with inorganic components with a part size of 0.05 mm or less
Рыбья чешуя и ее обогащенные фракции были использованы для подготовки и исследования их характеристик методом инфракрасного спектроскопического анализа.
Образцы чешуи каждого вида рыбы и ее фракций перед снятием спектра дополнительно измельчали в агатовой ступке. Для определения относительного содержания органической и неорганической составляющих в чешуе и ее фракциях порошок чешуи судака прокаливали в универсальной лабораторной муфельной электропечи SNOL 8,2/1100 при 200, 400 и 800 оС (рис. 4).

Рис. 4. Фото фракций рыбьей чешуи судака (Sander lucioperca) после прокаливания при 200, 400, 800 ºС:
нижний ряд – целая чешуя (5); средний ряд – фракция, обогащенная органическими компонентами
с размером частиц более 0,05 мм (5а); верхний ряд – фракция, обогащенная неорганическими компонентами
с размером частиц 0,05 мм и менее (5б)
Fig. 4. Photos of fractions of pike-perch fish scales (Sander lucioperca) after calcination at 200, 400, 800 °C: the lower row
is a whole scale (5), the middle row is a fraction enriched with organic components with a particle size of more than 0.05 mm (5а); the upper row is a fraction enriched with inorganic components with a size of particles 0.05 mm or less (5б)
Видам рыб и их измельченной в порошок чешуе были присвоены следующие обозначения: 1 – белый амур, 2 – сазан, 3 – карась, 4 – лещ, 5 – судак.
Для фракций, полученных после сепарации, к цифровому обозначению вида рыб добавили буквенный индекс. Фракции, обогащенной органическими компонентами ватообразной структуры, с размером частиц более 0,05 мм присвоили буквенный индекс а (образцы 1а, 2а, 3а, 4а, 5а). Фракции в виде порошка с размером частиц 0,05 мм и менее, обогащенной неорганическими компонентами, добавили буквенный индекс б (образцы 1б, 2б, 3б, 4б, 5б), образцам чешуи судака и ее фракций (а, б) после прокаливания при 200, 400 и 800 ºС бы-
ли присвоены обозначения 5(а, б)-200, 5(а, б)-400, 5(а, б)-800 (см. рис. 4).
Регистрация инфракрасных (ИК) спектров образцов проводилась на ИК-Фурье-спектрометре ФТ-801 (производитель – научно-производственная фирма СИМЕКС, г. Новосибирск, Россия). Для снятия спектров применяли метод нарушенного полного внутреннего отражения с использованием универсальной приставки. Образцы прижимали к кристаллу с помощью специального приспособления для лучшего контакта между частицами образца и кристаллом. Спектры регистрировались при комнатной температуре. Диапазон сканирования составлял от 500 до 4 000 см–1 при разрешении 8 см–1, число сканирования 36. Опорный спектр фонового воздуха снимался перед каждым сканированием образца. Спектры обработаны в программе ZaIR 3.5.
Результаты исследования и их обсуждение
Для всех исследуемых образцов в ИК-спектрах чешуи: 1 – белого амура, 2 – сазана, 3 – карася, 4 – леща, 5 – судака наблюдаются полосы поглощения, характерные как для органической ее составляющей (в основном коллагена), так и для неорганической части (преимущественно гидроксиапатита) (рис. 5).
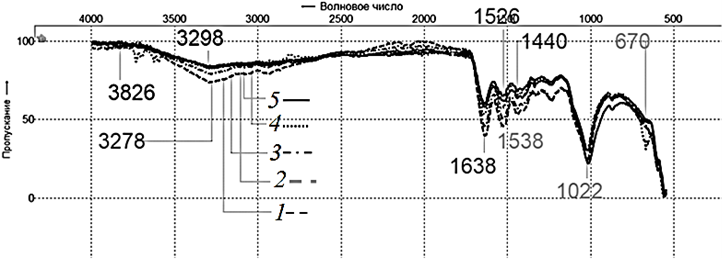
Рис. 5. Спектры порошка чешуи: 1 – белого амура; 2 – сазана; 3 – карася; 4 – леща; 5 – судака
Fig. 5. Scales powder spectra: 1 – white cupid; 2 – carp; 3 – crucian carp; 4 – bream; 5 – pike-perch
В спектрах образцов чешуи (1–5) интенсивные полосы с максимумами при ~1 638 см–1 (валентные колебания связи С = О в карбонильных группах) и ~1 530 см–1 (деформационные колебания связи
N – Н и валентные колебания связи N – C = O), а также менее интенсивная полоса с максимумом ~ 1 236 см–1 связаны с колебаниями в пептидной группе (полосы Амид I, Амид II, Амид III).
Кроме того, в ИК-спектрах всех изучаемых образцов присутствует знаковая для коллагена полоса при 1 338 см–1, предположительно связанная с деформационными колебаниями группы СН2 пролина полипептидной цепи. Также присутствуют полосы при ~1 440 и ~1 399 см–1, связанные с деформационными колебаниями групп СН2 и СН3. Полосы в области ~3 298 см–1 обусловлены валентными колебаниями групп NH и NH2 (как свободных, так и связанных водородными связями) и соответствуют Амиду A.
Таким образом, выявленные в ИК-спектрах полосы поглощения С = О и N – Н описывают колебания пептидной связи белка и могут являться доказательством коллагеновой природы тестируемых образцов [11, 12]. Для неорганической части исследуемых образцов полосы при ~1 022 см–1 и при ~599 см–1 указывают на валентные асимметричные колебания групп PO4 [13].
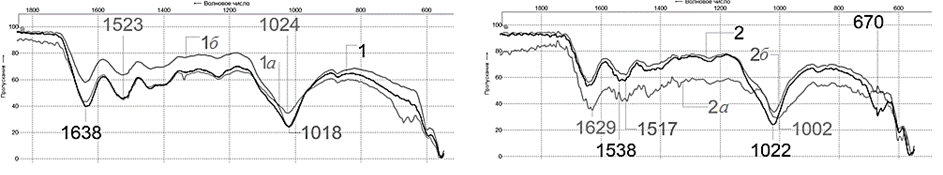
Многочисленные полосы для всех образцов в области длин волн 3 900–3 500 см–1 могут быть обусловлены колебаниями групп ОН (как свободных, так и ассоциированных в результате водородных связей), что связано с присутствием в тестируемых образцах воды. На рис. 6–8 приводятся в сравнении спектры исходной чешуи рыб (образцы 1–5) и ее фракций, обогащенных органической (образцы 1а–5а) и неорганической компонентой (образцы 1б–5б).
а б
Рис. 6. Спектры образцов: а – чешуи белого амура: 1 – исходной, 1а – фракции, обогащенной органическими
компонентами, 1б – фракции, обогащенной неорганическими компонентами; б – чешуи сазана: 2 – исходной,
2а – фракции, обогащенной органическими компонентами, 2б – фракции, обогащенной неорганическими компонентами
Fig. 6. Spectra of samples: a – scales of white cupid: 1 – initial, 1a – fraction enriched with organic components, 1б – fraction enriched with non-organic components; б – scales of carp: 2 – initial, 2a – fraction enriched with organic components, 2б – fraction enriched with inorganic-by the components
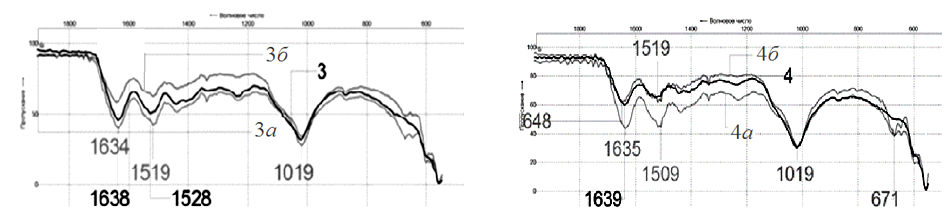
а б
Рис. 7. Спектры образцов: а – чешуи карася: 3 – исходной, 3а – фракции, обогащенной органическими компонентами,
3б – фракции, обогащенной неорганическими компонентами; б – чешуи пресноводного леща: 4 – исходной,
4а – фракции, обогащенной органическими компонентами, 4б – фракции, обогащенной неорганическими компонентами
Fig. 7. Spectra of samples: a – scales of crucian carp: 3 – initial, 3a – fractions enriched with organic components,
3б – fractions enriched with non-organic components; б – scales of freshwater bream: 4 – initial,
4a – fractions enriched with organic components, 4б – fractions, enriched with inorganic components
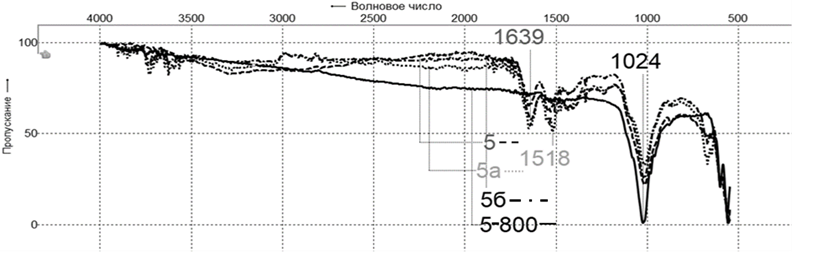
Рис. 8. Спектры образцов чешуи судака: 5 – исходной,
5а – фракции, обогащенной органическими компонентами,
5б – фракции, обогащенной неорганическими компонентами, 5-800 – фракции после прокаливания при 800 оС
Fig. 8. Spectra of pike-perch scale samples: 5 – initial, 5a – fraction, enriched with organic components,
5б – fraction, enriched with inorganic components, 5-800 – fractions, after calcination at 800оС
Результирующая кривая (конфигурация) ИК-спектров опытных образцов фракций чешуи аналогична спектрам исходной рыбьей чешуи (см. рис. 6, 7), что говорит о сохранении ее нативной структуры
в процессе переработки компонентами полученных фракций. Подобие всех спектров говорит о том, что образцы имеют схожий компонентный состав, а наблюдаемые различия (см. рис. 6, 7) обусловлены отчасти видом рыбы, а также степенью дисперсности после пробоподготовки, однако они не влияют на соотношение интенсивностей поглощения в каждом образце и, соответственно, на количественные соотношения их органической и неорганической компонент. На рис. 8 представлен спектр чешуи, прокаленной при 800 оС (образец – судак 5-800), что позволяет подтвердить вывод о том, что полоса поглощения при ~1 024 см–1 соответствует неорганической ее составляющей, т. к. в спектре отсутствуют интенсивные полосы амидных групп белка, удаленного в процессе озоления органической части. Исходная чешуя рыб и ее фракции представляют собой смесь органических и неорганических компонентов в различном соотношении, поэтому целесообразна разработка быстрого способа определения содержания этих составляющих в сырье. На наш взгляд, анализ ИК-спектров исследуемых образцов позволяет наметить путь реализации такого способа.
Одним из возможных подходов является сравнение интенсивности поглощения в области характеристических частот коллагена и гидроксиапатита. Для сравнения относительного содержания коллагеновой и гидроксиапатитовой фракций были выбраны диапазоны 1 640 и 1 020 см–1 соответственно. Сравнивалось соотношение площадей пиков поглощения в данных диапазонах (табл.).
Анализ отношения поглощения образцов фракций рыбьей чешуи в диапазонах 1 640 и 1 020 см–1
Analysis of the fish scale fractions samples absorption ratio in the range of 1640 and 1020 cm–1
|
Показатель |
Образец |
|||||||||
|
1а |
1б |
2а |
2б |
3а |
3б |
4а |
4б |
5а |
5б |
|
|
Площадь пика S |
3 464 |
6 385 |
3 423 |
4 581 |
3 500 |
5 727 |
4 509 |
5 672 |
4 010 |
6 271 |
|
Площадь пика S |
7 055 |
5 560 |
8 181 |
5 482 |
8 020 |
5 250 |
8 038 |
4 918 |
6 048 |
4 286 |
|
Соотношение* |
2,0 |
0,9 |
2,4 |
1,2 |
2,3 |
0,9 |
1,8 |
0,9 |
1,5 |
0,7 |
|
Соотношение |
67,0 33,0 |
46,6 53,4 |
70,5 29,5 |
54,5 45,5 |
69,6 30,4 |
47,8 52,2 |
64,0 36,0 |
46,4 53,6 |
60,1 39,9 |
40,6 59,4 |
* Соотношение органической части и неорганической, безразмерная величина.
По данным таблицы можно сделать вывод, что в образцах 1а–5а условное соотношение содержания органической компоненты к неорганической составляет от 1,5 до 2,4, соответственно, в образцах 1б–5б это соотношение в основном меньше 1 (среднее значение 0,9). Значительное количество коллагенового белка в виде мягкого волокна в получаемой органической фракции из чешуи рыб (60,1–70,5 % согласно табл.) по аналогии с сухой коллагеновой добавкой животного происхождения в виде также мелкого волокна или порошка (из кожи свиньи, спилка крупного рогатого скота и др.) может быть использована в рецептурах различных продуктов питания [14]. Коллагенсодержащая рыбная добавка будет способствовать также обогащению конечной продукции гидроксиапатитом кальция (29,5–39,9 %), увеличивая ее функциональную составляющую. Значительное содержание биогенного гидроксиапатита кальция в минеральной фракции (45,5–59,4 %), после соответствующей обработки, позволяет рекомендовать его в качестве сырья в тканевой инженерии, ортопедии и стоматологии. Представленный анализ рыбьей чешуи и ее обогащенных фракций согласуется с данными, полученными другими исследователями [15–20]. Использование метода ИК-Фурье-спектроскопии позволяет разработать экспресс-метод определения содержания коллагеновой и гидроксиапатитовой фракций в продуктах переработки рыбьей чешуи для их потенциального использования в пищевых и иных целях.
Заключение
Исследования измельченных образцов эласмоидной рыбьей чешуи и ее обогащенных фракций, полученных «сухим» способом, проведенные с помощью инфракрасного спектроскопического анализа, показали, что в ИК-спектрах наблюдаются характеристические полосы, свойственные для коллагена, в частности для Амида I, Амида II, Амида III, Амида A, а также (неорганическая часть) полосы, обусловленные валентными асимметричными колебаниями групп PO4 и колебаниями групп ОН (как свободных, так и ассоциированных в результате водородных связей), что связано с присутствием воды.
Метод ИК-Фурье-спектроскопии может быть использован для быстрого определения соотношения коллагена и гидроксиапатита в рыбьей чешуе и продуктах ее переработки.
1. Kodali D., Hembrick-Holloman V., Gunturu D. R., Samuel T., Jeelani S., Rangari V. K. Influence of fish scale-based hydroxyapatite on forcespun polycaprolactone fiber scaffolds. ACS omega, 2022, vol. 7, no. 10, pp. 8323-8335. DOI:https://doi.org/10.1021/acsomega.1c05593.
2. Dgebuadze Iu. Iu., Chernova O. F. Cheshuia kostistykh ryb kak diagnosticheskaia i registriruiushchaia struktura [Scales of bony fish as a diagnostic and recording structure]. Moscow, Tovarishchestvo nauchnykh izdanii KMK, 2009. 313 p.
3. Zhang Y., Tu D., Dai Z. Method for Extracting Fish Scale Collagen Protein Peptide Powder and Hydroxyapatite. Pat. CN. № 108949882; 07.12.2018.
4. Liu Y., Ji S., Zhang L., Yang F. Method for Extracting Hydroxyapatite and Collagen from Fish Scales by Using Deep Eutectic Solvent. Pat. CN. № 111302319; 19.06.2020.
5. Harada O., Hasegawa Y. Extraction Method and Ex-traction Apparatus of Collagen, Production Method and Production Apparatus of Hydroxyapatite, and Collagen-Containing Aqueous Extract and Hydroxyapatite. Pat. JP № 2008285456. 27.11.2008.
6. Li L., Yang Y., Yao T., Lin Y., Chen L., Xue X. Comprehensive Extraction Method of Collagen, Hydroxyapatite and Protein in Fish Scales. Pat. CN. № 107056933; 18.08.2017.
7. Hu C., Shi Y. Preparation method of collagen. Pat. CN. № 109053878; 21.12.2018.
8. Iqbal F., Muhammad N. Extraction of hydroxyapatite from fish scales employing ionic liquids. Pat. US. № 2016376149; 29.12.2016.
9. Vorob'ev V. I., Nizhnikova E. V. Poluchenie fraktsii kollagena i gidroksiapatita iz ryb'ei cheshui [Obtaining fractions of collagen and hydroxyapatite from fish scales]. Izvestiia Kaliningradskogo gosudarstvennogo tekhnicheskogo universiteta, 2021, no. 62, pp. 80-91. DOI:https://doi.org/10.46845/1997-3071-2021-62-80-91.
10. Vorob'ev V. I., Chernega O. P., Fatykhov Iu. A., Nizhnikova E. V. Sposob prigotovleniia khleba s rybnoi dobavkoi [The method of making bread with fish additives]. Patent RF 2785619; 09.12.2022.
11. Tarasevich B. N. IK-spektry osnovnykh klassov or-ganicheskikh soedinenii [IR spectra of the main classes of organic compounds]. Moscow, MGU im. M. V. Lomono-sova, 2012. Pp. 1-54. DOI: chem.msu.su/rus/teaching/tarasevich/Tarasevich IR tables 29-02-2012.
12. Ignat'eva N. Iu., Zakharkina O. L., Sviridov A. P. Ekspress-analiz khriashchevykh tkanei s ispol'zovaniem mno-gomernogo analiza IK-spektrov [Express analysis of cartilage tissues using multidimensional analysis of IR spectra]. So-vremennye tekhnologii v meditsine, 2022, vol. 14, no. 6, pp. 25-33. DOI:https://doi.org/10.17691/stm2022.14.6.03.
13. Mendes L. C., Ribeiro G. L., Marques R. C. In situ hydroxyapatite synthesis: influence of collagen on its structural and morphological characteristic. Materials Sciences and Applications, 2012, vol. 3, no. 8, pp. 580-586. DOI:https://doi.org/10.4236/msa.2012.38083.
14. Semenova A. A., Nasonova V. V., Drozdova N. A. Importozameshchenie pishchevykh ingredientov: zhivotnyi belok otechestvennogo proizvodstva [Import substitution of food ingredients: animal protein of domestic production]. Vse o miase, 2015, no. 3, pp. 4-7.
15. Srinivasan S., Durairaj B. Collagen isolation and characterization from Sardinella longiceps. Journal of Advanced Veterinary and Animal Research, 2021, vol. 18, no. 4, pp. 679-686. DOI:https://doi.org/10.5455/javar.2021.h560.
16. Pon-On W., Suntornsaratoon P., Charoenphandhu N., Thongbunchoo J., Krishnamra N., Tang M. I. Hydroxyapatite from fish scale for potential use as bone scaffold or regenerative material. Materials Science and Engineering: C, 2016, vol. 62, pp. 183-189. DOI: org/10.1016/j.msec.2016.01.051.
17. Wang L., Li W., Qu Y., Wang K. Preparation of Super Absorbent and Highly Active Fish Collagen Sponge and its Hemostatic Effect in vivo and in vitro. Frontiers in Bioengineering and Biotechnology, 2022, vol. 10, pp. 1-14. DOI: org/10.3389/fbioe.2022.862532.
18. Połomska M., Kubisz L., Wolak J., Hojan-Jezierska D. Effects of Temperature on the FT NIR Raman Spectra of Fish Skin Collagen. Applied Sciences, 2021, vol. 11, no. 18, p. 8358. DOI: org/10.3390/app11188358.
19. Zhang Y., Tu D., Shen Q., Dai Z. Fish scale valorization by hydrothermal pretreatment followed by enzymatic hy-drolysis for gelatin hydrolysate production. Molecules, 2019, vol. 24, no. 16, p. 2998. DOI: org/10.3390/molecules24162998.
20. Nkansah M. A., Dua A. B., Aryee G. A., Adusei-Gyamfi J. Evaluation of Scales of Tilapia sp. and Sciaenops ocellatus as Low Cost and Green Adsorbent for fluoride Removal from Water. Frontiers in Chemistry, 2022, vol. 10, p. 813533. DOI: org/10.3389/fchem.2022.813533.
















