Russian Federation
Russian Federation
Russian Federation
Russian Federation
Russian Federation
For the first time, biometric parameters of cysts and nauplii from populations of hypergaline lakes Bol’shoe Shklo and Malinovoe, and incubation features of cysts from populations of lakes Bol’shoe Shklo, Malinovoe, Maloe Yarovoe, Kulundinskoye, Kuchukskoye were determined. Significant inter-population differences in the biometric characteristics of Artemia sp. were revealed in all the lakes studied. The variability of the biometric parameters of nauplii and artemia cysts is due to the physical and chemical differences in the living conditions of each studied population discovered during the study. The average values of cyst diameter and linear sizes of nauplii (Instar I) of the studied five populations were in the range of 237.4 ± 11.8 – 250.6 ± 14.3 microns, 412.9 ± 27.4 – 463.3 ± 24.6 microns, respectively. The smallest cysts were found in lake Bol’shoe Shklo and lake Malinovoe. The smallest nauplii were derived from the cysts of the population living in lake Bol’shoe Shklo. A high positive correlation was established between the sizes of cysts and nauplii of the studied artemia populations. Experiments to study the effect of the concentration of dietary salt (98.4% NaCl) on the hatchability of nauplii have shown that for populations of artemia from lakes Malinovoe, Kulundinskoye and Kuchukskoye environments with concentrations of 25 g/l were the most favorable for breeding nauplii, while lake Maloe Yarovoe had concentrations of 10 and 25 g/l. Cysts from lake Bol’shoe Shklo population showed identical excretion in all studied salt concentrations. The optimal environmental parameters for breeding nauplii vary depending on the origin of the population. The differences in the hatchability conditions of artemia nauplii should be taken into account during the experiments and especially for the successful incubation and cultivation of artemia in fish farms.
hypergaline lakes, artemia, population, cysts, naupliuses, biometric characteristics, hatchability
Введение
Род Artemia Leach, 1819 относится к жаброногим ракообразным (Branchiopoda) и встречается во многих внутренних соленых озерах и прибрежных солончаках, распространенных по всему миру. Благодаря своим питательным качествам и небольшим размерам личинки артемии (науплиусы) представляют собой превосходный живой корм для выращивания различных представителей аквакультуры [1, 2].
Род Artemia включает несколько бисексуальных видов и большое количество облигатных партеногенетических популяций [3]. Бисексуальные виды артемии обитают в гипергалинных водоемах Старого и Нового Света в регионах с умеренным климатом [1]. На азиатском континенте, в том числе в Западной Сибири, обитают в основном партеногенетические популяции артемии [4], которые состоят из одних самок, или доля самцов ничтожно мала (не более 2 % от всего числа особей) [5]. Имеются литературные данные, что в озерах Алтая обитает вид Artemia urmiana Günther, 1899 [6].
Постановка задачи
В настоящее время для определения видовой и популяционной принадлежности жаброногих ракообразных большое значение имеет мультидисциплинарный подход, который подразумевает использование данных, полученных в рамках различных биологических дисциплин с использованием современных статистических методов [7]. Для описания популяций артемии используют биометрию взрослых рачков, цист и науплиусов, морфологические особенности оболочки, плавучесть цист, характеристики выводимости и биохимический состав науплиусов (жирные кислоты, общие липиды, содержание золы и т. д.) [8–11]. Наиболее важным и обязательным для характеристики популяций считается определение размеров цист и науплиусов, а также выводимости цист, т. к. эти параметры имеют решающее значение для оценки экономической ценности артемии, что способствует рациональному ее использованию в аквакультуре [10].
Цель исследования – изучение биометрических характеристик цист и науплиусов артемии из популяций, обитающих в разнотипных гипергалинных озерах Кулундинской равнины и имеющих промысловое значение, и некоторых особенностей инкубации цист из этих популяций.
Материал и методы
Регион исследований. Для исследований были взяты популяции гипергалинных водоемов Кулундинской равнины (Алтайский край), включающие сообщества жаброногого рачка Artemia, а также факторы среды, которые формируют популяционные характеристики рачков. Образцы для исследований были собраны из пяти разнотипных озер: Большое Шкло (2020 г.), Малиновое (2021 г.), Малое Яровое (2021 г.), Кулундинское (2022 г.) и Кучукское (2022 г.) (рис. 1, табл. 1).
Отбор проб и измерение факторов среды в гипергалинных озерах проведены по стандартным методикам [12, 13]. Цисты для биометрических измерений и исследования выводимости промыты в рассоле (160 г/л) и до исследования хранились в холодильной камере при отрицательной температуре 5–10 °С.
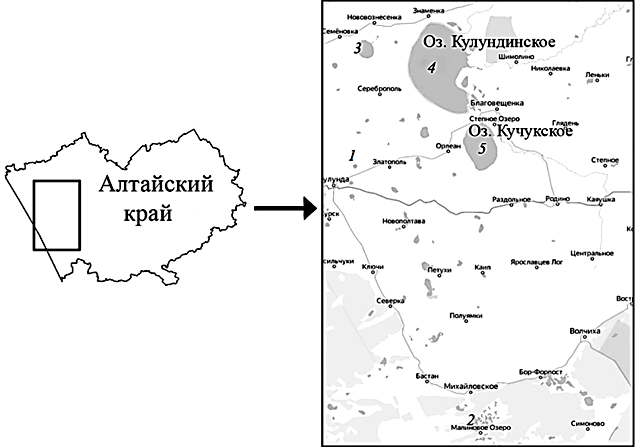
Рис. 1. Расположение мест обитания изученных популяций Artemia sp.:
1 – Большое Шкло; 2 – Малиновое; 3 – Малое Яровое; 4 – Кулундинское; 5 – Кучукское
Fig. 1. Locations of habitats of the studied populations of Artemia sp.:
1 – Bol’shoe Shklo; 2 – Malinovoe; 3 – Maloe Yarovoe; 4 – Kulundinskoye; 5 – Kuchukskoye
Таблица 1
Table 1
Местоположение и основные морфометрические параметры изученных озер
Location and main morphometric parameters of studied lakes
|
Озеро |
Район |
Координаты |
Площадь, км2 |
Глубина, м |
|
Большое Шкло |
Кулундинский |
52° 63' с. ш, 79° 05' в. д. |
2,5 |
1,2–1,9 |
|
Малиновое |
Михайловский |
51° 70′ с. ш, 79° 74′ в. д. |
11,4 |
0,4–1,5 |
|
Малое Яровое |
Табунский и Славгородский |
53° 05' с. ш, 79° 10' в. д. |
35,2 |
2,8–5,0 |
|
Кулундинское |
Благовещенский |
52° 95′ с. ш, 79° 50′ в. д. |
770,0 |
2,3–4,5 |
|
Кучукское |
Благовещенский |
52° 65' с. ш, 79° 75' в. д. |
181,0 |
2,3–3,3 |
Определение морфометрических параметров цист и науплиусов артемии. Измерение диаметра проводили у предварительно гидратированных в пресной воде цист. Время гидратации – 2 ч. Для получения науплиусов (Instar I) цисты инкубировали в растворе поваренной пищевой соли (98,4 % NaCl) с концентрацией 35 г/л при температуре 25 °С [17]. Через 24 ч после начала инкубации науплиусов фиксировали 1 %-м раствором Люголя в течение 12 ч [14, 15]. Все измерения выполняли с помощью бинокулярного микроскопа МБС–10 с окуляр-микрометром. Объем выборки – 50 цист и 100 науплиусов каждого образца.
Исследование выводимости цист артемии. Инкубационную среду для определения процента выводимости науплиусов (количество науплиусов, которое может быть получено из 100 полных
цист) [16] готовили из фильтрованной водопроводной воды и поваренной пищевой соли (98,4 % NaCl) в трех вариантах: 10, 25 и 35 г/л. Величина рH экспериментальных растворов соли составляла 7,3 (определена прибором Kellog PH-0099). Плотность цист в инкубаторе составляла 1 г/л, температура инкубационного раствора 25 ± 1 ºС. Для активации онтогенеза эмбрионов артемии в инкубационные сосуды добавляли эриторбат натрия по 0,5 г/л [17]. Процент выводимости считали после 24 ч инкубации. Все эксперименты были проведены в 3-кратной повторности.
Результаты
Условия обитания ракообразных Artemia. Морфологические параметры, соленость и химизм рапы гипергалинных озер зависят от состояния водности и уровенного режима водоема. Значительные изменения условий в среде обитания для популяций зоопланктона особенно характерны для мелководных и небольших по площади водоемов (оз. Большое Шкло и Малиновое). Анализ химического состава воды гипергалинных оз. Большое Шкло, Малиновое, Малое Яровое, Кулундинское и Кучукское показывает значительную вариабельность концентраций анионов и катионов (табл. 2).
Таблица 2
Table 2
Химический состав воды изученных озер Кулундинской равнины
Chemical composition of the water of stadied lakes of the Kulunda Plain
|
Параметр |
Большое Шкло |
Малиновое |
Малое Яровое |
Кулундинское |
Кучукское |
|
Минерализация, г/л |
25–140 |
105–300 |
170–280 |
45–180 |
215–325 |
|
рН |
8,2–9,1 |
8,0–9,4 |
7,8–8,1 |
7,9–8,9 |
7,6–8,3 |
|
Температура, °С |
17,0–23,0 |
19,5–25,0 |
21,0–25,3 |
18,5–24,0 |
19,4–24,0 |
|
Na+, г/л |
7,1–40,4 |
70,4–141,3 |
– |
7,4–40,7 |
5,8–8,5 |
|
Mg2+, г/л |
0,8–3,6 |
0,1–6,9 |
9,2–12,1 |
1,3–6,4 |
1,1–1,3 |
|
K+, г/л |
0,02–0,08 |
0,1–2,7 |
– |
0,04–0,15 |
– |
|
Ca2+, г/л |
0,05–0,21 |
0,02–0,05 |
0,10–0,33 |
0,02–0,13 |
0,20–0,30 |
|
Cl–, г/л |
8,5–45,8 |
54,0–188,2 |
102,5–149,2 |
13,0–57,1 |
10,6–139,0 |
|
SO42–, г/л |
5,6–35,9 |
2,0–71,3 |
9,8–18,3 |
2,7–26,3 |
1,9–40,9 |
|
HCO3–, г/л |
1,0–1,7 |
1,2–14,7 |
0,01–1,71 |
0,6–2,0 |
– |
|
NO2–, мг/л |
– |
– |
< 0,02 |
0,003–0,04 |
0,01–0,1 |
|
NO3–, мг/л |
– |
– |
< 0,1 |
0,2–24 |
0,9–62 |
|
PO43–, мг/л |
0,8–2,0 |
0,2–25 |
– |
0,07–0,7 |
0,05–0,4 |
В воде всех озер преобладают ионы хлора и натрия. На втором месте находятся ионы сульфата и магния. В некоторых пробах воды оз. Малиновое отмечена значительная концентрация карбонатов. Соотношение основных ионов показывает, что водаоз. Большое Шкло, Малиновое, Малое Яровое, Кулундинское и Кучукское относится к хлоридному классу группы натрия [18]. Наименьшие показатели общей минерализации воды в озерах наблюдаются весной после таяния снега с водосборной площади и достигают максимальных величин в летний и осенний период. В нашем исследовании самый низкий уровень солености можно наблюдать в оз. Большое Шкло, самый высокий в оз. Кучукское. Диапазон колебаний общей минерализации для популяций артемии весьма значителен в каждом озере, от 110 (оз. Малое Яровое) до 195 г/л (оз. Малиновое). Низкая соленость, при которой рачки Artemia теряют доминирующее положение в экосистеме, характерна только для оз. Большое Шкло и Кулундинское.
В осенний̆ период в некоторых озерах возможно выпадение солевого осадка (оз. Малиновое, Кучукское). Водородный показатель (рН) воды во всех озерах имеет слабощелочную реакцию. Наиболь-
шие значения зарегистрированы в оз. Большое Шкло и Малиновое, 9,1 и 9,4 соответственно.
Так как озера расположены в континентальной климатической зоне, для них характерны значительные сезонные колебания температуры. Температура воды, оптимальная для размножения и роста артемии, зарегистрирована в период с апреля по октябрь. В более мелководных озерах (оз. Большое Шкло, Малиновое) или озерах, имеющих большую литоральную зону (оз. Кулундинское), нагрев рапы происходит быстрее. В них наблюдается более ранний выклев науплиусов (третья декада марта) и более интенсивный рост рачков первой генерации.
В период опреснения в оз. Кулундинское и Большое Шкло отмечено развитие некоторых видов солоноватоводной фауны: коловратки (Rotifera), веслоногие (Copepoda) и ветвистоусые (Cladocera) рачки. При увеличении солености выше 110 г/л в зоопланктоне остаются только жаброногие ракообразные из рода Artemia.
Морфометрические параметры цист и науплиусов артемии. Результаты исследований показали значительную межпопуляционную изменчивость диаметра цист артемии, обитающей в разнотипных гипергалинных озерах (табл. 3).
Таблица 3
Table 3
Диаметр цист изученных популяций Artemia sp.
Cyst diameter of studied Artemia sp. populations
|
Место обитания популяции (озеро) |
Диаметр гидратированных цист*, мкм |
Достоверные различия c озерами |
||||
|
M ± σ |
m |
min |
max |
CV |
||
|
Большое Шкло |
237,4 ± 14,6 |
2,0 |
200,0 |
264,3 |
6,2 |
Малое Яровое (р < 0,01) Кучукское (р < 0,01) |
|
Малиновое |
237,4 ± 11,8 |
1,7 |
200,0 |
257,1 |
5,0 |
Малое Яровое (р < 0,01) Кучукское (р < 0,01) |
|
Малое Яровое |
250,3 ± 12,9 |
1,8 |
221,4 |
285,7 |
5,1 |
Большое Шкло (р < 0,01) Малиновое (р < 0,01) Кулундинское (р < 0,01) |
Окончание табл. 3
Ending of Table 3
|
Место обитания популяции (озеро) |
Диаметр гидратированных цист*, мкм |
Достоверные различия c озерами |
||||
|
Кулундинское |
239,7 ± 15,0 |
2,1 |
214,3 |
285,7 |
6,3 |
Малое Яровое (р < 0,01) Кучукское (р < 0,01) |
|
Кучукское |
250,6 ± 14,3 |
2,0 |
214,3 |
278,6 |
5,7 |
Большое Шкло (р < 0,01) Малиновое (р < 0,01) Кулундинское (р < 0,01) |
* М – среднее арифметическое значение; σ – стандартное отклонение от среднего; m – ошибка среднего; min и max – минимальное и максимальное значения; CV – коэффициент вариации.
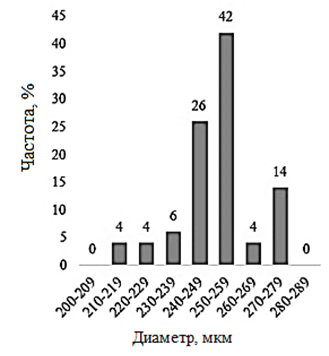
Наименьший средний размер цист был обнаружен в двух озерах – Большое Шкло и Малиновое (237,4 ± 14,6 и 237,4 ± 11,8 мкм). Диапазон варьирования значений размера цист в оз. Большое Шкло составляет 64,3 мкм, в оз. Малиновое – 57,1 мкм. В оз. Малиновое 94 % цист имеет размер от 220 до 259 мкм (рис. 2).
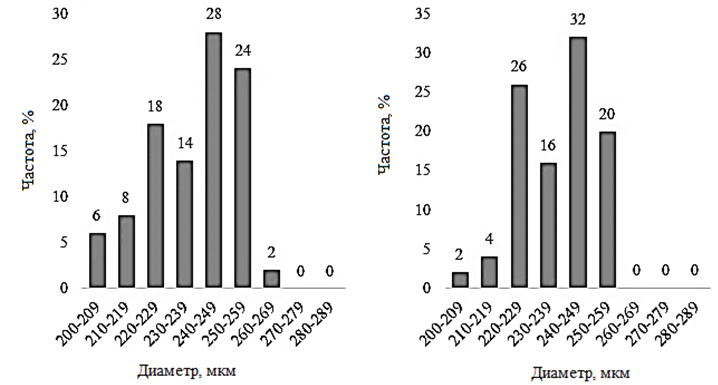
а б
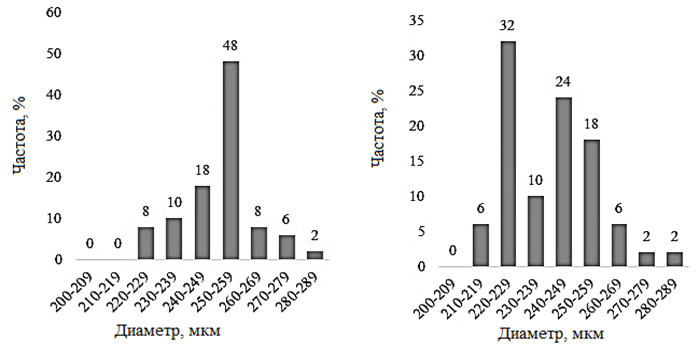
в г
д
Рис. 2. Распределение значений диаметра цист Artemia sp.:
а – Большое Шкло; б – Малиновое; в – Малое Яровое; г – Кулундинское
Fig. 2. Distribution of cysts diameter values of Artemia sp.:
а – Bol’shoe Shklo; б – Malinovoe; в – Maloe Yarovoe; г – Kulundinskoye
Рис. 2 (окончание). Распределение значений диаметра цист Artemia sp.: д – Кучукское
Fig. 2 (ending). Distribution of cysts diameter values of Artemia sp.: д – Kuchukskoye
В оз. Кулундинское отмечен наибольший среди исследованных озер диапазон варьирования – 71,4 мкм, среднее значение диаметра цист в популяции – 239,7 ± 15,0 мкм. Наибольший размер цист обнаружен в популяциях оз. Малое Яровое (250,3 ± 12,9 мкм) и Кучукское (250,6 ± 14,3 мкм). Коэффициент вариации размера цист в этих популяциях не превышал 5,70. Анализ распределения размеров цист в оз. Большое Шкло, Малиновое, Кулундинское и Кучукское показал незначительную асимметрию с коэффициентами (As) – 0,51; 0,38; 0,49 и –0,41. Для популяций артемии оз. Большое Шкло и Малиновое характерен отрицательный эксцесс (Ех – 0,69). В оз. Малое Яровое распределение размеров цист более всего приближено к нормальному (As – 0,09) с небольшим положительным эксцессом (Ех – 0,34).
Самые мелкие науплиусы были выведены из цист артемии, обитающей в оз. Большое Шкло (средний размер 412,9 ± 27,4 мкм) (табл. 4).
Таблица 4
Table 4
Линейные размеры науплиусов изученных популяций Artemia sp.
Linear dimensions of nauplii of the studied populations of Artemia sp.
|
Место обитания |
Линейные размеры науплиусов, мкм |
Достоверные различия |
||||
|
M ± σ* |
m |
min |
max |
CV |
||
|
Большое Шкло |
412,9 ± 27,4 |
2,7 |
357,1 |
485,7 |
6,6 |
Малиновое (р < 0,01) Малое Яровое (р < 0,01) Кулундинское (р < 0,01) Кучукское (р < 0,01) |
|
Малиновое |
440,4 ± 23,6 |
2,4 |
357,1 |
485,7 |
5,4 |
Большое Шкло (р < 0,01) Малое Яровое (р < 0,01) Кулундинское (р < 0,01) Кучукское (р < 0,01) |
|
Малое Яровое |
454,7 ± 26,9 |
2,7 |
371,4 |
514,3 |
5,9 |
Большое Шкло (р < 0,01) Малиновое (р < 0,01) Кучукское (р < 0,05) |
|
Кулундинское |
455,6 ± 28,2 |
2,8 |
357,1 |
514,3 |
6,2 |
Большое Шкло (р < 0,01) Малиновое (р < 0,01) Кучукское (р < 0,01) |
|
Кучукское |
463,3 ± 24,6 |
2,5 |
385,7 |
514,23 |
5,3 |
Большое Шкло (р < 0,01) Малиновое (р < 0,01) Малое Яровое (р < 0,05) Кулундинское (р < 0,05) |
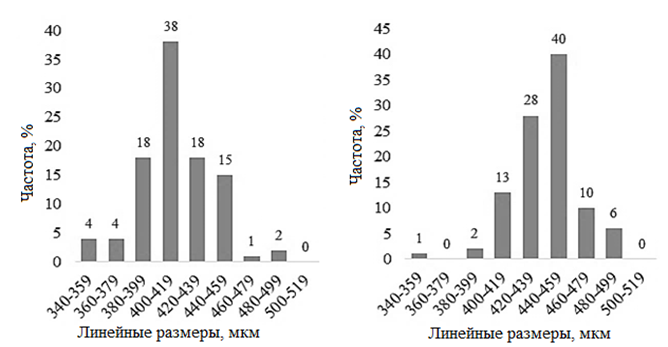
Минимальный размер науплиусов из популяции оз. Большое Шкло составлял 357,1 мкм, максимальный – 485,7 мкм, при этом большая часть науплиусов (89 %) имела размер от 380 до 460 мкм (рис. 3).
а б
в г
д
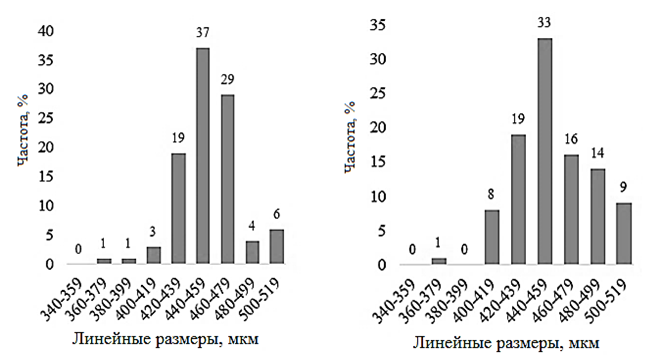
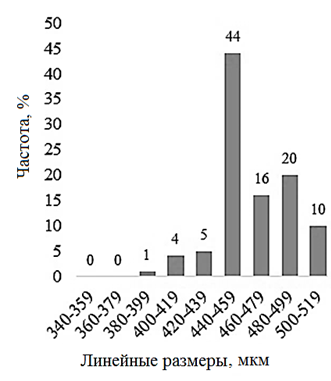
Рис. 3. Распределение значений линейных размеров науплиусов Artemia sp. изученных популяций:
а – Большое Шкло; б – Малиновое; в – Малое Яровое; г – Кулундинское; д – Кучукское
Fig. 3. Distribution of values of linear sizes of nauplius Artemia sp. studied populations:
а – Bol’shoe Shklo; б – Malinovoe; в – Maloe Yarovoe; г – Kulundinskoye; д – Kuchukskoye
Размеры науплиусов оз. Большое Шкло достоверно (р < 0,01) отличались от всех остальных изучаемых популяций. Немного больше были науплиусы оз. Малиновое, 91 % науплиусов имели размеры
в диапазоне от 400 до 480 мкм. Наибольший средний размер науплиусов был получен в популяции оз. Кучукское (463,3 ± 24,6 мкм): 90 % рачков имели размеры от 440 до 520 мкм. Анализ распределения значений линейной длины науплиусов в оз. Большое Шкло, Малое Яровое, Кулундинское и Кучукское показал почти симметричное распределение полученных данных: As – 0,07; 0,09; 0,06 и –0,01. Для размеров науплиусов оз. Малиновое определена существенная левосторонняя асимметрия распределения данных с коэффициентом (As) – 0,40 при р < 0,05. В изученных нами популяциях между диаметром цист и линейным размером науплиусов была обнаружена достоверная сильная положительная корреляционная связь (r = 0,70 при р < 0,05), при этом зависимость средней длины науплиусов от среднего диаметра цист в изученных популяциях является линейной (рис. 4).
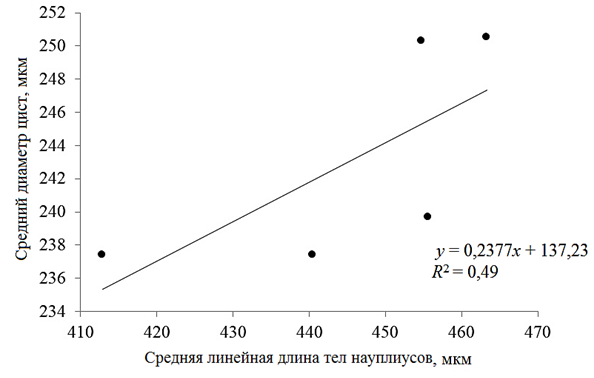
Рис. 4. Зависимость средней линейной длины тела науплиусов от среднего размера цист
Artemia sp. в изученных популяциях
Fig. 4. Dependence of the average linear body length of nauplii
on the average diameter of cysts Artemia sp. in the studied populations
Выводимость цист артемии при различной солености инкубационной среды. Для популяций артемии из оз. Малиновое, Кулундинское и Кучукское наиболее благоприятной для выведения науплиусов была среда с концентрацией 25 г/л (табл. 5).
Таблица 5
Table 5
Выводимость науплиусов рачка Artemia sp. из гипергалинных озер Кулундинской равнины
при различных концентрациях соли в инкубационной среде
Hatchability of naupliuses of Artemia sp. crustacean in hypergaline lakes of the Kulunda Plain
at different salt concentrations in the incubation medium
|
Место обитания популяции |
Концентрация NaCl, г/л |
Выводимость, % |
Концентрации |
|||
|
M ± σ |
m |
min |
max |
|||
|
Большое Шкло |
10 |
46,17 ± 2,00 |
1,16 |
43,9 |
47,7 |
* |
|
25 |
46,47 ± 1,90 |
1,10 |
44,5 |
48,3 |
* |
|
|
35 |
44,70 ± 1,80 |
1,04 |
42,7 |
46,2 |
* |
|
|
Малиновое |
10 |
82,93 ± 2,00 |
1,14 |
80,7 |
84,4 |
* |
|
25 |
86,50 ± 1,55 |
0,90 |
85,0 |
88,1 |
35 (р < 0,05) |
|
|
35 |
81,70 ± 1,67 |
0,96 |
80,2 |
83,5 |
25 (р < 0,05) |
|
|
Малое Яровое |
10 |
88,87 ± 0,42 |
0,24 |
88,4 |
89,2 |
35 (р < 0,01) |
|
25 |
88,83 ± 1,17 |
0,68 |
87,5 |
89,7 |
35 (р < 0,01) |
|
|
35 |
84,33 ± 0,97 |
0,56 |
83,5 |
85,4 |
10, 25 (р < 0,01) |
|
Окончание табл. 5
Ending of Table 5
|
Место обитания популяции |
Концентрация NaCl, г/л |
Выводимость, % |
Концентрации |
|||
|
M ± σ |
m |
min |
max |
|||
|
Кулундинское |
10 |
49,07 ± 1,63 |
0,94 |
47,2 |
50,2 |
25, 35 (р < 0,05) |
|
25 |
55,83 ± 1,45 |
0,84 |
54,4 |
57,3 |
10 (р < 0,05) |
|
|
35 |
52,97 ± 0,83 |
0,48 |
52,3 |
53,9 |
10 (р < 0,05) |
|
|
Кучукское |
10 |
79,20 ± 1,31 |
0,76 |
77,7 |
80,1 |
25 (р < 0,05) |
|
25 |
84,20 ± 1,41 |
0,81 |
82,9 |
85,7 |
10, 35 (р < 0,05) |
|
|
35 |
81,30 ± 1,23 |
0,71 |
80,8 |
82,5 |
10, 25 (р < 0,05) |
|
* Значения недостоверны.
Достоверные различия обнаружены для популяции оз. Малиновое между средами с концентрациями 25 и 35 г/л при р < 0,05. Для популяций артемии оз. Кулундинское и Кучукское достоверные различия выводимости были определены для всех вариантов инкубационной среды. Цисты оз. Малое Яровое имели аналогичный выход науплиусов в инкубационных средах с 10 и 25 г/л пищевой соли. При концентрации 35 г/л выводимость науплиусов была достоверно ниже при р < 0,01. Цисты оз. Большое Шкло показали идентичную выводимость во всех изученных концентрациях соли.
Обсуждение результатов
Широкий диапазон колебаний температурных условий, общей минерализации воды, состава ионов и различного их соотношения в континентальных биотопах приводит к появлению множества популяций с различными морфологическими, биохимическими и физиологическими характеристиками, которые связаны с комплексом экологических особенностей гипергалинных водоемов. Межпопуляционные различия морфологических характеристик артемии поддерживаются географической изоляцией, которая способствует выработке толерантности к определенному составу и концентрации ионов маточного водоема [19, 20].
Соленость среды обитания – важный морфообразующий фактор для рачков артемии [7, 21]. В лабораторных экспериментах показано, что ростовые параметры взрослых самок артемии зависят от концентрации и времени экспозиции рачков в определенной концентрации соли [22]. Размеры цист и науплиусов обусловлены генетическими характеристиками популяции, но имеют зависимость от параметров окружающей среды опосредованно через материнских особей. По этой причине между разными выборками в одной и той же популяции может существовать значительная разница биометрических характеристик цист и науплиусов [23]. Исследования диаметра цист артемии из оз. Малое Яровое показали значительную вариабельность межгодовых значений в популяции. Средние значения диаметра цист изменялись в пределах от 226 до 256 мкм [24]. Полученные нами результаты по биометрии цист оз. Малое Яровое (250,3 ± 12,9 мкм) находятся в диапазоне размеров, определенных ранее для этой популяции.
В результате исследований Р. Vanhaecke и Р. Sorgeloos [25] цисты из 32 бисексуальных и партеногенетических популяций были классифицированы на 3 группы:
1) самые маленькие цисты, относящиеся к популяции Adelaide (Австралия) и артемии из залива Сан-Франциско – 225,5 и 235,6 мкм соответственно;
2) самые большие цисты с диаметром от 267,0 до 284,9 мкм из партеногенетических популяций Китая, Франции, Италии и Индии;
3) популяции с цистами среднего размера, но с тонким хорионом характерны для штаммов A. franciscana Kellogg, 1906 (бисексуальная популяция), из озер Чаплин и Большого Соленого озера
с диаметром 240,0 мкм и 244,2–252,2 мкм соответственно.
Авторы предположили, что наибольший диаметр цист обусловлен партеногенезом [24]. Более поздние исследования показали, что в партеногенетических популяциях также могут быть относите-
льно небольшие цисты – 243,1 мкм [23], а самые крупные цисты были обнаружены в бисексуальной популяции A. tibetiana (323–330 мкм) [26]. Цисты A. urmiana на различных участках оз. Урмия в Иране имели средний диаметр от 262,7 до 286,6 мкм, а общая длина науплиусов – 466,3–505,0 мкм. При этом в данном озере обитают как бисексуальные, так и партеногенетические популяции с различной плоидностью: 2n, 4n и 5n [27]. Исследованные нами цисты из популяций артемии оз. Большое Шкло, Малиновое, Кулундинское, Малое Яровое и Кучукское имеют размеры, сравнимые с цистами A. franciscana и A. urmiana.
Различия размеров цист в партеногенетических популяциях многие авторы связывают с уровнем плоидности рачков. В популяции из Намибии (размер цист 246,7 мкм) основная часть клеток у рачков имеет диплоидный набор хромосом (2n = 42), а в популяции из Мадагаскара (размер цист 258,9 мкм) – триплоидный (3n = 63) [28]. В партеногенетических популяциях могут встречаться диплоидные (2n = 42), триплоидные (3n = 63), тетраплоидные (2n = 84) и пентаплоидные (2n = 105) организмы [1, 29]. Увеличение числа хромосом, как правило, способствует увеличению размера клеток, что может привести
к изменению морфологии, а именно – к увеличению биометрических параметров [28, 30].
Для популяций оз. Кулундинское, Кучукское и Малое Яровое был установлен широкий спектр чисел хромосом в клетках науплиусов артемии – от гаплоидного до пентаплоидного. У рачков, обитающих в оз. Малое Яровое (2006 г.), 73,7 % диплоидных (2n), 13,2 % триплоидных (3n), 2,3 % тетраплоидных (4n), 0,8 % пентаплоидных (5n) особей; в оз. Кучукское (2006 г.) 21,0 % диплоидных; 20,0 % триплоидных; 51,0 % тетраплоидных и 6,0 % пентаплоидных особей. Популяция оз. Кулундинское (2002, 2003 гг.) преимущественно (93,0–97,6 %) состоит из диплоидных рачков [30]. Полученные нами данные показали, что цисты артемии из оз. Кулундинское имеют меньший размер, чем в оз. Кучукское и Малое Яровое. В настоящее время взаимосвязь между степенью плоидности и размером цист не доказана, и их размер, скорее всего, обусловлен совокупным влиянием степени плоидности и параметров среды обитания популяции.
Соленость среды обитания – одна из наиболее важных переменных гипергалинных озер, которая контролирует жизненный цикл популяций артемии [31]. Несмотря на высокую степень эвригалинности артемии, для каждой популяции существует оптимальный (комфортный) диапазон солености, определяющий максимальную выживаемость, скорость роста, продолжительность жизни и продуктивность рачков [7]. В результате многолетних исследований продуктивности озер Алтайского края были определены оптимальные уровни минерализации для продукции цист в 25 популяциях (рис. 5).
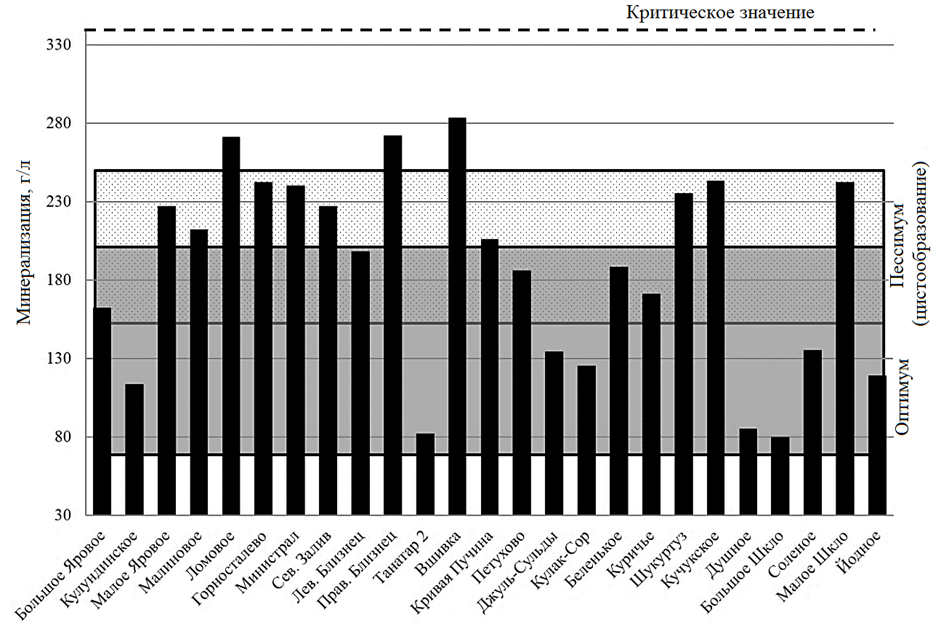
Рис. 5. Уровень минерализации воды в гипергалинных озерах Алтайского края
для периода активной жизнедеятельности в популяциях рачка Artemia sp.
Fig. 5. Level of water mineralization in hyperhaline lakes of Altai
for the period of active life in populations of the crustacean Artemia sp.
Уровень солености в среде оказывает значительное влияние на процесс выхода цист из диапаузы и на их выводимость. Для появления науплиусов в водоеме необходимо значительное разбавление рассолов, которое происходит при поступлении пресной воды с дождями, при таянии снега и льда, притока пресных поверхностных вод с прибрежной территории. Активный метаболизм в инцистированных эмбрионах артемии может быть инициирован только при низкой солености окружающей среды, способной обеспечить достаточное увлажнение цисты [32].
Полученные нами данные по выведению науплиусов при разной солености согласуются с результатами других авторов, которые показали, что разные популяции артемии могут иметь различный отклик на изменение солености инкубационной среды. В лабораторных экспериментах цисты A. franciscana из Португалии показали наибольший выход науплиусов при минерализации 50 г/л, в то время как в популяциях из Испании и США – при 25 г/л [33]. Исследования G. Alal и R. J. Olendi [34] показали влияние различных концентраций поваренной соли (4, 28 и 40 г/л) на выводимость и выживаемость науплиусов A. salina (Linnaeus, 1758). Наибольший выход науплиусов и значительно большая выживаемость (50 дней) оказалась у науплиусов, инкубированных при солености 40 г/л. У науплиусов, инкубированных при солености 28 и 4 г/л, выживаемость науплиусов составила 9 дней и 22 ч соответственно.
Сравнительные исследования выводимости цист различного происхождения показывают значительное варьирование процента, скорости, эффективности выведения и выживаемости науплиусов при различной солености. В то же время температура, освещенность и рН могут изменять действие солености на всех этапах жизни жаброногих ракообразных [35, 36].
Заключение
Установлены достоверные межпопуляционные различия биометрических характеристик Artemia sp. во всех изученных озерах. Вариабельность биометрических параметров науплиусов и цист артемии обусловлена обнаруженными в исследовании физико-химическими различиями условий обитания каждой изученной популяции.
Средние значения диаметра цист исследованных нами популяций находились в пределах 237,4 ± 11,8 (оз. Малиновое) – 250,6 ± 14,3 мкм (оз. Кучукское), средние значения линейных размеров науплиусов (Instar I) – в пределах 412,9 ± 27,4 (оз. Большое Шкло) – 465,3 ± 24,6 мкм (оз. Кучукское). Между размерами цист и науплиусов исследованных популяций артемии установлена высокая положительная корреляционная связь.
Оптимальные параметры среды для выведения науплиусов варьируют в зависимости от происхождения популяции. Различия условий выводимости науплиусов артемии следует принимать во внимание в ходе экспериментов, и особенно для успешной инкубации и культивирования артемии на рыбоводных предприятиях.
1. Abatzopoulos T. J., Beardmore J. A., Clegg J. S., Sorgeloos P. Artemia: basic and applied biology. Nether-lands: Kluwer Academic Publishers, 2002. 286 r.
2. Van Stappen G., Sui L., Hoa V. N. Tamtin M., Nyonje B., de Medeiros R. R., Sorgeloos P., Gajardo G. Review on integrated production of the brine shrimp Artemia in solar salt ponds // Reviews in Aquaculture. 2020. V. 12. N. 2. P. 1054–1071. https://doi.org/10.1111/raq.12371.
3. Asem A., Eimanifar A., Rastegar-Pouyani N., Hontoria F., De Vos S., Van Stappen G., Shi-Chun Sun. An overview on the nomenclatural and phylogenetic problems of native Asian brine shrimps of the genus Artemia Leach, 1819 (Crustacea, Anostraca) // ZooKeys. 2020. V. 902. P. 1–15. https://doi:https://doi.org/10.3897/zookeys.902.34593.
4. Shadrin N., Anufriieva E. Review of the biogeography of Artemia Leach, 1819 (Crustacea: Anostraca) in Russia // International Journal of Artemia Biology. 2012. V. 2. N. 1. P. 51–61.
5. Vesnina L. V., Lukerina G. V., Ronzhina T. O., Savos'kin A. V., Surkov D. A. Morfometricheskie issledovaniya samcov artemii iz raznyh populyaciy gipergalinnyh vodoemov Altayskogo kraya // Pybnoe hozyaystvo. 2020. № 2. S. 74–80. https://doi.org/10.33920/sel-09-2007-03.
6. Shadrin N., Anufriieva E., Galagovets E. Distribution and historical biogeography of Artemia Leach 1819 (Crustacea: Anostraca) in Ukraine // Int. J. Artemia Biology. 2012. V. 2. N. 2. P. 30–42.
7. Triantaphyllidis G. V., Poulopoulou K., Abatzopoulos T. J., Pinto Pérez C. A., Sorgeloos P. Salinity effects on survival, maturity, growth, biometrics, reproductive and lifespan characteristics of a bisexual and a parthenogenetic population of Artemia // Hydrobiologia. 1995. V. 302. P. 215–227.
8. Asem A., Sun S. SEM study of diversity in the cyst surface topography of nine parthenogenetic Artemia (Crustacea: Anostraca) populations from China // Microscopy Research and Technique. 2014b. V. 77. P. 1005–1014. https://doi. org/10.1002/jemt.22429.
9. Moruzi I. V., Pishchenko E. V., Djakovskay E. E., Kropachev D. V., Vibikov I. V., Vesnina L. V., Tokarev V. S., Farhod R. M. Biochemical Composition of Artemia Cysts Used as Food for Juvenile Fish from Different Hypersaline Lakes of the Altai Territory // Ekoloji. 2017. V. 26. N. 102. P. 1–4.
10. Sellami I., Ben Naceur H., Kacem A. Study of Cysts Biometry and Hatching Percentage of the Brine Shrimp Artemia salina (Linnaeus, 1758) from the Sebkha of Sidi El Hani (Tunisia) Accordin to Successive Generations // Aquaculture Studies. 2020. V. 21. N. 1. P. 41–46. https://doi. org/10.4194/2618-6381-v21_1_05.
11. Zhou J., Huang Z., Guo Y., Sun S. A Comparative Study on the Buoyancy of Resting Eggs from Different Artemia Populations, with Emphasis on Its Relationships with Habitat Salinity and Biometric Characters of Resting Eggs Environmental Science // Biology Journal of Ocean University of China. 2022. V. 21. N. 6. P. 1585–1596. https://doi. org/10.1007/s11802-022-5031-1.
12. Rukovodstvo po gidrobiologicheskomu monitoringu presnovodnyh ekosistem / pod red. V. A. Abakumova. SPb.: Gidrometeoizdat, 1992. 318 s.
13. Rukovodstvo po himicheskomu analizu poverhnostnyh vod sushi / pod red. L. V. Boevoy. Rostov n/D.: NOK, 2009. Ch. 1. 1032 s.
14. Ben Naceur H., Ben Rejeb Jenhani A., Romdhane M. S. Biometrical study of Artemia spp. (Anostraca: Artemiidae) cysts harvested from different salt lakes in Tunisia // North-Western Journal of Zoology. 2012. V. 8. N. 2. P. 308–314.
15. Castro J. M., Castro G. M., de Oliveira Costa D., Bridi R. Biometric comparison of four populations of Artemia franciscana Kellogg, 1906 (Crustacea: Anostraca) from Mexico and Peru // International Journal of Artemia Biology. 2013. V. 3. N. 1. P. 3–11.
16. Rahman M., Sorgeloos P. A training manual on Artemia cyst hatching and decapsulation. WorldFish, 2022. 32 p.
17. Pat. RF № 2352108C2. Sposob polucheniya naupliy artemii i kompoziciya dlya osuschestvleniya sposoba / Klepikov R. A.; zayavl. 30.12.2004; opubl. 20.04.2009.
18. Nikanorov A. M. Gidrohimiya. L.: Gidrometeoizdat, 1989. 351 s.
19. Asem A., Sun S. Biometric characterization of Chi-nese parthenogenetic Artemia (Crustacea: Anostraca) cysts, focusing on its relationship with ploidy and habitat altitude // North-Western Journal of Zoology. 2014. V. 10. N. 1. P. 149–157.
20. Triantaphyllidis G. V., Abatzopoulos T. J., Miasa E., Sorgeloos P. Characterization of two Artemia populations from Namibia and Madagascar: Cytogenetics, biometry, hatching characteristics and fatty acid profile // Hydrobiologia. 1996. V. 335. P. 97–106.
21. Solovov V. P., Studenikina T. L. Rachok artemiya v ozerah Zapadnoy Sibiri: morfologiya, ekologiya, perspektivy hozyaystvennogo ispol'zovaniya. Novosibirsk: Nauka, 1990. 42 s.
22. Mueller C. A., Willis E., Burggren W. W. Salt sensitivity of the morphometry of Artemia franciscana during development: a demonstration of 3D critical windows // Journal of Experimental Biology. 2016. V. 219. P. 571–581. https://doi.org/10.1242/jeb.125823.
23. Abatzopoulos T. J., Agh N., Van Stappen G., Razavi Rouhani S. M., Sorgeloos P. Artemia sites in Iran // Journal of the Marine Biological Association of the United Kingdom. 2006. V. 86. N. 2. P. 299–307. https://doi. org/10.1017/S0025315406013154.
24. Starovoytova D. A., Burmistrova O. S. Razmery cist i mikromorfologiya poverhnosti horiona cist v populyacii artemii ozera Maloe Yarovoe // Lomonosovskie chteniya na Altae: fundamental'nye problemy nauki i obrazovaniya: sb. nauch. st. Mezhdunar. konf. (Barnaul, 14–17 noyabrya 2017 g.). Barnaul: Izd-vo Altays. gos. un-ta, 2017. S. 1440–1446.
25. Vanhaecke P., Sorgeloos P. The biometrics of Artemia strains from different geographical origin // The Brine Shrimp Artemia. Wetteren: Universa Press, 1980. V. 3. Ecology. Culturing, Use in Aquaculture. P. 393–405.
26. Abatzopoulos T. J., Zhang B., Sorgeloos P. Artemia tiberiana: preliminary characterization of a new Artemia species found in Tibet (People’s Republic of China). International Study on Artemia. LIX // International Journal of Salt Lake Research. 1998. V. 7. P. 41–44.
27. Abatzopoulos T. J., Baxevanis A. D., Triantaphyl-lidis G. V., Criel G., Pador E. L., Van Stappen G., Sorgeloos P. Quality evaluation of Artemia urmiana Günther (Urmia Lake, Iran) with special emphasis on its particular cyst characteristics (International Study on Artemia LXIX) // Aquaculture. 2006. V. 254. Iss. 1–4. P. 442–454. https://doi.org/10.1016/j.aquaculture.2005.11.007.
28. Triantaphyllidis G. V., Abatzopoulos T. J., Miasa E., Sorgeloos P. Characterization of two Artemia populations from Namibia and Madagascar: Cytogenetics, biometry, hatching characteristics and fatty acid profile // Hydrobiologia. 1996. V. 335. P. 97–106.
29. Egorkina G. I., Pavlova E. K., Vereschagin A. L., Bychin N. V., Kirillov V. V., Romanova N. S. K voprosu ob identifikacii partenogeneticheskih populyaciy artemii v Sibirskom regione // Vestn. Altays. gos. un-ta. 2008. T. 6. № 44. C. 44–46.
30. Egorkina G. I., Romanova N. S., Bender Yu. A. Micromorphology of cyst chorion surface in Artemia parthenogenetic races of West Siberia: its functional and ecological importance // Advances in zoology research. 2012. V. 1. N. 6. P. 132–154.
31. Browne R. A., Wanigasekera G. Combined effects of salinity and temperature on survival and reproduction of five species of Artemia // Journal of Experimental Marine Biology and Ecology. 2000. V. 244. N. 1. P. 29–44. https:// doi.org/10.1016/S0022-0981(99)00125-2.
32. Rahman M. M., Hoa N. V., Sorgeloos P. Handbook for Artemia pond culture In Bangladesh. Malaysia: World-Fish, 2022. 72 r.
33. Speer F. W., Weider L. J. Examining population-specific hatching cues of salinity and light for Artemia franciscana // Hydrobiologia. 2018. V. 805. N. 1. P. 391–397. https://doi. org/10.1007/s10750-017-3326-9.
34. Alal G., Olendi R. J. Effect of different salinity levels on the hatchability and survival of brine shrimp, Artemia salina (Linnaeus, 1758) from Malindi, Kenya // African Journal of Education, Science and Technology. 2014. V. 3. N. 4. P. 1–6. https://doi.org/10.2022/ajest.v3i4.35.
35. Abatzopoulos T. J., El-Bermawi N., Vasdekis C., Baxevanis A. D., Sorgeloos P. Effects of salinity and tem-perature on reproductive and life span characteristics of clonal Artemia. International Study on Artemia. LXVI // Hydrobiologia. 2003. V. 492. P. 191–199. https://doi. org/10.1023/A:1024826702830.
36. Nargesi E. A., Falahatkar B., Abdollahpour H. The interaction of light intensity and pH on the hatching performance of Artemia franciscana in laboratory condition (in Persian) // Journal of Aquatic Ecology. 2017. V. 6. N. 4. P. 124–129.
















