Russian Federation
Russian Federation
Russian Federation
The results of experimental work on the treatment of beluga caviar with solutions of chemicals (0.9% sodium chloride, 0.05% hydrogen peroxide, 0.5% “Monclavit-1”, 0.01% “Iodinol”, 0.5% tannin), conducted with the aim of suppressing the growth and development of micromycetes sem. Saprolegniaceae, causing the disease of fish saprolegniosis. Saprolegnium micromycetes, affecting eggs during incubation, juveniles and adult fish, cause enormous damage to fish farms. Treatment of this disease is very difficult due to a number of restrictions imposed on the use of veterinary drugs in aquaculture. Evaluation of the effectiveness of the use of chemical solutions and their effects on the embryonic development of beluga (Huso huso) and the degree of infection of embryos with sem micromycetes. Saprolegniaceae was carried out according to fish-breeding and biological indicators (the proportion of fertilized eggs; the proportion of embryos infected with saprolegnium mycomycetes; the proportion of developing embryos; the number of abnormally developing oocytes and the proportion of hatched pre-larvae) at certain stages of development. Experimental work was carried out in production conditions in the incubation apparatus “Sturgeon” under optimal hydrochemical conditions for the development of beluga embryos. The experimental groups corresponded to the experimental concentrations of solutions. The most effective solutions that have an inhibitory effect on the growth and development of sem micromycetes. Saprolegniaceae, is a 0.05% solution of hydrogen peroxide with an exposure of 10 minutes and a 0.9% solution of sodium chloride with an exposure of 3 minutes. These solutions of substances suppressed the growth of saprolegnium micromycetes without adversely affecting the embryogenesis of beluga.
sturgeon caviar, beluga, chemical solutions, saprolegniosis, therapeutic and prophylactic treatment, embryos
Введение
Осетровые, в отличие от других видов рыб, характеризуются более высоким уровнем врожденного иммунитета и в естественной среде обитания относительно меньше подвержены заболеваниям [1]. В промышленных условиях с интенсивным темпом производства рыбоводы часто сталкиваются с такими инфекционными заболеваниями осетровых рыб, как микозы, вызываемыми, в частности, микромицетами рода Saprolegnia. Среди грибковых заболеваний сапролегниоз является одним из наиболее распространенных. Особенность возбудителя болезни образовывать устойчивые к неблагоприятным условиям зооспоры способствует их активному распространению как в водной среде, так и в биологических организмах [2]. У сапролегниевых микромицетов токсины не найдены и предполагается, что вред, наносимый ими, выражается в некрозе тканей хозяина в прилегающих к гифам участках [3]. Поражение оплодотворенных ооцитов и эмбрионов сапролегниевыми микромицетами в период инкубации в заводских условиях в ряде случаев может привести к их массовой гибели [4].
Для профилактики и лечения заболеваний рыб рекомендуют около 400 химических препаратов, однако большинство средств, в том числе и все органические красители (фиолетовый «К», малахитовый зеленый, метиленовый зеленый и т. д.), традиционно используемые в аквакультуре для борьбы с сапролегниозом, в настоящее время не входят в Государственный реестр лекарственных средств для ветеринарного применения [4]. Это обусловлено тем, что в результате исследований [5] выявлено токсическое и аккумулирующее действие на икру при ее обработке трифенилметановыми красителями в период инкубации. В настоящее время в Российской Федерации альтернативной замены этим препаратам нет [6].
Поиск средств защиты икры и рыб от микозов ведется в разных направлениях: повышение устойчивости хозяина, поиск антиспорулянтов и подавляющих рост сапролегнии штаммов бактерий и т. д. Преобладают работы, посвященные поиску химических веществ, имеющих фунгицидные и бактерицидные свойств [7–9].
Интенсивное развитие аквакультуры и ограничение использования органических красителей обуславливает необходимость проведения научных исследований, цель которых заключается в оценке эффективности применения химических веществ при лечебно-профилактической обработке икры, зараженной микромицетами сем. Saprolegniacea.
Для достижения цели были поставлены следующие задачи:
1. Изучить рыбоводно-биологические показатели эмбрионального развития белуги до и после лечебно-профилактических обработок икры.
2. Оценить степень заражения икры микромицетами сем. Saprolegniacea в экспериментальных группах после обработок растворами химических веществ.
Материал и методы исследований
Экспериментальные исследования проводили на научно-экспериментальной базе «БИОС» Волжско-Каспийского филиала Всероссийского научно-иссле-
довательского института рыбного хозяйства и океанографии. Объектом исследований являлись оплодотворенные ооциты и развивающиеся эмбрионы белуги (Huso huso) в период инкубации в аппаратах типа «Осетр» в условиях замкнутого водоснабжения.
Для обработки икры использовали растворы пероксида водорода и хлорида натрия, танина и двух лекарственных препаратов: «Йодинол» и «Монклавит-1». Концентрации и продолжительность обработки представлены в табл. 1.
Таблица 1
Table 1
Схема эксперимента и обозначение экспериментальной группы на графиках
в период инкубации икры белуги (Huso huso)
The scheme of the experiment and the designation of the experimental group on the graphs
during the incubation of beluga caviar (Huso huso)
|
№ опытной группы |
Вещество / лекарственное средство |
Концентрация раствора, % |
Экспозиция, мин |
|
1 |
Контроль* |
– |
– |
|
2 |
Натрия хлорид |
0,9 |
3,0 |
|
3 |
«Монклавит-1» |
0,5 |
10,0 |
|
4 |
«Йодинол» |
0,01 |
2,0 |
|
5 |
Пероксид водорода |
0,05 |
10,0 |
|
6 |
Танин |
0,5 |
1,5 |
* Группа, в которой икру не обрабатывали.
Инкубируемая икра распределялась по опытным группам в соответствии с экспериментальными растворами (см. табл. 1) в двух повторностях.
Обработку испытуемыми растворами осуществляли на двух стадиях развития (на 21–22 и 27–28 стадии) [7, 10] методом кратковременных лечебных ванн [8].
Оценку степени воздействия растворов испытуемых веществ на эмбриональное развитие осетровых рыб проводили по следующим параметрам: доля оплодотворенных ооцитов, доля выживших эмбрионов и вылупившихся предличинок [11], доля эмбрионов, зараженных микромицетами сем. Saprolegniaceae, и аномально развивающихся организмов [12]. Определения проводили с использованием микроскопа «Биомед МС-1 Стерео». Оплодотворение определяли на стадии 4 бластомеров – все икринки, которые на данной стадии имеют 4 клетки, считали развивающимися. Количество вылупившихся предличинок определяли весовым методом [11] на электронных весах (НТ-300) с точностью до 0,01 г. Результаты исследований подвергались статистической обработке с использованием программы Microsoft Excel.
Для определения условий в инкубационном цехе ежедневно проводили контроль за основными гидрохимическими показателями воды: температурой воды [13], содержанием в воде кислорода [14], активной реакцией среды рН [15], содержанием в воде аммонийного азота [16], нитритов [17], нитратов [18]. За технологические нормы состояния среды условно приняты обобщенные химические показатели воды хозяйств по выращиванию осетровых рыб и ПДК [19] (табл. 2).
Таблица 2
Table 2
Предельно допустимые значения химических показателей воды хозяйства
при проведении лечебно-профилактических обработок икры осетровых рыб
Maximum permissible values of chemical indicators of water of the farm
when carrying out therapeutic and preventive treatments of sturgeon caviar
|
Химические показатели воды |
Предельно допустимая концентрация (ПДК) |
|
t, оС |
10–24 |
|
O2, мг/л |
не ниже 4,0 |
|
O2, % |
90–100 |
|
рН, ед. |
7,0–8,0 |
|
NH4+, мг/л |
0,5 |
|
NO2–, мг/л |
0,1 (мягкая вода) 0,2 (жесткая вода) |
|
NO3–, мг/л |
1,0 |
Результаты и обсуждение
Условия инкубации икры. При оценке эффективности применения химических веществ для лечебно-профилактической обработки икры белуги (Huso huso) от сапролегниоза и полноценного развития эмбрионов необходим ежедневный контроль гидрохимических условий в процессе инкубации. Показатели гидрохимических условий воды в инкубационном цехе в период развития эмбрионов белуги представлены в табл. 3.
Таблица 3
Table 3
Гидрохимические показатели воды при инкубации икры белуги (Huso huso)
в инкубационных аппаратах типа «Осетр»
Hydrochemical parameters of water during incubation of beluga caviar (Huso huso)
in incubation devices of the “Sturgeon” type
|
Показатель |
Среднее значение, М ± m |
Min значение |
Max значение |
|
t, ºС |
14,3 ± 0,7 |
14,0 |
14,7 |
|
O2, мг/л |
8,9 ± 0,1 |
8,0 |
9,8 |
|
O2, % |
91,1 ± 5,8 |
98,0 |
104 |
|
рН, ед. |
8,3 ± 0,06 |
8,05 |
8,7 |
|
NH4+, мг/л |
0,2 ± 0,01 |
0,09 |
0,26 |
|
NO2–, мг/л |
0,03 ± 0,003 |
0,017 |
0,061 |
|
NO3–, мг/л |
1,57 ± 0,09 |
0,7 |
1,7 |
Установлено, что при оптимальных для развития эмбрионов значениях температуры воды (t) и растворенного кислорода (O2) водородный показатель (рН) и содержание нитратов (NO3–) превышали рекомендуемые нормы вследствие повышенных фоновых показателей воды из водоисточника (рукав Бахтемир), max – 8,7 ед., 1,7 соответственно.
Эмбриональное развитие икры. Наблюдение за эмбриональным развитием включало определение количества нормально развивающихся эмбрионов. Доля оплодотворенной икры в процессе инкубации составляла в среднем 88,8 ± 2,1 %. Полученные показатели не выходили за пределы рекомендуемых (средний процент оплодотворения – 85 %) [20].
Следует отметить, что развитие эмбрионов, полученных в результате использования половых продуктов хорошего рыбоводного качества, а также при соблюдении биотехники инкубации, проходит одновременно, в конце могут встречаться лишь единичные эмбрионы с большими желточными пробками неправильной формы. Если при развитии качественной икры наблюдаются значительные различия в размерах желточной пробки у зародышей, это может свидетельствовать о неблагоприятных условиях инкубации [19]. Также при развитии икры осетровых рыб возможно снижение количества развивающихся эмбрионов за счет элиминации слабых.
При обработке икры экспериментальными растворами различной концентрации и экспозиции может произойти гибель эмбрионов и из-за возможного негативного действия химических веществ или неправильно выбранной экспозиции. В связи с этим необходимо подобрать оптимальную концентрацию раствора и длительность его воздействия.
Соотношение развивающихся эмбрионов белуги до (14–15 стадии развития) и после (34–35 стадии развития) двукратной обработки растворами экспериментальных веществ изображено на рис. 1.
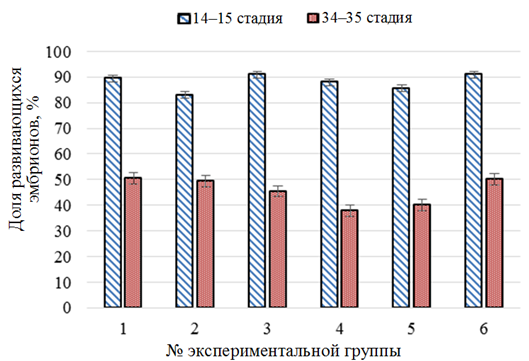
Рис. 1. Соотношение развивающихся эмбрионов в период инкубации икры белуги (Huso huso) в контроле (1),
при воздействии растворов хлорида натрия (2), «Монклавит-1» (3), «Йодинол» (4),
пероксида водорода (5) и танина (6)
Fig. 1. The ratio of developing embryos during incubation of beluga caviar (Huso huso) in the control (1),
when exposed to solutions of sodium chloride (2), “Monclavit-1” (3), “Iodinol” (4),
hydrogen peroxide (5) and tannin (6)
В опытных группах во время инкубации икры белуги при испытании натрия хлорида, «Монклавит-1», танина показатель развития эмбрионов был на уровне контрольной группы (50,5 ± 5,5 %), при испытании «Йодинола» и пероксида водорода – ниже контрольной группы – 38,0 ± 6,0 и 40,0 ± 2,0 % соответственно.
Аномалии в период эмбрионального развития икры. В период инкубации всех групп регистрировали синхронность развития зародышей, стадийный разброс развития не превышал более двух стадий в пробе. Аномально развивающихся эмбрионов регистрировали с 24–25 стадии развития. Их долю определяли на стадиях образования глазных выростов в переднем мозговом пузыре и образования утолщения в области общего зачатка заднетуловищного отдела хвоста (24–25 стадия) и на стадиях единичного и массового вылупления свободных эмбрионов (35–36 стадия).
Изменение доли аномально развивающихся эмбрионов белуги представлены на рис. 2.
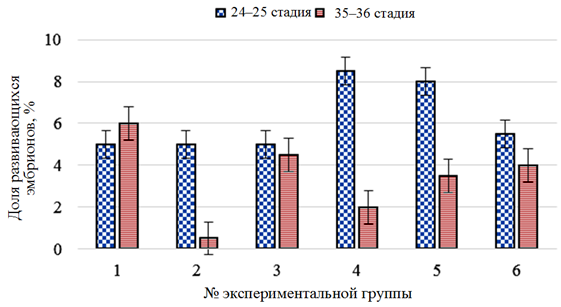
Рис. 2. Изменение доли аномально развивающихся эмбрионов в контроле (1),
при воздействии растворов хлорида натрия (2), «Монклавит-1» (3), «Йодинол» (4),
пероксида водорода (5) и танина (6) в период инкубации икры белуги (Huso huso)
Fig. 2. Changes in the proportion of abnormally developing embryos in the control (1),
when exposed to solutions of sodium chloride (2), “Monclavit-1” (3), “Iodinol” (4),
hydrogen peroxide (5) and tannin (6) during incubation of beluga caviar (Huso huso)
Аномалии, регистрируемые у эмбрионов белуги (Huso huso) на 24–25 стадиях развития до обработки растворами, в основном были морфологического характера: искривление тела или хвостового отдела, укороченное тело. Доля аномально развивающихся эмбрионов не превышала 8,5 % и отмечалась в опытной группе с применением раствора «Йодинол».
На этапе массового вылупления (35–36 ст.) разнообразие аномалий, выявленных у эмбрионов, повысилось, добавились следующие патологии: отсутствие глаз или пигмента, а также неправильное развитие желточного мешка. Число выявленных эмбрионов с максимальным значением в контрольной группе не превышало 6 %.
В целом количество эмбрионов белуги (Huso huso) с аномалиями в строении во всех экспериментальных группах составило не более 14 %, что говорит о хорошем качестве икры и об оптимальных условиях инкубации [4].
Определение степени заражения микромицетами сем. Saprolegniacea в период эмбрионального развития икры. Для определения эффективности применения экспериментальных растворов необходимо учитывать степень заражения микромицетами сем. Saprolegniacea. На интенсивность развития сапролегниевых микромицетов на икре влияет как показатель оплодотворения, так и количество мертвой икры, которая поражается микромицетами в первую очередь.
Сапролегниевые микромицеты начинают заражение с неоплодотворенных или мертвых яиц и быстро распространяются на здоровые яйца через положительный хемотаксис, вызывая снижение скорости вылупления. В ходе заражения сначала сапролегниевые микромицеты разрыхляют поверхности оболочек оплодотворенных икринок, происходит их деструкция и вакуолизация. В ряде случаев гифы инвазируют и внутреннее содержимое яиц [8].
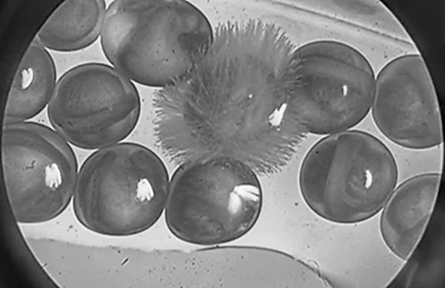
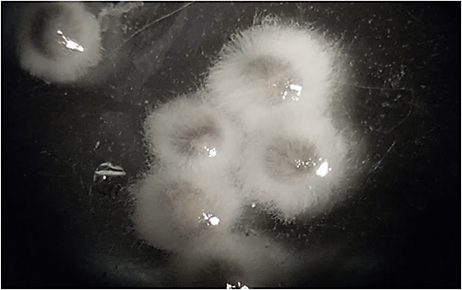
В процессе эксперимента пораженные сапролегнией икринки имели белый или сероватый цвет, чем легко отличались от прозрачных, нормально развивающихся (рис. 3).
|
|
|
а б
Рис. 3. Икра белуги (Huso huso), пораженная микромицетами сем. Saprolegniacea:
а – единичное заражение икры; б – массовое поражение икры
Fig. 3. Beluga caviar (Huso huso), affected by sam micromycetes. Saprolegniacea:
a – a single infection of the caviar; б – a massive lesion of the caviar
Заражение инкубируемой икры белуги сапролегниевыми микромицетами регистрировали с 24–25 стадии развития.
Изменение заражения инкубируемой икры белуги представлено на рис. 4.
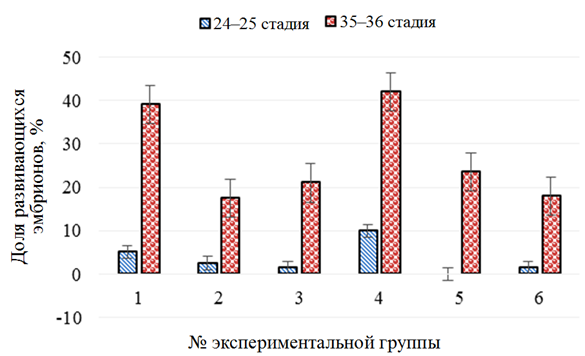
Рис. 4. Изменение доли зараженных эмбрионов в контроле (1), при воздействии растворов хлорида натрия (2), «Монклавит-1» (3), «Йодинол» (4), пероксида водорода (5) и танина (6)
в период инкубации икры белуги (Huso huso)
Fig. 4. Changes in the proportion of infected embryos in the control (1), when exposed to solutions of sodium chloride (2), “Monclavit-1” (3), “Iodinol” (4), hydrogen peroxide (5) and tannin (6)
during incubation of beluga caviar (Huso huso)
Максимальное заражение икры после двух последовательных воздействий экспериментальных растворов отмечено в группе с использованием раствора «Йодинол» (42,0 ± 8,0 %) и в контрольной группе (39,0 ± 1,0 %), минимальное – в группе с использованием растворов хлорида натрия (17,5 ± 0,5 %), танина (18,0 ± 3,0 %), «Монклавит-1» (21,0 ± 11,0 %) и пероксида водорода (23,5 ± 3,5 %).
Получение предличинок. Завершающим этапом исследований является получение предличинок. Это один из самых важных показателей для оценки эффективности применения лечебно-профилактических средств. По количеству живых подвижных эмбрионов (стадия 35) можно получить представление об ожидаемом выходе личинок. Доля вылупившихся предличинок представлена на рис. 5.
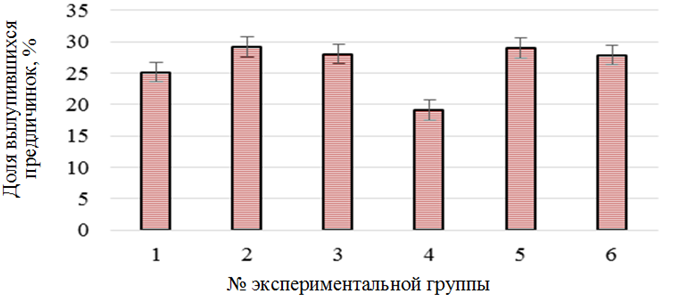
Рис. 5. Доля вылупившихся предличинок белуги (Huso huso) в контроле (1),
при воздействии растворов хлорида натрия (2), «Монклавит-1» (3), «Йодинол» (4),
пероксида водорода (5) и танина (6)
Fig. 5. The proportion of hatched prelarvae of beluga (Huso huso) in the control (1),
when exposed to solutions of sodium chloride (2), “Monclavit-1” (3), “Iodinol” (4),
hydrogen peroxide (5) and tannin (6)
Доля полученных предличинок белуги в большинстве опытных групп была несколько выше значений контрольной группы (25,2 ± 3,5 %), что говорит об отсутствии негативного влияния химических веществ на долю вылупившихся предличинок. Предличинки не отличались размерно-весовыми характеристиками от контрольной группы. Полученная молодь была переведена в пластиковые бассейны цеха с установкой замкнутого водоснабжения для дальнейшего выращивания.
Оценка эффективности применения растворов химических веществ (0,9 % хлорида натрия, 0,05 % пероксида водорода, 0,5 % «Монклавит-1», 0,01 % «Йодинол», 0,5 % танина) для лечебно-профилактической обработки икры белуги (Huso huso) от сапролегниоза проводилась по следующим показателям: эмбриональное развитие, в том числе аномалии, и степень зараженности микромицетами сем. Saprolegniacea.
При применении растворов для обработки эмбрионов белуги были получены следующие результаты:
– 0,9 % хлорида натрия с экспозицией 3 мин – эмбриональное развитие не отличалось от контрольной группы, аномалии составили 0,5 %, доля зараженной икры в 2,2 раза ниже относительно значений в контрольной группе, выход свободных эмбрионов увеличился на 4 %;
– 0,05 % пероксида водорода с экспозицией 10 мин – эмбриональное развитие было ниже относительно контрольной группы, аномалии составили 3,5 %, доля зараженной икры в 1,7 раза ниже относительно значений в контрольной группе, выход свободных эмбрионов увеличился на 3,8 %;
– 0,5 % «Монклавит-1» – эмбриональное развитие не отличалось от контрольной группы, аномалии составили 4,5 %, доля зараженной икры в 1,9 раза ниже относительно значений в контрольной группе, выход свободных эмбрионов увеличился на 2,9 %;
– 0,01 % «Йодинол» – эмбриональное развитие ниже на 12 % относительно контрольной группы, аномалии составили 2,0 %, доля зараженной икры на 3 % выше относительно значений в контрольной группе, выход свободных эмбрионов уменьшился на 6,1 %;
– 0,5 % танин – эмбриональное развитие не отличалось от контрольной группы, аномалии составили 4,0 %, доля зараженной икры в 2,2 раза ниже относительно значений в контрольной группе, выход свободных эмбрионов увеличился на 2,7 %.
Заключение
В результате из всех испытуемых растворов наиболее эффективными являются 0,05 %-й раствор пероксида водорода с экспозицией 10 мин и 0,9 %-й хлорида натрия с экспозицией 3 мин, обработка которыми позволила снизить долю зараженных эмбрионов на 34–35 стадии развития и повысить выход предличинок белуги на 3,8–4 %.
1. Borisova M. N., Pichugina T. D., Zav'ialova E. A., Droshnev A. E., Kolomytsev S. A. Bolezni ryb. Obzor epi-zooticheskoi situatsii za 2006 god [Diseases of fish. Review of the epizootic situation for 2006.]. Veterinarnaia zhizn', 2007, no. 14, pp. 2-3.
2. Isaeva N. M., Davydov O. N., Dudka I. S., Nebor-achek I. S. Mikozy i mikotoksikozy ryb [Mycoses and mycotoxicoses of fish]. Kiev, Izd-vo in-ta zoologii NAN Ukrainy, 1995. 168 p.
3. Castell J. D., Tiews K. Report of the EIFAC, IUS and ICES Worcing Group on the standardization of the method-ology in fish nutrition research. EIFAC Tech. pap. (Hamburg, Federal Republic of Germany, March 21-23, 1979). Hamburg, 1979. N. 36. Pp. 1-24.
4. Barinova V. V. Tekhnologicheskie aspekty povyshe-niia effektivnosti inkubatsii ikry osetrovykh vidov ryb. Dissertatsiya … kand. s.-kh. nauk [Technological aspects of increasing the efficiency of incubation of caviar of stur-geon fish species. Dis. ... Can. of Agricul. Scien.]. Astra-khan', 2022. 138 p.
5. Lavrukhina O. I., Amelin V. G., Prokhvatilova L. B., Ruchnova O. I. Riski zagriazneniia pishchevykh produktov na razlichnykh stadiiakh ikh proizvodstva [Risks of contamination of food products at various stages of their production]. Veterinariia segodnia, 2017, no. 3 (22), pp. 33-40.
6. Golovin P. P., Romanova N. N., Golovina N. A., Varaksina V. V. Problemy profilaktiki i terapii zabolevanii ryb v khoziaistvakh akvakul'tury: sovremennye trebovaniia i vozmozhnost' realizatsii [Problems of prevention and therapy of fish diseases in aquaculture farms: modern requirements and the possibility of implementation]. Sostoianie i puti razvitiia akvakul'tury v Rossiiskoi Federatsii v svete importozameshcheniia i obespecheniia prodovol'stvennoi bezopasnosti strany: materialy II Natsional'noi nauchno-prakticheskoi kon-ferentsii (Sankt-Peterburg, 13-15 sentiabria 2017 g.). Saratov, OOO «TseSAin» Publ., 2017. Pp. 14-20.
7. Nechaeva T. A. Otsenka effektivnosti primeneniia Monklavita-1 s tsel'iu povysheniia sokhrannosti inkubiruemoi ikry raduzhnoi foreli i zashchity ee ot saprolegnioza [Evaluation of the effectiveness of the use of Monclavit-1 in order to improve the safety of incubated rainbow trout caviar and protect it from saprolegniosis]. Voprosy normativno-pravovogo regulirovaniia v veterinarii, 2009, no. 4, pp. 41-43.
8. Rakhkonen R., Vennerstrem P., Ritamiaki P., Kannel R. Zdorovaia ryba. Profilaktika, diagnostika i lechenie boleznei [Healthy fish. Prevention, diagnosis and treatment of diseases]. Khel'sinki, Nykypaino Publ., 2012. 180 p.
9. Barinova V. V., Bakhareva A. A., Batalova R. R. Opredelenie stepeni vozdeistviia rastvorov khimicheskikh veshchestv raznoi kontsentratsii na rost i razvitie kul'tury mikromitsetov sem. Saprolegniaceae «in vitro» [Determination of the degree of influence of solutions of chemicals of different concentrations on the growth and development of the culture of micromycetes sem. Saprolegniaceae “in vitro”]. Vestnik Astrakhanskogo gosudarstvennogo tekhnicheskogo universiteta. Seriia: Rybnoe khoziaistvo, 2020, iss. 4, pp. 121-131.
10. Detlaf T. A., Ginzburg A. S. Zarodyshevoe razvitie osetrovykh ryb (sevriugi, osetra i belugi) v sviazi s voprosami ikh razvedeniia [Embryonic development of sturgeon fish (sturgeon, sturgeon and beluga) in connection with their breeding]. Moscow, Izd-vo Akademii nauk SSSR, 1954. 228 p.
11. Sbornik instruktsii i normativno-metodicheskikh ukazanii po promyshlennomu razvedeniiu osetrovykh ryb v Kaspiiskom i Azovskom basseinakh [Collection of instructions and regulatory guidelines for the industrial breeding of sturgeon fish in the Caspian and Azov basins]. Moscow, Izd-vo VNIRO, 1986. 271 p.
12. Akimova N. V., Goriunova V. B., Mikodina E. V., Ni-kol'skaia M. P., Ruban G. I., Sokolova S. A., Shagaeva V. G., Shatunovskii M. I. Atlas narushenii v gametogeneze i stroenii molodi osetrovykh [Atlas of disorders in gametogenesis and structure of juvenile sturgeon]. Moscow, Izd-vo VNIRO, 2004. 120 p.
13. RD 52.24.496-2018. Metodika izmerenii tempera-tury, prozrachnosti i opredeleniia zapakha vody [RD 52.24.496-2018. Method of measuring temperature, trans-parency and determination of the smell of water]. Rostov-on-Don, Izd-vo Gidrokhim. in-ta, 2018. 10 p.
14. RD 52.24.419-2005. Massovaia kontsentratsiia rastvorennogo kisloroda v vodakh. Metodika vypolneniia izmerenii iodometricheskim metodom [RD 52.24.419-2005. The mass concentration of dissolved oxygen in the waters. Method of performing measurements by the iodometric method]. Rostov-on-Don, Federal'naia sluzhba Rossii po gidrometeorologii i monitoringu okruzhaiushchei sredy, 2005. 21 p.
15. PND F 14.1:2:3:4.121-97. Kolichestvennyi khimicheskii analiz vod. Metodika vypolneniia izmerenii pH v vodakh potentsiometricheskim metodom [HDPE F 14.1:2:3:4.121-97. Quantitative chemical analysis of waters. Method of performing pH measurements in waters by the potentiometric method]. Moscow, FTsAO, 2016. 7 p.
16. PND F 14.1:2:3.1-95. Kolichestvennyi khimicheskii analiz vod. Metodika izmerenii massovoi kontsentratsii ionov ammoniia v prirodnykh i stochnykh vodakh fotometricheskim metodom s reaktivom Nesslera [HDPE F 14.1:2:3.1-95. Quantitative chemical analysis of waters. Method of measuring the mass concentration of ammonium ions in natural and wastewater by photometric method with Nessler reagent]. Moscow, FTsAO, 2017. 24 p.
17. RD 52.24.381-2017. Massovaia kontsentratsiia ni-tritov v vodakh. Metodika vypolneniia izmerenii fotometricheskim metodom s reaktivom Grissa [RD 52.24.381-2017. The mass concentration of nitrites in the waters. Method of performing measurements by photometric method with Griss reagent]. Rostov-on-Don, Izd-vo Gidrokhim. in-ta, 2017. 21 p.
18. RD 52.24.380-2017. Massovaia kontsentratsiia nitratov v vodakh. Metodika vypolneniia izmerenii fotomet-richeskim metodom s reaktivom Grissa posle vosstanovleniia v kadmievom reduktore [RD 52.24.380-2017. The mass concentration of nitrates in the waters. Method of performing measurements by photometric method with Griss reagent after reduction in a cadmium reducer]. Rostov-on-Don, Izd-vo Gidrokhim. in-ta, 2017. 28 p.
19. Chebanov M. S., Galich E. V. Rukovodstvo po iskusstvennomu vosproizvodstvu osetrovykh ryb [Manual on artificial reproduction of sturgeon fish]. Tekhnicheskie doklady FAO po rybnomu khoziaistvu i akvakul'ture. Ankara, FAO, 2011. N. 558. 297 p.
20. O vnesenii izmenenii v Metodiku rascheta ob"ema dobychi (vylova) vodnykh biologicheskikh resursov, ne-obkhodimogo dlia obespecheniia sokhraneniia vodnykh biologicheskikh resursov i obespecheniia deiatel'nosti ry-bovodnykh khoziaistv, pri osushchestvlenii rybolovstva v tseliakh akvakul'tury (rybovodstva), utverzhdennuiu pri-kazom Minsel'khoza Rossii ot 30 ianvaria 2015 goda № 25: prikaz Ministerstva sel'skogo khoziaistva Rossiiskoi Federatsii ot 25 avgusta 2015 g № 377 [On Amendments to the Methodology for Calculating the Volume of Extraction (Catch) of Aquatic Biological Resources Necessary to Ensure the Conservation of Aquatic Biological Resources and Ensure the Activities of Fish Farms when Fishing for Aquaculture (Fish Farming), approved by Order No. 25 of the Ministry of Agriculture of the Russian Federation dated January 30, 2015: Order of the Ministry of Agriculture No. 377 of the Russian Federation dated August 25, 2015]. Available at: http://www.consultant.ru/document/cons_doc_LAW_188208/2ff7a8c72de3994f30496a0ccbb1ddafdaddf518/ (accessed: 25.01.2023).