Russian Federation
Russian Federation
Russian Federation
Assessment of the physiological and immunological status of fish is an urgent problem of modern aquaculture. One of the methods of such assessment is based on hematological and biochemical studies. Blood is the most sensitive and informative indicator of changes occurring in the body of fish. It reacts quickly and acutely to the effects of various adverse environmental factors and can serve as one of the early indicators of a violation of the functional state of fish. The study of the effect of a probiotic drug on the enterosorbent “Florin forte” on hematological and biochemical blood parameters, in particular, on the level of hemoglobin, total serum protein, triglycerides, cholesterol, glucose, as well as on the distribution of shaped elements of peripheral blood of Bester (Huso huso × Acipenser ruthenus) was carried out on the basis of the Innovation Center “Bioaquapark – scientific andtechnical center of aquaculture” ASTU for 30 days. As a result of the conducted studies, it was noted that the use of the sorbed form of the probiotic drug has a positive effect on the physiological and immunological condition of the farmed fish. Thus, the blood of Bester's two-year-olds grown on compound feeds with the addition of probiotic enterosorbent was characterized by an increase in hemoglobin levels to 64.9 g/l, total whey protein to 23.6 g/l, as well as a decrease in cholesterol and glucose concentrations to 2.6 and 0.55 mmol/l, respectively. In the leukocyte formula of the studied fish, shifts in the quantitative ratios of leukocytes were found, confirming the body's reaction to the introduction of a probiotic drug on enterosorbent into the diet and considered as an adaptive mechanism that increases the protective function of the blood.
aquaculture, bester, probiotic-enterosorbent, hematological and biochemical studies, leukocyte blood formula
Введение
В настоящее время в условиях интенсивной аквакультуры наиболее важным фактором является тщательный контроль за физиолого-иммунологическим состоянием объектов выращивания [1]. Кровь и ее компоненты являются внутренней средой организма, образованной жидкой соединительной тканью. Любые изменения ее состава отражают метаболические процессы, протекающие в организме при воздействии на него внешней среды [2]. Кроме того, кровь представляет собой лабильную ткань, наиболее быстро реагирующую на воздействие различных факторов и способствующую восстановлению нарушений равновесия между организмом гидробионтов и средой их обитания. В связи с этим для ранней диагностики различных заболеваний, помимо ихтиопатологических и микробиологических исследований, проводят клинический и биохимический анализ крови. В аквакультуре при гематологических и биохимических исследованиях принято определять следующие показатели крови: уровень гемоглобина, скорость оседания эритроцитов, количественный показатель общего белка в сыворотке крови, уровень глюкозы, липидный профиль, количество эритроцитов и лейкоцитарную формулу [1].
Цель исследований – оценить влияние различных дозировок пробиотического препарата на энтеросорбенте «Флорин форте» на физиолого-иммуноло-
гическое состояние бестера.
Материал и методы исследований
Исследования проводились в экспериментальной установке замкнутого водоснабжения и в лабораториях кафедры «Аквакультура и водные биоресурсы» Астраханского государственного технического университета. В качестве объектов исследований выступили двухлетки бестера (Huso huso × Acipenser ruthenus) (рис. 1).

Рис. 1. Двухлетки бестера (Huso huso × Acipenser ruthenus)
Fig. 1. Bester two year olds (Huso huso × Acipenser ruthenus)
Для проведения исследований использовали поликомпонентный сорбированный пробиотический препарат «Флорин форте», представляющий собой комплекс бифидобактерий штамма Bifidobacterium bifidum 1 (5 · 107 КОЕ) и лактобактерий штамма Lactobacillus plantarum 8P-A3 (5 · 107 КОЕ), сорбированных на активированном угле.
Экспериментальное выращивание рыб осуществлялось в стеклопластиковых бассейнах типа ИЦА-1 согласно опубликованным нормативным документам [3]. Для кормления рыб использовали продукционные комбикорма рецептуры ОТ-7. Из исследуемых рыб были сформированы 4 группы: контрольная и 3 опытные. Экспериментальные дозировки препарата в комбикормах составили 4, 6, 8 г/кг комбикорма (1, 2, 3 опытная группа соответственно).
Оценка влияния пробиотического препарата на физиологический статус исследуемых рыб была проведена на основании анализа основных биохимических показателей крови, на иммунологический статус – на основании анализа лейкоцитарной формулы периферической крови.
Отбор крови производили прижизненно из хвостовой вены. Определение концентрации гемоглобина в крови проводили гемиглобинцианидным методом [4, 5], общего сывороточного белка – биуретовым методом [5], холестерина и триглицеридов – энзиматическим методом [6], глюкозы – энзиматическим колориметрическим методом без депротеинизации [7]. Для изучения лейкоцитарной формулы мазки крови окрашивали фиксатором-красителем по Май-Грюнвальду [8].
Полученные результаты подвергали обработке на основании общепринятых методов c использованием элементов статистического анализа [9, 10].
Результаты исследований
Проведение гематологических и биохимических исследований является одним из методов, используемых для оценки физиологического и иммунологического статуса рыб в аквакультуре. Анализ крови включает в себя измерение основных биохимических показателей крови, плазмы или сыворотки: например, уровня глюкозы, сывороточного белка, липидного профиля и т. д. Гематологические и биохимические показатели крови позволяют получить достоверную информацию
о способности рыб транспортировать кислород, об иммунном потенциале, уровне стресса, заболеваемости, интоксикации и т. д. [1].
Результаты проведенных исследований показали, что содержание гемоглобина в крови рыб опытной группы, в рационе которых содержался пробиотический препарат, превышало таковой показатель у рыб из контрольной группы. Концентрация гемоглобина в крови двухлеток бестера варьировала в пределах 59,5–64,9 г/л. В контрольном варианте данный показатель не превышал 57,9 г/л, что также соответствует биологической норме данного вида (см. рис. 1). Необходимо отметить, что уровень гемоглобина в крови рыб является индикатором реализации дыхательной функции, и его снижение может свидетельствовать о функциональной напряженности в системе обеспечения организма кислородом [11].
Общий белок выполняет в организме рыб разнообразные функции и служит основным источником энергии [11]. Согласно полученным результатам, уровень общего белка в сыворотке крови бестера, выращенного с использованием пробиотика-энтеросорбента, увеличился от начала эксперимента к его окончанию. Так, максимальное его значение наблюдалось во второй опытной группе и составило 23,6 г/л, в то время как в контроле данный показатель снизился на 0,8 г/л, что может быть связано с обменом веществ и обусловлено интенсивностью питания (рис. 2).
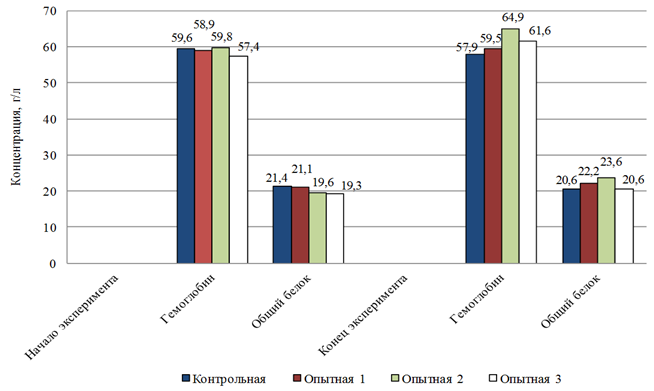
Рис. 2. Концентрация гемоглобина и общего белка в сыворотке крови бестера
Fig. 2. The level of hemoglobin and total protein in bester's blood serum
Вариабельность уровня холестерина в сыворотке крови осетровых рыб в значительной степени соизмерима с динамикой концентрации общего сывороточного белка [11, 12]. Следует отметить, что уровень холестерина у рыб контрольной группы был выше, чем у рыб из опытных групп, и составил 4,92 ммоль/л. Кроме того, установлено, что у бестера, выращенного с использованием сорбированного пробиотического препарата, наблюдалось снижение данного показателя к концу эксперимента до 2,60 ммоль/л.
Наиболее частым показателем углеводного обмена у рыб является содержание глюкозы в сыворотке крови [11]. Глюкоза используется для получения энергии и является эффективным показателем протекания обменных процессов в организме. Повышение уровня глюкозы в крови рыб происходит в ответ на факторы, вызывающие стрессовые реакции. Кроме того, глюкоза является важным субстратом для метаболизма клеток, в частности клеток головного мозга. Установлено, что для опытных групп была характерна тенденция к снижению концентрации глюкозы в сыворотке крови двухлетков бестера к концу экспериментального исследования. Так, у рыб первой опытной группы (4 г/кг) произошло понижение данного показателя в 1,5 раза, у второй (6 г/кг) – в 1,3 раза, в третьей (8 г/кг) – в 2,2 раза, однако полученные различия не были достоверны (рис. 3).
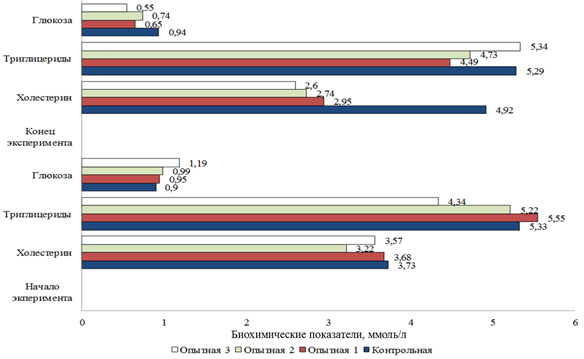
Рис. 3. Биохимические показатели крови бестера
Fig. 3. Biochemical parameters of bester's blood
Таким образом, применение пробиотического препарата на энтеросорбенте «Флорин форте» оказало положительное влияние на показатели крови двухлетков бестера, выраженное в повышении уровня гемоглобина, общего белка, снижении концентрации холестерина и глюкозы.
Одним из информативных показателей иммунологического состояния рыб является лейкоцитарная формула крови. Соотношение лейкоцитов в лейкоцитарной формуле крови отражает не только состояние неспецифического иммунитета, в частности клеточного, но и является характеристикой функционального состояния организма рыб [13]. Анализ лейкоцитарной формулы периферической крови двухлетков бестера представлен в таблице.
Лейкоцитарная формула периферической крови бестера, %
The leukocyte formula of bester's peripheral blood, %
|
Показатель |
Группа |
|||
|
Контрольная |
Опытная 1 |
Опытная 2 |
Опытная 3 |
|
|
Лимфоциты |
70,68 ± 2,98 |
74,71 ± 3,31 |
76,73 ± 1,97 |
75,63 ± 2,14 |
|
Моноциты |
4,31 ± 0,24 |
3,89 ± 0,64 |
3,32 ± 0,52 |
3,36 ± 0,47 |
|
Палочкоядерные нейтрофилы |
20,79 ± 1,14 |
16,29 ± 1,02 |
14,07 ± 0,98 |
15,53 ± 1,31 |
|
Сегментоядерные нейтрофилы |
2,15 ± 0,12 |
2,96 ± 0,32 |
3,15 ± 0,27 |
2,98 ± 0,32 |
|
Эозинофилы |
2,07 ± 0,41 |
2,15 ± 0,24 |
2,73 ± 0,36 |
2,50 ± 0,18 |
Полученная лейкоцитарная формула крови подтвердила хорошее физиологическое состояние исследуемых рыб. Обнаружено, что белая кровь носила ярко выраженный лимфоидный характер. Так, количество лимфоцитов варьировало в пределах 70,68–76,73 %, количество моноцитов было незначительным и не превышало 4,31 %. Кроме того, в лейкоцитарном профиле крови рыб отмечено, что значительную часть лейкоцитов составляли палочкоядерные (14,07–20,79 %) и сегментоядерные (2,15–3,15 %) нейтрофилы.
В результате анализа установлено, что сдвиг лейкоцитарной формулы крови двухлетков бестера находился в пределах физиологической нормы, что подтверждает отсутствие различного рода патологических и воспалительных реакций в организме выращиваемых рыб.
Заключение
По полученным в ходе экспериментальных исследований результатам можно сделать вывод о том, что использование сорбированной формы пробиотического препарата «Флорин форте» при кормлении осетровых рыб оказывает положительное влияние на их физиолого-иммунологическое состояние. Так, у рыб, получавших пробиотический препарат в различных дозировках, наблюдалось увеличение гематологических и биохимических показателей крови. Уровень гемоглобина у рыб опытных групп повысился до 59,5–64,9 г/л, общего белка до 20,6–23,6 г/л, при этом уровень холестерина снизился на 0,48–0,97 ммоль/л.
Анализ лейкоцитарной формулы периферической крови двухлетков бестера позволил установить, что популяция лейкоцитов была представлена лимфоцитами и моноцитами, относящимися к агранулоцитам, и нейтрофилами, и эозинофилами, относящимися к гранулоцитарному ряду, находящимися на различных стадиях развития. Обнаружено, что лимфоциты занимали доминирующее положение как в контрольной (70,68 %), так и в опытных группах (74,71–75,63 %). Установлено, что пробиотик-энтеросорбент «Флорин форте» способствовал активизации функции существующих лимфоцитов, но не вызывал стимуляцию появления новых лимфобластных клеток.
1. Golovina N. A. Ispol'zovanie gematologicheskikh pokazatelei dlia otsenki fiziologicheskogo sostoianiia orga-nizma ryb [The use of hematological indicators to assess the physiological state of the body of fish]. Akvakul'tura i zdorov'e ryb: Rossiisko-Amerikanskii simpozium (12-19 iiulia 1998 g.). Moscow, Izd-vo VNIIPRKh, 1998. Pp. 137-138.
2. Puchkov N. V. Fiziologiia ryb [Physiology of fish]. Moscow, Pishchepromizdat, 1954. 370 p.
3. Ponomarev S. V., Grozesku Iu. N., Bakhareva A. A. Industrial'noe rybovodstvo [Industrial fish farming]. Saint-Penersburg, Lan' Publ., 2013. 420 p.
4. Van Kampen E. J., Zjilstra W. G. Standardization of hemoglobinometry. The hemiglobincyanide method. Clin. Chim. Acta, 1961. 538 p.
5. Filippovich Iu. B., Egorova T. A., Sevast'ianova G. A. Praktikum po obshchei biokhimii [Workshop on general biochemistry]. Moscow, Prosveshchenie Publ., 1975. 318 p.
6. Fishbach F., Dunning M. A manual of laboratory diagnostic tests. Lppincott Williams & Wilkins, 2004. 1291 p.
7. Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann. Clin. Biochem., 1969, pp. 24-25.
8. Abramov M. G. Gematologicheskii atlas [Hemato-logical Atlas]. Moscow, Meditsina Publ., 1985. 344 p.
9. Katmakov P. S., Gavrilenko V. P., Bushov A. V. Biometriia [Biometrics]. Moscow, Iurait Publ., 2019. 177 p.
10. Lakin G. F. Biometriia [Biometrics]. Moscow, Vysshaia shkola Publ., 1990. 293 p.
11. Matishov G. G., Kokoza A. A., Metallov G. F., Geraskin P. P. Kompleksnyi podkhod k probleme sokhraneniia i vosproizvodstva osetrovykh ryb Kaspiiskogo moria [An integrated approach to the problem of conservation and reproduction of sturgeon fish of the Caspian Sea]. Rostov-on-Don, Izd-vo IuNTs RAN, 2017. 352 p.
12. Metallov G. F., Geraskin P. P., Aksenov V. P., Lev-ina O. A. Mnogoletnii monitoring fiziologicheskogo so-stoianiia osnovnykh vidov kaspiiskikh osetrovykh ryb [Long-term monitoring of the physiological state of the main Caspian sturgeon species]. Vestnik Astrakhanskogo gosudarstvennogo tekhnicheskogo universiteta. Seriia: Rybnoe khoziaistvo, 2016, no. 1, pp. 88-97.
13. Zhandalgarova A. D., Bakhareva A. A., Grozesku Iu. N., Akhmedzhanov A. B. Opyt primeneniia piobakteriofaga polivalentnogo ochishchennogo (Pyobasteriophagum polyvalentum purum) v akvakul'ture [Experience of application of polyvalent purified pyobacteriophage (Pyobacteriophagum polyvalentum purum) in aquaculture]. Rybnoe khoziaistvo, 2021, no. 4, pp. 7680.
















