Russian Federation
The optimal formula for calculating the total number of hemocytes (HTN) of the Australian red-claw crayfish (Cherax quadricarinatus) has been established, which allows optimizing the time of counting HTN without re-ducing accuracy. Methodical recommendations on preparing a hemolymph sample, HTN calculation and differentiated calculation of hemocytes are given. It was found out that the differences in HTN are minimal when using different formulas, which is con-firmed by the analysis of variance F = 0.011, p = 0.998, the average values of HTN range from 2 384 to 2 427 cell/µl. Conducting multiple comparisons also demonstrated that the differences between the formulas are minimal: the significance levels between the formulas were p = 0.99. The optimal formula for the Australian red-claw crayfish is: HTN in 1 µl = N • 10, where N is the total number of hemocytes in 25 large squares of Gorjaev’s chamber. The counting chamber should be clean, since when even small dust particles are found on the grid, hemocyte clusters can form and impede counting, or the result of the calculation will be incorrect, because the distribution of hemocytes on the grid will not be uniform. After filling the chamber with hemolymph, it is recommended to wait 1-1.5 minutes so that the movement of the hemolymph stops and the hemocytes stop moving. It is recommended to use an anticoagulant, which prevents the rapid decay of cells and promotes their uniform distribution on the grid of the chamber without developing clots (clusters) that affect the accuracy of counting. Working with the whole hemolymph implies the speed and accuracy of the researcher's actions, since it quickly coagulates and forms clusters of hemocytes. In order to avoid confusion when counting cells located on the border between squares, Egorov’s rule is applied. The optimal increase for counting is a 400-fold increase.
Australian red-claw crayfish, Cherax quadricarinatus, hemolymph, hemocytes, total hemocyte number, differentiated counting
Введение
Прижизненная оценка физиологического состояния промыслово значимых видов ракообразных является перспективным направлением, развивающимся последние несколько десятков лет. Наиболее полную картину о состоянии ракообразного позволяет дать анализ гемолимфы [1, 2]. При анализе гемолимфы используют группу различных показателей, в их число входит общее число гемоцитов (ОЧГ). Для ряда декапод установлено, что отклонение ОЧГ от нормы указывает на изменение физиологического состояния. Так, повышение уровня ОЧГ можно рассматривать как ответ на стресс или как спровоцированное митогенетическое возбуждение [3, 4], а снижение ОЧГ можно интерпретировать как показатель ослабления иммунитета и ухудшения состояния здоровья, вызванного угнетением вследствие влияния загрязняющих и отравляющих веществ [5–7] или заражением ракообразного вирусами или микроорганизмами [8]. Также изменение ОЧГ может сопровождать такие процессы, как линька, изменение цвета и гликемия [9]. Однако приведенные закономерности нельзя экстраполировать на все таксономические группы ракообразных, т. к. для различных видов возможны отличные изменения ОЧГ как ответ на одни и те же факторы воздействия.
Обычно ОЧГ определяют, используя различные типы камер для счета форменных элементов крови, как правило, в России применяют камеру Горяева.
Камера Горяева представляет собой счетную камеру объемом 0,9 мм3 с выгравированной сеткой, состоящей из 225 больших квадратов размером 0,2 × 0,2 мм и 400 маленьких квадратов размером 0,05 × 0,05 мм. При установлении формул для подсчета форменных элементов крови рыб и ракообразных руководствуются рекомендациями Н. Т. Ивановой по подсчету клеток крови рыб [10]. Так, для длиннопалого и широкопалого раков разработаны следующие формулы для подсчета ОЧГ в камере Горяева [11, 12]:
ОЧГ = N ∙ 4 000 / 3 600
или
ОЧГ = N / 0,9, (1)
где N – ОЧГ в 225 больших квадратах камеры Горяева;
ОЧГ = N ∙ 2,5, (2)
где N – ОЧГ в 100 больших квадратах камеры Горяева;
ОЧГ = N ∙ 5, (3)
где N – ОЧГ в 50 больших квадратах камеры Горяева;
ОЧГ = N ∙ 10, (4)
где N – ОЧГ в 25 больших квадратах камеры Горяева.
Как правило, ОЧГ в России выражают в числе клеток (шт.) в 1 мкл или 1 мм3. Как можно заметить, число просчитываемых квадратов может варьировать в широком диапазоне – от 225 (все квадраты камеры) до 25. Представленное разнообразие формул объясняется тем, что в зависимости от концентрации гемоцитов в крови целесообразно использовать ту или иную формулу. Так, например, при очень маленьком числе гемоцитов рекомендуется использовать формулы с большим количеством просчитываемых квадратов (формулы (1) и (2)). Однако от числа просчитанных квадратов зависит время получения результата, что в реалиях рыбоводных предприятий требует наименьших затрат по времени. При этом для перспективного объекта аквакультуры [13] – австралийского красноклешневого рака – требуется пересмотреть предложенные для речных раков формулы подсчета ОЧГ, поскольку имеется тенденция к снижению количества подсчитываемых квадратов сетки счетной камеры при увеличении числа форменных элементов крови. Так, у раков Astacus astacus
и Pontastacus leptodactylus ОЧГ составляет в норме в среднем 700–800 шт./мкл соответственно [14, 15], в то время как у австралийского красноклешневого рака ОЧГ в несколько раз выше, чем у первых двух видов, и среднее число гемоцитов может колебаться, по разным источникам, от 1 678 до 2 400 шт./мкл в зависимости от условий содержания [16, 17].
Целью настоящей работы было определение наиболее оптимальной формулы и разработка рекомендаций для подсчета ОЧГ австралийского красноклешневого рака.
Материалы и методы исследования
Работу проводили в лаборатории перспективных технологий в аквакультуре на базе бизнес-инкубатора ФГБОУ ВО «Кубанский государственный университет». В работе использовали 23 разноразмерных особи австралийского красноклешневого рака обоих полов (Cherax quadricarinatus, Von Martens 1868). Отбор гемолимфы и подсчет общего числа гемоцитов. Гемолимфу отбирали прижизненно из вентрального синуса шприцем объемом 2 мл с иглой 23G с учетом норм санитарии. Такой способ позволяет отбирать кровь, не нанося здоровью раков значительного ущерба. В качестве антикоагулянта использовали 4 %-й раствор Трилона-Б (ЭДТА-Na2) (BASF, Китай). Подсчет ОЧГ велся в 225, 100, 50 и 25 больших квадратах камеры Горяева и рассчитывался в соответствии с формулами (1)–(4). Всего провели 23 наблюдения для каждой из формул. Подсчет ОЧГ осуществляли следующим образом: подсчитывали гемоциты во всех больших квадратах камеры Горяева, далее производили подсчет по формулам с использованием необходимого числа квадратов, располагающихся на сетке в соответствии с рис. 1.
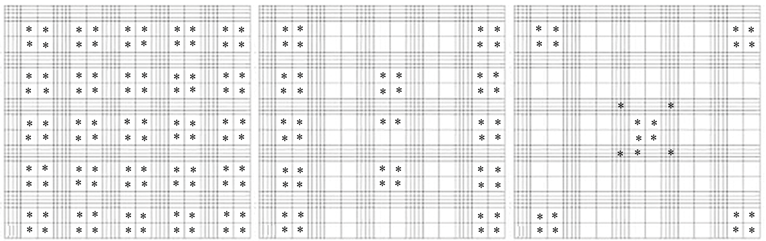
а б в
Рис. 1. Квадраты камеры Горяева, в которых велся подсчет:
* – квадраты, в которых велся подсчет гемоцитов; а – в 100 больших квадратах;
б – в 50 больших квадратах; в – в 25 больших квадратах
Fig. 1. Squares of Goryaev’s chamber in which the counting was carried out:
* – squares in which hemocytes were counted; a – in 100 large squares;
б – in 50 large squares; в – in 25 large squares
Статистическая обработка. Для определения статистической значимости результатов использовали однофакторный дисперсионный анализ (ANOVA), предварительно проведя проверку на нормальность с использованием критериев Колмогорова – Смирнова и Шапиро – Уилка. Множественные сравнения проводили с помощью HSD-теста. Расчеты и графическое оформление полученных данных проводили с использованием программ Microsoft Excel (Microsoft Corporation, США) и Statistica 14 (TIBCO Software Inc. США). Результаты представлены как среднее ± стандартное отклонение (M ± SD).
Результаты и их обсуждение
Отличия в ОЧГ при использовании различных формул минимальны, что подтверждается дисперсионным анализом F = 0,011, p = 0,998, средние величины ОЧГ колеблются от 2 384 до 2 427 шт./мкл (табл., рис. 2).
Показатели ОЧГ при подсчете различными формулами
THC indicators calculated by different formulas
|
Показатели ОЧГ |
Число просчитанных больших квадратов в камере |
|||
|
225 |
100 |
50 |
25 |
|
|
M ± SD |
2 427 ± 921,5 |
2 384 ± 896,1 |
2 402 ± 877,9 |
2 384 ± 947,2 |
|
Min–max |
942–4 444 |
761–4 400 |
910–4 305 |
900–4 360 |
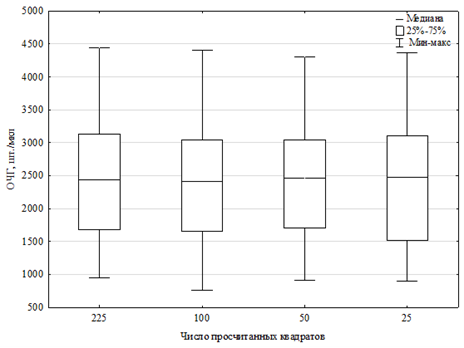
Рис. 2. Результаты подсчета ОЧГ различными формулами
Fig. 2. Results of calculating the THC by different formulas
Проведение множественных сравнений также показало, что различия между формулами минимальны: уровни значимости между формулами составляли p = 0,99. Исходя из этого можно сделать вывод, что наиболее оптимальной для использования у австралийского красноклешневого рака является формула (4), поскольку при подсчете 25 квадратов камеры, по сравнению с другими вариантами, различия в средних значениях ОЧГ минимальны. Используя меньшее количество квадратов можно снизить количество времени на проведение анализа без снижения его точности, что позволяет оптимизировать процесс подсчета ОЧГ.
Методические рекомендации по подсчету ОЧГ
Счетная камера должна быть чистая, т. к. при нахождении на сетке даже мелких пылинок могут образовываться скопления из гемоцитов, которые осложняют подсчет, или результат при таком подсчете будет некорректным, поскольку распределение на сетке гемоцитов не будет равномерным. После заполнения камеры гемолимфой рекомендуется подождать 1–1,5 мин, чтобы перемещение в ней гемолимфы остановилось и гемоциты прекратили свое движение. Для подсчета ОЧГ рекомендуется использовать антикоагулянт: он препятствует быстрому распаду клеток и способствует их равномерному распределению на сетке камеры, без образования сгустков (скоплений), которые влияют на точность подсчета (рис. 3, а).
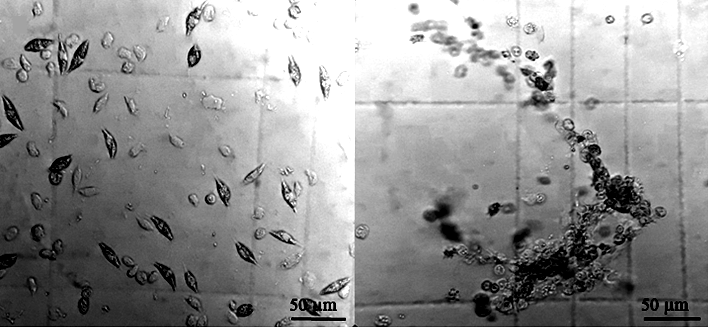
а б
Рис. 3. Гемоциты в камере Горяева:
a – равномерное распределение гемоцитов в камере при использовании антикоагулянта;
б – скопления гемоцитов в нативной гемолимфе
Fig. 3. Hemocytes in Goryaev's chamber:
а – uniform distribution of hemocytes in the chamber when using an anticoagulant;
б – accumulations of hemocytes in native hemolymph
Важно при использовании антикоагулянта не забывать вводить поправки на разбавление гемолимфы в формулы. Равномерного распределения клеток в сетке камеры можно также добиться, если заполнить камеру первыми двумя каплями только что отобранной нативной гемолимфы [18]. Работа с цельной гемолимфой подразумевает быстроту и точность действий исследователя, поскольку она быстро коагулирует и образует скопления гемоцитов (см. рис. 3, б). При образовании скоплений клеток в квадратах камеры рекомендуется пропускать такие квадраты и просчитывать другие, находящиеся неподалеку, без скоплений гемоцитов. Во избежание путаницы при подсчете клеток, находящихся на границе между квадратами, применяют правило Егорова при подсчете эритроцитов: в квадрате учитываются только те клетки, которые находятся внутри квадрата и на его верхней и левой границе, при условии, что клетки находятся в квадратах больше собственной половиной внутри него. Наиболее оптимальным увеличением для ведения подсчета является 400-кратное увеличение. Несмотря на то, что разница в ОЧГ между предложенными формулами минимальна, рекомендуется при ОЧГ менее 1 100 шт./мкл использовать формулу (3) или (2), а не (4).
Помимо подсчета ОЧГ в камере Горяева можно определить присутствие бактерий в гемолимфе и обломков гемоцитов, а также произвести дифференциальный подсчет гемоцитов – определить процентное соотношение различных типов гемоцитов. В частности, не составляет труда определить процент гранулоцитов в гемолимфе, поскольку данный тип клеток хорошо идентифицируется ввиду своего большого лучепреломления из-за крупных гранул. Для дифференциального подсчета гемоцитов следует просчитать не менее 100 клеток (100–300 в зависимости от количества клеток в камере) в разных частях камеры Горяева и воспользоваться следующей формулой:
Тип клеток (%) = 100 / (Кол-во клеток, просчитанных для диф. подсчета) ∙ Кол-во клеток искомого типа.
Допустим, мы просчитали 150 гемоцитов, и 38 из этих просчитанных клеток – гранулоциты, тогда доля гранулоцитов будет рассчитываться следующим образом:
Гранулоциты = 100 / 150 ∙ 38 = 25,3 %.
В итоге в анализируемом образце гемолимфы доля гранулоцитов будет составлять 25,3 %.
Заключение
Таким образом, установлена оптимальная формула с использованием 25 квадратов в счетной камере Горяева для подсчета ОЧГ австралийского красноклешневого рака, которая позволяет оптимизировать время подсчета ОЧГ без снижения точности. Помимо этого были приведены методические рекомендации по пробоподготовке образца гемолимфы, подсчету ОЧГ и дифференцированному подсчету гемоцитов.
1. Aleksandrova E. H., Kocheva N. P. Prizhiznennoe opredelenie fiziologicheskogo statusa desyatinogih rakoobraznyh (Srustacea: Decapoda) po gematologiche-skim pokazatelyam // Uspehi fiziologicheskih nauk. 2010. T. 41, № 2. S. 51-67.
2. Paterson B. D., Spanogle P. T., Davidson G. W., Hosking W., Nottingam S., Jussila J., Evans L. H. Prediction survival of western rock lobster Panuluris cygnus, using discriminant analysis of hemolymph parameters taken immediately following simulated handling treatments // New Zealand Journal of Marine and Freshwater Research. 2005. V. 39. P. 1129-1143.
3. Jussila J. Physiolog ical responses of Astacid and Parastacid Crayfi sches (Crustacea: Decapoda) to conditions of intensive culture: the dissertation on doctor’s degree. Univer. Kuopio, 1997. 138 p.
4. Sequiera T., Tavares D., Arala-Shaves M. Evidence for circulation hemocyte proliferation in the shrimp Penaeus japonicus // J. Develop. and Comp. Immunol. 1996. V. 20, no. 2. P. 97-104. https://doi.org/https://doi.org/10.1016/0145-305x(96)00001-8.
5. Lorenz S., Francese M., Smith V. J., Ferrero E. A. Heavy metals affect the circulating haemocyte number in the shrimp Palaemon elegans // Fish Shellfish Immunol. 2001. V. 11, no. 6. P. 459-472. https://doi.org/https://doi.org/10.1006/fsim.2000.0321.
6. Cheng W., Chen Jiann-Chu. Effects of environmental factors on the immune responses of freshwater prawn Macrobrachium rosenbergii and other decapod crusta-ceans // J. Fish. Soc. Taiwan. 2002. V. 29. P. 1-19.
7. Romano N., Zeng C. Toxic Effects of Ammonia, Nitrite, and Nitrate to Decapod Crustaceans: A Review on Factors Influencing their Toxicity, Physiological Consequences, and Coping Mechanisms // Reviews in Fisheries Science. 2013. V. 21, no. 1. P. 1-21. https://doi.org/10.1080/10641262.2012.753404.
8. Liu Y.-T., Chang C.-I., Hseu J.-R., Liu K.-F., Tsai J.-M. Immune responses of prophenoloxidase and cytosolic manganese superoxide dismutase in the freshwater crayfish Cherax quadricarinatus against a virus and bacterium // Molecular Immunology. 2013. V. 56, no. 1-2. P. 72-80. https://doi.org/10.1016/j.molimm.2013.03.023.
9. Truscott R., White K. N. The Influence of Metal and Temperature Stress on the Immune System of Crabs // Functional Ecology. 1990. V. 4, no. 3. P. 455-461. https://doi.org/10.2307/2389609.
10. Ivanova N. T. Atlas kletok krovi ryb (sravni-tel'naya morfologiya i klassifikaciya formennyh ele-mentov krovi ryb). M.: Leg. prom-st', 1982. 184 s.
11. Aleksandrova E. N., Pronina G. I., Koryagina N. Yu. O chisle gemocitov i nekotoryh drugih svoystvah gemolimfy rechnyh rakov (Decapoda, Astacinae) // Akvakul'tura i integrirovannye tehnologii: problemy i vozmozhnosti: materialy Mezhdunar. nauch.-prakt. konf., posvyasch. 60-letiyu Mosk. rybovodno-meliorativ. opyt. st. i 25-letiyu ee reorganizacii v GNU VNIIR (Moskva, 11-13 aprelya 2005 g.): sb. nauch. tr. M.: Izd-vo VNIIR Rossel'hozakademii, 2005. S. 365-375.
12. Ivanov A. A., Pronina G. I., Koryagina N. Yu. Fiziologiya gidrobiontov. SPb.: Lan', 2021. 480 s.
13. Lagutkina L. Yu., Kuz'mina E. G., Ahmedzhanova A. B., Taranina A. A., Yasinskiy V. S., Ponomarev R. A. Faktologicheskoe obespechenie praktik povysheniya effektivnosti vyraschivaniya tropicheskih presnovodnyh vidov // Vestn. Astrahan. gos. tehn. un-ta. Ser.: Rybnoe hozyaystvo. 2020. № 2. S. 94-105. https://doi.org/10.24143/2073-5529-2021-2-134-143.
14. Pronina G. I., Koryagina N. Yu. Referensnye znacheniya fiziologo-immunologicheskih pokazateley gidrobiontov raznyh vidov // Vestn. Astrahan. gos. tehn. un-ta. Ser: Rybnoe hozyaystvo. 2015. № 4. S. 103-108.
15. Adzhiev D. D., Pronina G. I., Ivanov A. A., Koryagina N. Yu. Funkcional'nye pokazateli poykilotermnyh gidrobiontov iz prirodnyh i iskusstvennyh vodnyh biocenozov // Sel'skohozyaystvennaya biologiya. 2018. T. 53, № 2. S. 337-347. https://doi.org/10.15389/agrobiology.2018.2.337rus.
16. Mauro M., Arizza V., Arculeo M., Attanzio A., Pinto P., Chirco P., Badalamenti G., Tesoriere L., Vazzana M. Haemolymphatic Parameters in Two Aquaculture Crustacean Species Cherax destructor (Clark, 1836) and Cherax quadricarinatus (Von Martens, 1868) // Animals. 2022. N. 12. P. 543. https://doi.org/10.3390/ ani12050543.
17. Bone J. W. P., Renshaw G. M. C., Furse J. M., Wild C. H. Using biochemical markers to assess the effects of imposed temperature stress on freshwater decapod crusta-ceans: Cherax quadricarinatus as a test case // Journal of Comparative Physiology B. 2014. V. 185, no. 3. P. 291-301. https://doi.org/10.1007/s00360-014-0883-3.
18. Kovacheva N. P., Aleksandrova E. N. Gematologicheskie pokazateli kak indikatory fiziologicheskogo sostoyaniya dekapod: kamchatskogo kraba Paralithodes camtschaticus i rechnyh rakov rodov Astacus i Pontastacus. M.: Izd-vo VNIRO, 2010. 91 s.
















