Russian Federation
Russian Federation
Russian Federation
In the recent years, in the water and soils of the Black Sea are found oil products, whose concentration exceeds the allowable standard by 3 times. Due to the limited works on studying the petroleum products’ impact on the sea fish juveniles, evaluating the effect of low concentrations of fuel oil and diesel oil (½ maximum permissible concentration (MPC), MPC – 0.05 ml/l and 2 MPC) on atherina larvae was seen as important. This object has already been successfully used in testing the domestic sewage and pesticides. Despite the fact that Atherinidae species are not commercially significant, they are active pelagic fish species of the coastal zone of the southern seas and an important object in the trophic chain of the coastal biocenosis. As a results of the proper experiments, as well as of the literature data, it was proved that the above allowed concentrations of oil products should be revised from the point of view of their safety for aquatic organisms. During three days, the survival of larvae decreased by more than 50%, after which all species (including controls) died in 4-5 days. A similar experiment with diesel oil and fuel oil, due to its greater toxicity, included a feeding factor. Atherina larvae consumed both cysts and branchiopod nauplii, however, on the third day their intestines were empty. This fact, as well as survival rates exceeding the control values, is probably part of the organism compensatory reaction in response to the toxicant presence. From a methodological point of view, it would be more correct to carry out even acute and short-term toxicological experiments with feeding, because they significantly influence the determination of toxicity of the environment or of a specific xenobiotic.
Atherina, larvae, petroleum products, feeding, diesel oil, mazut, maximum allowable concentration, survival
Введение
Нефтяное загрязнение водоемов остается одним из самых распространенных и опасных видов антропогенного воздействия на Мировой океан. Компоненты нефтяного загрязнения попадают в моря в результате добычи нефти, судоходства, выпадения атмосферных осадков и действия речного стока, а также с уже загрязненных донных отложений портовых акваторий. Известно, например, что за последние 10–20 лет загрязнение прибрежных вод Среднего Каспия нефтепродуктами в целом стабильно превышает ПДК в 1–3 раза, и очень редко встречаются районы, где концентрация нефтяных углеводородов была бы меньше или на уровне ПДК [1]. В водной толще северо-восточной части Черного моря в 2011–2014 гг. среднегодовые концентрации нефтепродуктов (НП) менялись от 0,6 до 0,8 ПДК, а с 2011 по 2015 г. частота встречаемости проб воды, в которых концентрация НП была больше ПДК, не превышала 9–14 % от общего количества проанализированных проб. Неблагополучными в этом отношении были Керченское предпроливье, траверз г. Анапы, участок Геленджик – Архипо-Осиповка и прибрежье района г. Сочи [2]. Несмотря на информативность мониторинговых работ, биотестирования и биоиндикации эффектов воздействия НП на гидробионты, а также неоднозначное отношение ученых к концепции ПДК, остаются открытыми вопросы методического характера проведения токсикологических работ в области водной токсикологии. Высокая токсичность нефти в концентрациях 14–30 мг/л уже доказана на примере некоторых видов взрослых черноморских рыб [3]. Сходные исследования были проведены и на ранних стадиях развития рыб (мальках кефали, нильской тиляпии, корюшки и др.) [4–7].
В настоящем исследовании была поставлена цель – проанализировать в эксперименте воздействие НП в низких концентрациях на личинок атерины при их кормлении и без.
Объект, материалы и методы исследования
Активные пелагические виды рыб более чувствительны к нефтяному загрязнению, чем рыбы других экологических групп ихтиофауны [3]. Черноморская атерина – прибрежный эвригалинный вид, размножение которого порционное и продолжительное – с мая по сентябрь [8, 9]. Преимущество использования атерины при биоиндикационных работах, а также при биотестировании, заключается в ее широком распространении, наличии в прибрежье в течение всего теплого периода года. В Черном море атерины не являются объектом промысла, однако, являясь пищевыми конкурентами для других видов рыб и объектом питания для хищных видов, они играют важную роль в трофической цепи прибрежных ихтиоценозов. Молодь рыб была отловлена в прибрежной зоне бухты Круглая саком в июле-августе 2022 г. Личинки атерины Atherina sp. постоянно держатся на выходе из бухты Круглая; данная часть акватории характеризуется относительной чистотой вод [10]. Химический анализ морской воды в районе отлова был осуществлен с использованием стандартных наборов реактивов фирмы Tetra. Концентрация О2 составила 3 мг/л, РО4 – 5 мг/л, NO3 – 5 мг/л, NO2 < 0,3 мг/л. После транспортировки в лабораторию хемоэкологии Института биологии южных морей им. А. О. Ковалевского личинок адаптировали, помещая в чистую воду с аэрацией на 1 ч. В первом эксперименте токсикант (солярка/мазут) в концентрациях 0,025 мл/л (К1, ПДК/2), 0,05 мл/л (К2, т. е. ПДК) и 0,1 мл/л (К3, 2ПДК) был добавлен с помощью автоматического дозатора в чистую морскую воду.
В каждом кристаллизаторе объем морской воды составлял 2 л. Концентрация НП 0,05 мл/л (К2) является ПДК для рыбохозяйственных водоемов [11]. Контролем служила чистая морская вода без токсиканта. В кристаллизаторы с разными концентрациями помещали по 15–20 личинок. Каждый эксперимент повторяли 3 раза. Определяли выживаемость молоди рыб в течение 4-5 суток и, в конечном счете, оценивали ее относительно первоначальной численности, %. Второй эксперимент (с соляркой) отличался тем, что личинок в опытах и контроле кормили 1 раз в сутки, внося сачком науплиусы артемии (цисты также попадали в кристаллизатор автоматически). Цисты жаброногого рачка Artemia, из которых
в течение нескольких дней можно получить науплиусы, во всем мире признаны наилучшим живым стартовым кормом для многих видов рыб и ракообразных [12]. Мы использовали 3–4-суточных особей жабронога. Диаметр цист был в среднем 0,25 мм, а размер науплиусов – от 0,3 до 0,8 мм.
Через 20–30 минут отлавливали не менее 5 личинок в сутки из каждого кристаллизатора, фиксировали в спиртовом растворе.
Питание рыб изучалось по методике [13]. Личинок вскрывали под микроскопом МБС–9, извлекали содержимое кишечников, в котором идентифицировали пищевые объекты, затем их просчитывали и измеряли под микроскопом Nikon Eclipse 200 при увеличении 40x. Массу тела личинок рыб W, мг, измеряли на торсионных весах. Длина TL, мм, – расстояние от вершины рыла до вертикали конца наиболее длинной лопасти хвостового плавника; длина SL, мм, измерялась от вершины рыла до конца позвоночного столба.
При статистическом анализе использовали приложение Microsoft Office Excel 2016.
Результаты и обсуждение
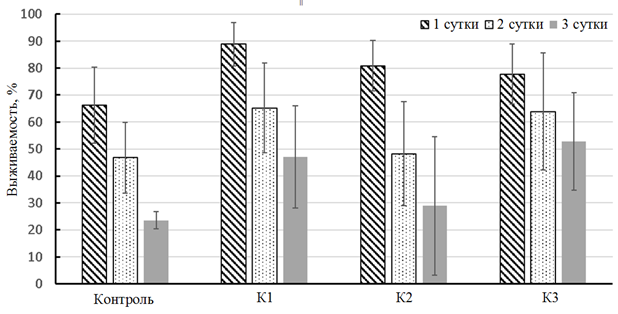
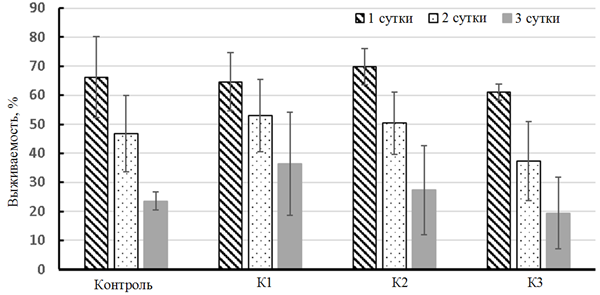
Отмечено, что за трое суток экспериментов (воздействие дизельного топлива и мазута) выживаемость личинок атерины снизилась (рис. 1).
а
б
Рис. 1. Выживаемость личинок атерины, подвергнутых влиянию дизельного топлива (а) и мазута (б)
Fig. 1. Survival of atherina larvae exposed to diesel oil (а) and fuel oil (б)
Значения показателя выживаемости достоверно различались между 1-м и 3-м днем. Чем выше была концентрация солярки/мазута, тем выживаемость рыб оказалась выше. Личинки атерины, помещенные в растворы с мазутом, имели более близкие к контрольным величины выживаемости, в то время как при воздействии низких концентраций дизельного топлива эти отличия были сильнее. Данный факт можно трактовать как более губительное действие дизельного топлива, по сравнению с тяжелыми нефтяными фракциями.
Неоднозначный эффект мéньшей смертности в опытах, нежели в контроле, можно объяснить активизацией защитных свойств личинок в ответ на поступление токсиканта в организм, что было показано на примере эксперимента по влиянию хозяйственно-бытовых сточных вод на личинок атерины [14]. Это подтверждают и другие аналогичные работы: при воздействии солярки (2,5 и 5 мл/л) на мальков кефали у рыб только к 3-4 дню отмечали нарушение в двигательной и дыхательной активности, нарушение пигментации тела [6], при этом активность антиоксидантных ферментов возрастала на вторые сутки, после чего концентрация ферментов значительно снизилась [6]. В данных краткосрочных экспериментах молодь черноморских рыб не питалась, и сочетание этих двух факторов – воздействия токсиканта и отсутствия пищи – привело к фазности реагирования защитной системы организма, но,
в конечном счете, к гибели. При изучении влияния низких концентраций солярки на личинок атерины на фоне потребления ими корма получены отличные от первого эксперимента результаты (рис. 2).
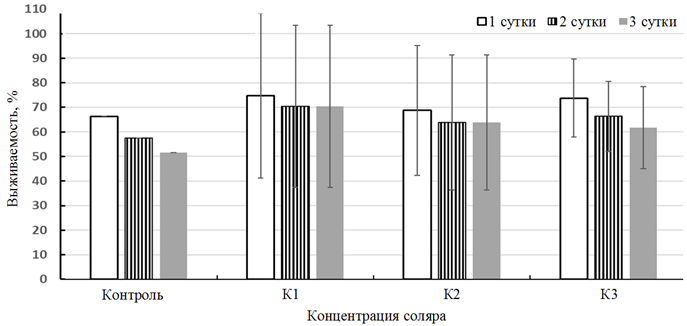
Рис. 2. Выживаемость личинок атерины, потреблявших артемию, подвергнутых влиянию дизельного топлива
Fig. 2. Survival rate of atherina larvae consuming Artemia and exposed to diesel oil
Во-первых, сами величины выживаемости рыб были достаточно высокими – гибель не превышала 50 % в опытах и контроле, следовательно, острого токсического эффекта не было. Во-вторых, как и в первом случае, изученный показатель был с 1 по 3 день выше в опытах, чем в контроле.
Этот результирующий эффект токсического влияния НП – итог взаимодействия одновременно протекающих процессов интоксикации и компенсаторно-адаптивных реакций живой системы. Компенсаторная реакция, представляющая собой ответ системы на дестабилизирующее воздействие, запаздывает во времени по отношению к нарастанию деструктивных последствий этого воздействия, но возрастает интенсивнее и имеет предельный уровень, определяемый свойствами и состоянием системы [15].
Трехфазное течение токсического процесса справедливо как для молоди, так и в отношении взрослых экземпляров [3]. Известно, что смерть рыб в острых и подострых случаях нефтяной интоксикации вызывается сочетанием двух стресс-факторов – гипоксии и резкого снижения энергетических запасов, в том числе гликогеновых. Это провоцируется непосредственным недостатком кислорода (НП в водной среде препятствуют естественной аэрации и нарушают нормальные биологические процессы водоема), намеренным отсутствием в эксперименте пищи либо отказом рыб от питания, а также заглатыванием НП, т. е. прямым отравлением [3, 16, 17]. С одной стороны, токсикологические эксперименты на рыбах могут (а иногда это рекомендовано) проводиться без кормления. Это касается, прежде всего, холодного периода года, а также краткой экспозиции (острые и подострые опыты) [3]. Имеются сведения, что при долговременном голодании у рыб также происходит активизация работы антиоксидантной системы. Так, активность антиоксидантных ферментов в печени в течение 5 недель была выше контрольных значений, что позволило Dentex dentex восстановиться через 3 недели после возобновления кормления [18]. С другой стороны, в нашем случае, личинки рыб, являющиеся более чувствительными по отношению к разным факторам среды, могут преодолеть негативное действие невысоких концентраций токсиканта, по-видимому, если они будут обитать в более приближенных к натуральным условиям жизни и, в первую очередь, обеспечены пищевыми объектами (табл.).
Влияние низких концентраций дизельного топлива на потребление личинками атерины
науплиусов и цист артемии
Influence of low concentrations of diesel oil on Artemia consumption
by atherina larvae
|
Стадия эксперимента |
Количество личинок атерины |
Размерно-весовые характеристики |
Количество науплиусов и цист |
|||
|
TL, мм |
SL, мм |
W, мг |
Цисты |
Науплии |
||
|
Контроль – 1 сутки |
15 |
6,2–13,1* 9,2 |
6,5–11,7 8,5 |
0,4–2,9 1,5 |
1–6 2 |
0 |
|
Контроль – 2 сутки |
18 |
7,8–14 10,3 |
7,4–12,6 9,3 |
0,9–4,3 1,6 |
1–13 4 |
2 |
|
Контроль – 3 сутки |
21 |
8,6–14,6 11,7 |
7,9–12,9 10,5 |
1,2–6,3 3,8 |
1–27 6,7 |
0 |
|
К 1 – 1 сутки |
9 |
6,6–12,6 10,3 |
6,3–11,2 9,4 |
0,3–3,6 2,0 |
1–12 2,6 |
0 |
|
К 1 – 2 сутки |
8 |
9,7–13,0 11,3 |
9,0–11,7 10,3 |
1,8–5,2 3,2 |
2–23 7,8 |
2– 4 2,7 |
|
К 1 – 3 сутки |
9 |
7,5–13,2 10,5 |
7,2–11,6 9,6 |
0,7–6,8 3,2 |
1–7 1,2 |
0 |
|
К 2 – 1 сутки |
11 |
7,5–13,2 10,5 |
7,1–11,6 9,6 |
0,5–5,4 1,8 |
1–2 0,3 |
1–6 2,8 |
|
К 2 – 2 сутки |
8 |
7,5–13,1 10,7 |
7,1–11,6 9,8 |
0,9–7,2 2,2 |
2–14 2 |
3–6 4,5 |
|
К 2 – 3 сутки |
7 |
9,5–13,3 11,7 |
8,7–12,8 10,7 |
2,5–8,4 4,4 |
0 |
0 |
|
К 3 – 1 сутки |
16 |
8,2–12,6 10,9 |
7,7-11 9,7 |
1,2–4 2,2 |
1–4 0,3 |
0 |
|
К 3 – 2 сутки |
14 |
8,6–13,3 11,6 |
7,7–12,2 10,6 |
2–4,5 3,1 |
1–20 2,4 |
5–7 6,0 |
|
К 3 – 3 сутки |
6 |
10,6–14,5 12,1 |
9,6–12,6 10,9 |
1,9–8,1 4,3 |
0 |
0 |
*В числителе – диапазон значений, в знаменателе – среднее значение.
При отсутствии солярки личинки предпочитали потреблять цисты артемии (см. рис. 1, табл.), нежели науплиусов, причем к 3-му дню численность корма достигла максимальных величин. Сходная картина получена и в отношении воздействия самой малой концентрации дизельного топлива – 0,025 мл/л; при этом все-таки количество подвижной добычи увеличилось (2-е сутки). Интересным фактом оказалось то, что при влиянии ПДК НП и двойной ПДК в начале эксперимента атерина и охотилась, и потребляла цисты артемии, но к 3-му дню кишечники были пустыми. Это, вероятно, также является частью компенсаторных реакций организма в ответ на присутствие токсиканта.
То, что личинки потребляли как науплиусов, так и цисты артемии (рис. 3), согласуется с литературными сведениями о полноценности яиц этих рачков в качестве распространенного стартового корма; однако быстрое оседание цист может вызвать их недоступность для планктонных личинок, если цисты не были предварительно высушены.
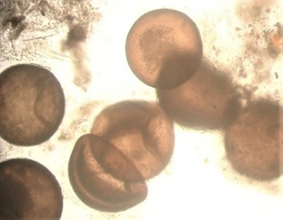
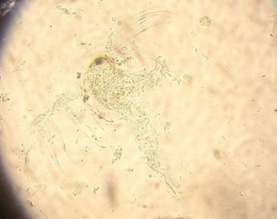
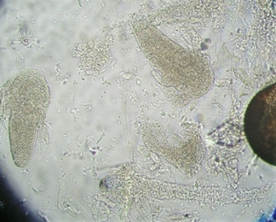
Рис. 3. Фото потребленных цист и науплиусов артемии в кишечниках атерины
Fig. 3. Photo of consumed cysts and nauplii of artemia in the intestines of atherina
В случае плохого (малого) выклева науплиусов цисты, если они не осели на дно, используются рыбами полноценно и оправданно, т. к. содержат липиды, железо, необходимые для развития молоди [12].
Как было отмечено ранее, вероятно, именно факт кормления оказал положительный эффект на выживаемость рыб, однако к 4-5 дню все особи погибли во всех вариантах, что все-таки свидетельствует о том, что в условиях эксперимента выедание цист, а не живого корма, а в последующем отказ от пищи приводят к скорой гибели.
Что касается самой концентрации нефтепродукта, то ранее было показано, что концентрация 0,05 мг/л – ПДК нефти для рыбохозяйственных водоемов – вызывает более мягкое воздействие на организм рыб за счет раннего включения компенсаторных механизмов [3]. Но после проведения многочисленных токсикологических экспериментов на взрослых рыбах автор [3] сделал заключение о безвредной концентрации нефти для черноморских рыб: 0,01 мг/л нефти не оказывала какого-либо эффекта на отклик организма на разных уровнях организации [3].
На основании проведенного литературного обзора по токсичности НП для икры, эмбрионов и личинок разных видов морских и пресноводных рыб авторы работы [5] подтверждают: концентрации НП, вызывающие токсическое или даже губительное действие на ранние стадии развития рыб, меньше ПДК для рыбохозяйственных водоемов:
от 0,0004 до 0,0025 мг/л. Такое содержание водорастворимой фракции нефти приводит к снижению выживаемости и роста, изменению поведения и другим аномалиям, что в итоге отражается на здоровье популяции [5]. Например, выветренная нефть при концентрации ПАВ 0,0007 мг/л приводила к уродствам, генетическим отклонениям, водянке, снижению размеров у личинок сельди Clupea pallasii [19, 20]. От повышенных концентраций растворенных НП страдают и планктонные ракообразные [1], в природной среде являющиеся основным видом пищи для ранних стадий развития рыб, в том числе атерины [21], что в конечном счете может привести к непосредственному отравлению разных представителей ихтиофауны и к накоплению НП в тканях рыб [16, 17]. Но есть сведения о том, что в нефтяной среде после выклева личинок кутума активность пищевого поведения была нормальной [22]. Следовательно, внесение концентраций нефти выше ПДК (до 0,2 мг/л), вызвавшие аномалии развития эмбрионов, морфологические изменения, замедленное сердцебиение, снижение размеров выклюнувшихся личинок [22], приводило к изменению направленности обменных процессов на обеспечение индивидуальной адаптации к изменившимся условиям среды.
Таким образом, тестированные концентрации дизельного топлива и мазута – 0,025; 0,05 и 0,1 мл/л – были токсичны для личинок атерины. Высокая токсичность солярки для личинок проявлялась и во втором эксперименте, когда особей кормили науплиусами артемии, что позволяет, наряду с данными Н. Д. Мазманиди (1997) [3] о безвредности для взрослых черноморских рыб концентрации нефти 0,01 мг/л, рекомендовать снижение ПДК. То, что при отсутствии пищи в контроле процент гибели рыб был высоким, а при ее наличии не превышал 50 %, также может служить предпосылкой к рекомендации кормления в токсикологических (даже краткосрочных) работах на молоди рыб.
Заключение
Тестированные концентрации дизельного топлива и мазута – 0,025; 0,05 и 0,1 мл/л – были токсичны для личинок атерины. Высокая токсичность солярки для личинок проявлялась и в эксперименте, когда особей кормили науплиусами артемии, что позволяет, наряду с данными Н. Д. Мазманиди (1997) о безвредности для взрослых черноморских рыб концентрации нефти 0,01 мг/л, рекомендовать снижение ПДК. С методической точки зрения следует проводить даже острые и краткосрочные токсикологические эксперименты с кормлением, т. к. это существенно влияет на определение степени токсичности среды или отдельного ксенобиотика.
1. Abdusamadov A. S., Abdurahmanov G. M., Dohtukaeva A. M., Dudurhanova L. A. Zagryaznenie melkovodnoy pribrezhnoy opresnennoy zony i shel'fa zapadnoy chasti Kaspiyskogo morya i ego vliyanie na biotu i vosproizvodstvo ryb // Yug Rossii: ekologiya, razvitie. 2011. № 2. S. 37-62.
2. Evseeva A. I. Raspredelenie komponentov neftyanogo zagryazneniya po akvatorii severo-vostochnoy chasti Chernogo morya v sovremennyy period // Sovremennye voprosy ekologicheskogo monitoringa vodnyh i nazemnyh ekosistem: materialy Mezhdunar. nauch. konf. molodyh uchenyh (Rostov-na-Donu, 26-29 oktyabrya 2015 g.). Rostov n/D.: Izd-vo Azov. NII ryb. hoz-va, 2015. S. 86-87.
3. Mazmanidi N. D. Ekologiya ryb Chernogo morya i neft'. Batumi: Izd-vo «Adzhara», 1997. 147 s.
4. Luk'yanenko V. I. Ekologicheskie aspekty ihtio-toksikologii. M.: Agropromizdat, 1987. 240 s.
5. Pryazhevskaya T. S., Cherkashin S. A. Vliyanie nefteuglevodorodov na ranniy ontogenez ryb // Izv. TINRO. 2007. T. 149. S. 359-365.
6. Chesalina T. L., Rudneva I. I., Kuz'minova N. S. Toksicheskoe deystvie solyara na molod' chernomorskoy kefali-ostronosa Liza saliens // Vopr. ihtiologii. 2000. T. 40, № 3. S. 429-432.
7. Dede E. B., Kaglo H. D. J. Aqua-toxicological Effects of Water Soluble Fractions (WSF) Of Diesel Fuel On O. Niloticus Fingerlings // Appl. Sci. Environ. Mgt. 2001. V. 5 (1). P. 93-96.
8. Boltachev A. R., Karpova E. P. Morskie ryby Krymskogo poluostrova. Simferopol': Biznes-Inform, 2012. 224 s.
9. Svetovidov A. N. Ryby Chernogo morya. L.: Nauka, 1964. 550 s.
10. Gubanov V. I., Stel'mah L. V., Klimenko N. P. Kompleksnye ocenki kachestva vod Sevastopol'skogo vzmor'ya (Chernoe more) // Ekologiya morya. 2002. Vyp. 62. S. 76-80.
11. Ob utverzhdenii normativov kachestva vody vodnyh ob'ektov rybohozyaystvennogo znacheniya, v tom chisle normativov predel'no dopustimyh koncentraciy vrednyh veschestv v vodah vodnyh ob'ektov rybohozyaystvennogo znacheniya: prikaz Minsel'hoza Rossii ot 13 dekabrya 2016 g. № 552 (red. ot 10.03.2020). URL: https://docs.cntd.ru/document/420389120 (data obrascheniya: 21.11.2022).
12. Razova L. F. Ocenka biologicheskih i reproduktivnyh osobennostey artemii sibirskih populyaciy: dis. … kand. biol. nauk. Tyumen', 2022. 172 s.
13. Duka L. A., Sinyukova V. I. Rukovodstvo po izucheniyu pitaniya lichinok i mal'kov morskih ryb v estestvennyh i eksperimental'nyh usloviyah. Kiev: Naukova dumka, 1976. 134 s.
14. Kuz'minova N. S. Ocenka toksicheskogo deystviya hozyaystvenno-bytovyh stochnyh vod na organizmy: avtoref. dis. … kand. biol. nauk. M., 2006. 24 s.
15. Culadze V. L. Basseynovyy metod vyraschivaniya lososevyh ryb: na primere raduzhnoy foreli. M.: Agropromizdat, 1990. 156 s.
16. Kukin P. P., Ponomarev N. L., Taranceva K. R. i dr. Osnovy toksikologii: ucheb. posobie. M.: Abris, 2012. 279 s.
17. Cherkashin S. A. Otdel'nye aspekty vliyaniya uglevodorodov nefti na ryb i rakoobraznyh // Vestn. DVO RAN. 2005. № 3. C. 83-91.
18. Morales A. M., Perez-Jimenez A., Hidalgo M. C., Abellan E., Cardenete G. Oxidative stress and antioxidant defenses after prolonged starvation in Dentex dentex liver // Comparative biochemistry and physiology Part C. 2004. V. 139. P. 153-161. DOI:https://doi.org/10.1016/j.cca.2004.10.008.
19. Carls M. G., Marty G. D., Hose J. E. Synthesis of the toxicological impacts of the Exxon Valdez oil spill on Pacific herring (Clupea pallasi) in Prince William Sound, Alaska U.S.A. // Can. J. Fish. Aquat. Sci. 2002. V. 59. P. 153-172.
20. Carls M. G., Rice S. D., Hose J. E. Sensitivity of fish embryos to weathered crude oil. Part 1. Low level exposure during incubation causes malformations, genetic damage and mortality in larval Pacific herring (Clupea pallasi) // Environ. Toxicol. Chem. 1999. V. 18. P. 481-493.
21. Vdodovich I. V., Kolesnikova E. A., Kuz'minova N. S., Ryl'kova O. A., Muhanov V. S. Vliyanie kachestvennogo sostava pischevyh ob'ektov na reakciyu pischevaritel'nyh fermentov molodi Atherinidae v pribrezhnyh vodah Sevastopolya v letniy period // Vopr. rybolovstva. 2017. T. 18, № 4. S. 499-506.
22. Gazimagomedova I. K., Rabadanova M. M. Fiziologo-biohimicheskie pokazateli ryb v rannem ontogeneze pri neftyanom zagryaznenii vodnoy sredy // Vestn. Dagestan. gos. un-ta. Ser. 1. Estestvennye nauki. 2016. T. 31. Vyp. 4. S. 106-113.
















