Perm', Russian Federation
Russian Federation
Russian Federation
Russian Federation
Russian Federation
As a result of secondary salinization of freshwater ecosystems the biota significantly changes, which results in declining the abundance and species diversity of aquatic organisms. This study aims experimental assessment of the hematological parameters of the juvenile perch Perca fluviatilis (Linnaeus, 1758), held at normal (background), as well as elevated mineralization and temperature. The experiment was carried out in August 2021 on perch YOY (young-of-the-year) collected by a fry seine in the lower reaches of the river Gaiva (Perm Kray). We presented the results of studying the peripheral blood of perch juveniles under natural temperature (8.7 ± 0.12 oC) and mineralization (0.26 ± 0.01 g/l) – a control group, as well as the species put into the aquariums 1) with natural temperature and high mineralization (5.3 ± 0.03 g/l), and 2) with higher temperature (19.7 ± 0.12 oC) and higher mineralization. At the end of the experiment (on 35th day) the peripheral blood samples (general analysis) were analyzed. The various destructive disorders of red blood cells were separately identified. The fish held in the highly mineralized water have lower hemoglobin levels, lower hematocrit and deformed blood elements, higher average volume of red blood cells, which indicates the suppression of hematopoiesis. The following disorders of erythrocytes were revealed in the studied fish: poikilocytosis, centric arrangement of the nucleus, scalloped contour, vacuolization of cytoplasm, agglutination, hypochromasia, chromatinolysis, anisocytosis (increase in size), hemolysis, nuclear shadows, formation of schistocytes. In fish contained in the aquariums with increased mineralization the number of aberrant erythrocytes was found higher than in fish from the control group. Combination of increased mineralization with increased temperature leads to the onset of the fourth stage of toxicosis resulting in a mass death of fish.
perch, salinity, mineralization, hematological parameters, erythrocytes, pathomorphological changes in erythrocytes
Введение
Верхнекамское месторождение калийно-магниевых солей (Пермский край) является одним из крупнейших в мире. Промышленная разработка месторождения началась в 30-х гг. XX в. [1]. Под влиянием отходов производства, межпластовыми перетоками и изливами высокоминерализованных вод приповерхностная гидросфера подвергается загрязнению [2]. Приоритетными загрязняющими веществами калийного производства являются хлориды калия и натрия. При взаимодействии горных пород и засоленных подземных вод отмечается увеличение содержания в воде кальция, магния, сульфатов, а также ряда тяжелых металлов [3].
Вторичное засоление пресноводных экосистем оказывает значительное влияние на биоту, приводя к уменьшению численности и сокращению видового разнообразия гидробионтов [4–6]. Повышенное содержание ионов в воде (преимущественно Cl–, K+, Na+, Mg2+) приводит к острым и хроническим физиологическим последствиям [7]. Нарушение физиологического состояния у рыб отражается на гематологических показателях [8, 9]. Кроветворение и состав крови рыб являются динамичными параметрами внутренней среды, отвечающими за адаптивные процессы в ответ на изменение условий обитания [10, 11]. У особей из техногенно засоленного водоема выявлен ряд гематологических показателей, потенциально свидетельствующих о снижении иммунитета. Так, по результатам пилотного проекта, проведенного в 2020 г. на р. Волим, подверженной воздействию отвально-шламового хозяйства БКРУ-3 ПАО «Уралкалий», для обыкновенного ерша Gymnocephalus cernua (Linnaeus, 1758) была отмечена эритропения и высокая встречаемость эритроцитарно-морфологических аномалий, что свидетельствует о неблагоприятном воздействии окружающей среды [12].
На сегодняшний день в литературе сведений о гематологических характеристиках рыб бореальной зоны в условиях засоления недостаточно. Рыбы являются важнейшим элементом бореальных пресноводных экосистем, для которых характерна низкая устойчивость к антропогенному воздействию, негативный эффект от которого способен усиливаться в текущих условиях изменения климата [13, 14].
Целью данной работы является анализ (экспериментальная оценка) гематологических показателей молоди речного окуня Perca fluviatilis (Linnaeus, 1758), содержащейся при нормальной (фоновой, а также повышенной минерализации и температуре. Необходимость изучения влияния хронического засоления на организм рыб в сочетании с действием повышенных температур связана с масштабным засолением прилегающих к Верхнекамскому месторождению водоемов. В связи с глобальным потеплением климата изучение диапазонов солевой толерантности гидробионтов приобретает особую актуальность.
Материал и методы исследований
В качестве объекта исследования был выбран окунь, который является распространенным эврибионтным видом. Эксперимент проводили на сеголетках, выловленных с помощью малькового невода (сечение ячеи 5 мм) в нижнем течении р. Гайвы (координаты: 58° 05' с. ш., 56° 17' в. д.) в августе 2021 г. Было отловлено 1 050 особей, которых в течение часа доставили в пластиковых емкостях с аэрацией в ботанический сад Пермского государственного национального исследовательского университета (место экспериментальной работы). За время транспортировки 178 особей погибли, выжившие рыбы были помещены в пластиковый бассейн с водопроводной водой и системами фильтрации и аэрации, объемом 2 м3, для двухнедельной акклиматизации. В бассейне и экспериментальных контейнерах систематически проводили замену трети объема воды (интервал 3–5 дней). Кормление рыб за весь период исследования осуществляли ежедневно живыми личинками комара-звонца Chironomus plumosus (Linnaeus, 1758). Количество корма регулировали по поедаемости. Донные осадки ежедневно убирали с помощью сифона.
Для эксперимента использовали пластиковые контейнеры с крышкой объемом по 32 л, оснащенные системами фильтрации и аэрации. В каждый контейнер помещали от 28 до 31 особи окуня, прошедших акклиматизацию. Сами контейнеры находились под навесом, который служил защитой от попадания прямых солнечных лучей и атмосферных осадков, на открытом воздухе. Эксперимент проводили в формате трехкратных повторений для каждого из факторов: так, в контейнерах № 1–3 были созданы фоновые условия минерализации и температуры; в контейнерах № 4–6 – условия повышенной солености и фоновой температуры; в контейнерах № 7–9 – условия повышенной солености и температуры. Для минерализации использовали соль из солеотвалов Верхнекамского месторождения калийно-магниевых солей (с помощью прибора Aquaprobe AP-2000 следили за уровнем минерализации при смене воды), температуру повышали с помощью аквариумных терморегуляторов. Значение концентрации солей, использованной в эксперименте, подбирали близкими к наблюдаемым в водных объектах, населенных ихтиофауной и подверженных засолению. Искусственное увеличение температуры настраивали таким образом, чтобы термический режим находился в пределах толерантности тест-объекта, но был выше относительно климатической нормы с учетом возможного роста температуры в будущем. В конце эксперимента были взяты пробы воды для определения общего химического и микроэлементного анализов, которые проводили в лаборатории гидрохимического анализа Пермского государственного национального исследовательского университета.
Продолжительность эксперимента составила
35 дней: с 15 сентября до 19 октября включительно. По окончании эксперимента проводили взятие проб крови из хвостовой артерии путем отсечения хвостового стебля у анального плавника не позднее чем через 15–20 с после извлечения рыбы из воды согласно методике В. В. Метелева [15]. В связи с тем, что объем крови у сеголетков не позволяет произвести индивидуальный анализ, для набора минимального объема крови, необходимого для проведения общего анализа (0,5 мл), в одной пробирке с антикоагулянтом объединяли кровь 7–13 особей. Таким образом, для проведения общего анализа крови были собраны по три объединенные пробы крови рыб, содержавшихся в фоновых условиях и условиях повышенной минерализации. Общий анализ крови рыб, выживших в условиях повышенной минерализации и температуры, не проводили ввиду малочисленности особей, выживших до конца эксперимента. У всех выживших рыб индивидуально брали кровь на мазок для проведения дальнейшего гематологического анализа. Количество экспериментальных животных, выживших до конца эксперимента в фоновых условиях, составило 77 экз., в условиях повышенной минерализации – 82 экз., в условиях повышенной минерализации и температуры – 10 экз.
Гематологические исследования проводили в соответствии с опубликованными методическими рекомендациями [16]. В лаборатории освоения агрозоотехнологий Пермского государственного аграрно-технологического университета на автоматическом гематологическом анализаторе Abaxis HM 5 проводили анализ следующих показателей периферической крови: гемоглобин (HGb), гематокрит (Hct), средний объем эритроцита (MCV), абсолютное количество эритроцитов (RBC), лейкоцитов (WBC) и тромбоцитов (PLT).
Лейкоцитарную формулу и процентный состав зрелых и незрелых клеток красной крови определяли по мазкам (для фиксации и окраски использовали раствор Лейшмана). При установлении процентного состава клеток эритропоэтического ряда за 100 % принимали 1 000 просчитанных эритроцитов и 200 клеток при рассмотрении форм лейкоцитов. Руководствуясь атласами форменных элементов крови рыб, проводили идентификацию клеток крови и определяли патоморфологические изменения эритроцитов [16, 17]. Для каждой особи изготавливали 1 мазок. Микроскопирование окрашенных мазков крови проводили с помощью микроскопа OLYMPUS BX53 при увеличении 40Х. Были обследованы мазки 18 особей, содержавшихся в фоновых условиях, 16 рыб, содержавшихся в условиях повышенной минерализации, и 4 рыб, содержавшихся в условиях повышенной температуры воды при повышенной минерализации.
Статистическое сравнение гематологических показателей экспериментальных рыб, а также химических показателей воды, использованной в ходе эксперимента, проводили с использованием критерия Манна – Уитни. Оценку нормальности распределения данных осуществляли с помощью критерия Шапиро – Уилка. При определении нормальности выборок и сравнении их с помощью статистических критериев использовали стандартный уровень значимости p = 0,05. Для статистического анализа результатов использовали следующие функции, реализованные в программе R версии 3.4.3: shapiro.test, wilcox.test (Core Team, 2022).
Результаты исследования
За время эксперимента средняя величина общей минерализации в контейнерах с фоновыми условиями составляла 0,26 ± 0,01 г/л, при повышенной солености – 5,3 ± 0,03 г/л. Среднее значение температуры в аквариумах без подогрева составило 8,7 ± 0,12 °С, в контейнерах с подогревателями – 19,7 ± 0,12 °С. В контейнерах с повышенной минерализацией воды отмечены высокие показатели жесткости, выявлено достоверно большее содержание кальция, сульфат-иона, гидрокарбонат-ионов, общего железа, ванадия, хрома, кобальта, стронция, ртути, свинца и ряда других элементов. Наибольшие различия между контейнерами с фоновой и повышенной минерализацией воды выявлены по величине концентрации натрия и хлорид-иона. В контейнерах с фоновыми показателями минерализации воды было выше содержание Fe57, Cu65, Mo98, Ba137.
Результаты общего анализа крови сеголетков окуня, содержавшихся при повышенной минерализации и фоновых условиях, свидетельствуют о снижении числа эритроцитов у рыб, содержавшихся в условиях повышенной минерализации. Также в условиях солености у рыб выше объем эритроцита, ниже гемоглобин, гематокрит и количество тромбоцитов. Достоверных различий по последним 4-м показателям выявлено не было (табл. 1).
Таблица 1
Table 1
Результаты общего анализа крови сеголетков окуня, содержавшихся при повышенной минерализации
и фоновых условиях, с результатами сравнения с использованием критерия Манна – Уитни*
Results of the general blood analysis of perch yearlings held under elevated salinity
and background conditions, with results compared using the Mann – Whitney test*
|
Показатель |
Фон |
Повышенная минерализация |
р |
|
Гемоглобин, г/л |
105,00 ± 3,215 (99–110) |
98,33 ± 4,333 (94–107) |
0,29 |
|
Гематокрит, % |
6,61 ± 1,190 (4,32–8,32) |
3,50 ± 0,583 (2,49–4,51) |
0,10 |
|
Количество эритроцитов, 1012/л |
0,56 ± 0,063 (0,44–0,65) |
0,27 ± 0,038 (0,20–0,33) |
0,02** |
|
Количество лейкоцитов, 109/л |
22,67 ± 1,712 (19,71–25,64) |
16,54 ± 1,50 (14,49–19,45) |
0,05** |
|
Количество тромбоцитов, 109/л |
133,67 ± 23,255 (107–180) |
89,67 ± 8,838 (17–107) |
0,19 |
|
Средний объем эритроцита, 10–15л |
114,67 ± 8,647 (98–127) |
125,33 ± 6,960 (114–138) |
0,39 |
* Приводится среднее значение ± стандартная ошибка среднего; в скобках приведены пределы варьирования признака; ** жирным шрифтом выделены значения уровня значимости, при котором различия являются статистически достоверными.
У изученных рыб эритроциты были представлены молодыми бластными клетками округлой или слегка вытянутой формы и зрелыми эллипсовидными клетками. Относительное количество незрелых эритроцитов в крови окуня, содержащегося в условиях с повышенной минерализацией и температурой, было выше, чем при фоновых условиях, и у отдельных особей превышало 9 %, хотя достоверно средние показатели не отличались (табл. 2).
Таблица 2
Table 2
Относительные показатели периферической крови подопытной молоди окуня
(в % отдельно для эритроцитов и лейкоцитов),
с результатами сравнения с использованием критерия Манна – Уитни*
Relative indices of peripheral blood of experimental perch juveniles
(in % separately for erythrocytes and leukocytes),
with the results of comparison using the Mann – Whitney test*
|
Показатель |
Фоновые |
Повышенная |
Повышенная |
Результаты сравнения (р) |
||
|
1–2 |
2–3 |
1–3 |
||||
|
Незрелые эритроциты |
5,2 ± 0,52 (2,5–8,8) |
6,3 ± 0,52 (2,8–9,8) |
8,1 ± 0,97 (6,3–10,8) |
– |
– |
– |
|
Зрелые эритроциты |
94,8 ± 0,52 (91,2–97,5) |
93,7 ± 0,52 (90,2–97,2) |
91,9 ± 0,97 (89,2–93,7) |
– |
– |
– |
|
Лимфоциты |
78,6 ± 1,69 (68–92) |
84,7 ± 1,64 (72–94,5) |
76,9 ± 3,07 (71–85,5) |
0,02 |
– |
– |
|
Нейтрофилы |
11,1 ± 0,88 (4–17) |
7,2 ± 1,01 (1,5–16,5) |
7,7 ± 1,38 (4,5–10,5) |
0,01 |
– |
– |
|
Моноциты |
3,0 ± 0,33 (1–6) |
1,2 ± 0,30 (0–3,5) |
3,3 ± 0,52 (2–4,5) |
0,01 |
0,02 |
– |
|
Эозинофилы |
0,2 ± 0,12 (0–2) |
0,2 ± 0,09 (0–1) |
0,3 ± 0,25 (0–1) |
– |
– |
– |
|
Лимфобласты |
3,8 ± 0,42 (1–8) |
4,8 ± 0,46 (2–8) |
7,8 ± 0,97 (5–9,5) |
– |
0,03 |
0,01 |
|
Промиелоциты |
0,6 ± 0,09 (0–1) |
0,3 ± 0,10 (0–1) |
1,1 ± 0,55 (0–2,5) |
0,05 |
– |
– |
|
Миелоциты |
1,1 ± 0,16 (0–2,5) |
0,7 ± 0,12 (0–1,5) |
1,5 ± 0,38 (1–2,5) |
– |
– |
– |
|
Метамиелоциты |
1,6 ± 0,24 (0–3,5) |
0,9 ± 0,13 (0–2) |
1,4 ± 0,47 (0–2) |
0,04 |
– |
– |
|
Количество особей |
18 |
16 |
4 |
– |
– |
– |
* Приводится среднее значение ± стандартная ошибка среднего; в скобках приведены пределы варьирования признака; приведены значения уровня значимости (р), при котором различия являются статистически достоверными.
Наряду со здоровыми клетками были обнаружены и патологичные. Измененные эритроциты зарегистрированы во всех изученных мазках крови (табл. 3).
Таблица 3
Table 3
Патоморфологические нарушения эритроцитов (%) и результаты сравнения
с использованием критерия Манна – Уитни*
Erythrocyte pathomorphological disorders (%) and results
of comparison using the Mann – Whitney test*
|
Показатель |
Фоновые значения (1) |
Повышенная |
Повышенная |
Результаты сравнения (р) |
||
|
1–2 |
2–3 |
1–3 |
||||
|
Пойкилоцитоз |
24,5 ± 2,63 (11,6–42,5) |
34,5 ± 2,59 (15,4–49,6) |
79,3 ± 5,50 (69,2–94,3) |
0,01 |
< 0,01 |
< 0,01 |
|
Ацентрическое |
3,4 ± 0,35 (1,5–6,4) |
3,57 ± 0,24 (2–4,9) |
7,2 ± 0,7 (5,3–8,9) |
– |
< 0,01 |
< 0,01 |
|
Фестончатый контур |
1,1 ± 0,19 (0–2,5) |
8,8 ± 0,69 (4,2–13,1) |
14,8 ± 2,39 (9,5–20,6) |
< 0,01 |
< 0,01 |
0,02 |
|
Вакуолизация |
7,7 ± 0,79 (2,6–13,7) |
31,2 ± 2,17 (16,4–46,1) |
16,3 ± 1,61 (12,8–20,6) |
< 0,01 |
< 0,01 |
< 0,01 |
|
Агглютинация |
29,3 ± 2,39 (10,2–43,2) |
41,3 ± 5,54 (10–80) |
38,7 ± 12,07 (16,5–70) |
– |
– |
– |
|
Гипохромазия |
5,9 ± 0,56 (2,7–9,1) |
8,8 ± 1,14 (2,9–16,6) |
6,5 ± 2,03 (3,9–12,5) |
– |
– |
– |
|
Хроматинолиз |
0,5 ± 0,09 (0–1,4) |
1,2 ± 0,25 (0,1–3,4) |
1,4 ± 0,52 (0,3–2,4) |
0,01 |
– |
– |
|
Анизоцитоз |
2,2 ± 0,21 (0,8–3,8) |
3,2 ± 0,33 (1,4–6,2) |
1,5 ± 0,17 (1,1–1,9) |
0,04 |
0,01 |
– |
|
Гемолиз |
0,9 ± 0,14 (0,2–2,1) |
1,5 ± 0,33 (0,5–5,6) |
0,6 ± 0,13 (0,3–0,9) |
– |
– |
– |
|
Ядерные тени |
1,3 ± 0,14 (0,5–2,4) |
1,5 ± 0,15 (0,5–2,9) |
3,2 ± 0,48 (2,2–4,5) |
– |
< 0,01 |
< 0,01 |
|
Количество особей |
18 |
16 |
4 |
– |
||
* Приводится среднее значение ± стандартная ошибка среднего; в скобках приведены пределы варьирования признака; приведены значения уровня значимости (р), при котором различия являются статистически достоверными.
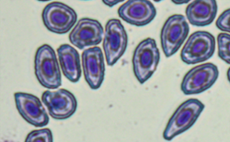
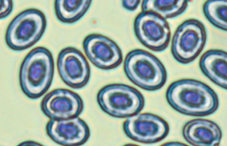
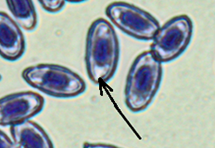
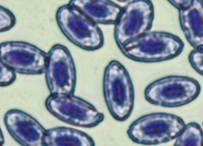
Пойкилоцитоз (изменение формы) отмечен в мазках у 100 % изученных рыб. В сравнении с нормально развивающимися эритроцитами измененные клетки имели различные формы: палочковидные, каплевидные, серповидные, грушевидные, 3-х-, 4-х- и 5-угольные (рис., а).
|
|
|
|
|
а
|
б |
в |
|
|
|
|
|
г |
д |
е
|
|
|
|
|
|
ж |
з |
и
|
|
|
||
|
к л |
||
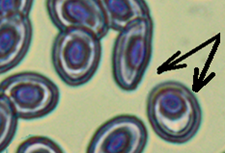
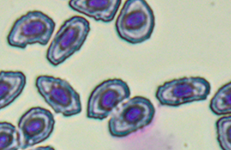
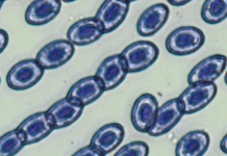
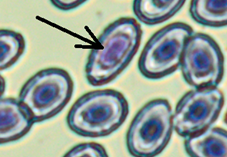
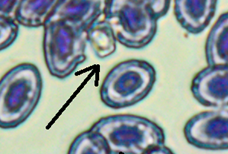
Патоморфологические изменения эритроцитов: пойкилоцитоз (а), смещение ядра (б), нарушение осморезистентности (фестончатый край) (в), агглютинация (слипание) (г), анизоцитоз (д), гипохромазия (е), хроматинолиз (ж), безъядерный эритроцит (з), клетки с вакуолизированной цитоплазмой (и),
гемолиз (к), ядерные тени эритроцита (л)
Pathomorphological changes in erythrocytes: poikilocytosis (a), nucleus displacement (б), osmoresistance disorder (festoon edge) (в), agglutination (adhesion) (г), anisocytosis (д), hypochromasia (е), chromatinolysis (ж), nucleated erythrocyte (з), cells with vacuolized cytoplasm (и), hemolysis (к), erythrocyte nuclear shadows (л)
Количество пойкилоцитозных эритроцитов достоверно различалось во всех исследуемых группах. Так, наибольше количество измененных форм характерно для красных клеток крови рыб, содержавшихся в условиях с повышенной минерализацией и температурой (в среднем 79,3 ± 5,50 %), причем у одной особи количество пойкилоцитозных эритроцитов составило 94,3 %. Наименьшее количество неправильных форм эритроцитов характерно для крови рыб, содержавшихся в фоновых условиях. Преобладающим пойкилоцитозом были каплевидные формы.
Ацентрическое расположение ядра обнаружено у эритроцитов во всех мазках. Ядра были смещены к периферии или имели пристеночное расположение (см. рис., б). Достоверно выше количество смещенных ядер у эритроцитов рыб из контейнеров с повышенной минерализацией воды и температурой, в сравнении с эритроцитами рыб из других групп. Среднее количество смещенных ядер
у рыб из контроля и из минерализованной воды достоверно не отличалось и у отдельных особей не превышало 6,4 %.
Фестончатый контур эритроцитов (нарушение осмотической резистентности) отмечен в 100 % мазков рыб, содержавшихся в соленой воде, и в 77,8 % мазков рыб из фоновых условий (см. рис., в). Количество клеток с зубчатой поверхностью достоверно отличалось во всех экспериментальных группах, при этом наибольшее количество изменений, связанных с нарушением осморезистентности, отмечено у эрит-
роцитов рыб из емкостей с повышенной минерализацией и температурой (до 20,6 %), наименьшее – у красных клеток крови рыб, содержавшихся в фоновых условиях, где количество нарушений края эритроцитов не превышало 2,5 % у отдельных особей.
Агглютинация эритроцитов отмечена для всех мазков изученных рыб. Длины цепочек насчитывали от 3 до 12 клеток (см. рис., г). Хотя достоверных отличий в частоте встречаемости слипшихся клеток красной крови не выявлено, длины цепочек различались: так, у эритроцитов рыб из фоновых условий длина цепочек была наименьшей и у большинства рыб составила 3–5 клеток; у эритроцитов сеголетков окуня из воды с повышенной минерализацией – 4–7 клеток; для рыб из емкостей с повышенной минерализацией и температурой количество слипшихся клеток в цепочках у большинства особей составило 6–9 клеток.
Анизоцитоз (разноразмерность) выявлена во всех мазках периферической крови окуня. Морфопатологические изменения проявлялись в увеличении размера эритроцитов (см. рис., д). Наибольшее число подобных клеток отмечено для эритроцитов рыб из контейнеров с повышенной минерализацией (3,2 ± 0,33 %), наименьшее – для клеток красной крови рыб из контейнеров с повышенной минерализацией и температурой (1,5 ± 0,17 %), хотя достоверных различий в количестве анизоцитозов эритроцитов рыб, содержавшихся в фоновых условиях и при повышенной минерализации и температуре, не выявлено.
Гипохромазия (наличие обедненных гемоглобином белых участков цитоплазмы) отмечена у всех изученных особей (см. рис., е). Достоверных отличий среднего содержания гипохромазированных клеток в экспериментальных группах не выявлено, хотя у отдельных особей, содержавшихся в контейнерах с повышенной минерализацией воды, встречаемость данной патологии превышает 12 %.
Хроматинолиз, или процесс распада хроматина, при котором ядро приобретает светлую окраску, выявлен у 100 % рыб из групп, содержавшихся в контейнерах с повышенной минерализацией воды, и у 83,3 % рыб из фоновых условий (см. рис., ж). Количество хроматинолизированных эритроцитов у рыб из высокоминерализованной воды значимо превышало эти значения у рыб из фоновых групп.
К дегенеративным изменениям эритроцитов также относится вакуолизация цитоплазмы (см. рис., и), гемолиз (см. рис., к) и ядерные тени (см. рис., л). Эти патологии были обнаружены во всех мазках. Также сюда можно отнести и образование шистоцитов (безъядерных фрагментов цитоплазмы), образующихся при амитотическом делении (см. рис., з). Шистоциты отмечены единично у всех рыб, содержавшихся в контейнерах с повышенной минерализацией воды, у 33,3 % рыб, содержавшихся в фоновых условиях, и у 56,3 % рыб, содержавшихся в условиях повышенной минерализации и температуры воды.
Количество эритроцитов с вакуолизированной цитоплазмой достоверно различалось во всех группах. Наибольшее количество вакуолизированных клеток (31,2 ± 2,17 %) отмечено у рыб из воды с повышенной минерализацией. При этом интенсивность проявления патологии у отдельных особей была значительной и превышала 40 % от общей численности эритроцитов. Число эритроцитов с вакуолизированной цитоплазмой было меньше у рыб, содержавшихся в условиях повышенной минерализации и температуры воды (16,3 ± 1,61 %). Самая низкая встречаемость данной патологии была отмечена у рыб в фоновых условиях (7,7 ± 0,79 %). Различия во всех парах сравнения были достоверными (см. рис., и).
Гемолиз охватывал эритроциты в мазках около 1 % рыб во всех группах. Достоверных отличий выявлено не было, хотя у отдельных особей из воды с повышенной минерализацией на долю гемолизированных клеток приходилось более 3 % из числа просмотренных. Процесс распада эритроцитов проявлялся в набухании клетки, разрушении мембраны и хроматина (ядро светлое, не имеющее структуры). Степень проявления гемолиза ниже, чем вакуолизация цитоплазмы (см. рис., к).
Присутствие ядерных теней, образовавшихся после полного распада цитоплазмы и ядра эритроцитов у рыб из фоновых условий и условий повышенной минерализации, были близки к количеству гемолизированных клеток. У рыб, содержавшихся в условиях повышенной минерализации и температуры, среднее количество ядерных теней было значимо выше, чем у рыб из фоновых условий и условий повышенной минерализации (см. рис., л).
В отдельных мазках у всех групп рыб были обнаружены единичные эритроциты с пикнозом (уплотненное и сморщенное ядро) и инвагинацией ядра, которая возникает в результате нарушения ядерно-плазменных отношений и резистентности ядерной оболочки. Значимых различий по этим показателям между сравниваемыми выборками отмечено не было.
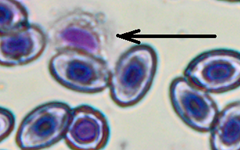
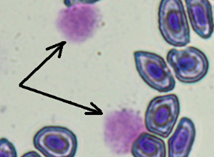
Лейкоцитарная формула представлена в табл. 2. У окуня были обнаружены следующие лейкоциты: лимфоциты, нейтрофилы, моноциты, эозинофилы, лимфобласты и клетки-предшественники нейтрофилов (промиелоциты, миелоциты, метамиелоциты). Кровь у всех изученных рыб имела ярко выраженный лимфоидный характер. Эозинофилы встречались в единичных количествах у отдельных особей (как из контрольной, так и из опытной группы), имевших паразитарные инвазии.
При сравнении лейкоформулы у экспериментальных групп обнаружены достоверные отличия относительного количества клеток белой крови. Так, у молоди окуня, содержавшейся в условиях повышенной минерализации, относительное количество лимфоцитов выше, а нейтрофилов, моноцитов и клеток-предшественников нейтрофилов ниже, чем у рыб из контрольной группы. У рыб, содержавшихся при повышенной минерализации и температуре, выше количество лимфобластов в сравнении с особями из других групп.
В мазках обнаружены лейкоциты с вакуолизированной цитоплазмой. Наибольшее количество вакуолизированных клеток (4,4 ± 0,61 %) и (5,8 ± 1,49 %) отмечено у рыб из фоновых условий и повышенной минерализации и температуры соответственно. У рыб в условиях повышенной минерализации относительное количество вакуолизированных клеток достоверно ниже (1,3 ± 0,36) в сравнении с другими группами.
Лимфобласты и клетки-предшественники нейтрофилов отмечены в значительном количестве у всех групп экспериментальных животных, причем наибольшее количество было отмечено для особи окуня в условиях повышенной минерализации и температуры (более 15 % от всех лейкоцитов), наименьшее – у окуня из фоновых условий (2 % от всех лейкоцитов) (см. табл. 2).
Во всех мазках изученных рыб относительное количество нейтрофилов превышало относительное количество моноцитов более чем в 2 раза. Наибольшее среднее количество нейтрофилов отмечено у рыб из фоновых условий. Достоверные отличия по числу моноцитов выявлены между рыбами из фоновых условий и молодью окуня, которая находилась в условиях повышенной минерализации, а также между опытными группами. Моноциты обнаружены в 100 % мазков рыб из фоновых условий, а также у рыб, содержавшихся в условиях повышенной минерализации и температуры, и 62,5 % мазков крови рыб из контейнеров с повышенной минерализацией.
Обсуждение
Колебание солености окружающей среды в пределах толерантности вида не нарушает гомеостатических констант крови, но при многофакторных изменениях в параметрах водной среды может действовать как стресс-фактор и приводить как к значительному снижению, так и к повышению показателей периферической крови. Нарушения гематологических параметров могут отражать потерю гомеостаза или свидетельствовать о компенсаторной реакции организма на изменения солености [18]. В исследованиях влияния повышенного уровня минерализации воды на показатели периферической крови у карпа Cyprinus carpio (Linnaeus, 1758), тиляпии Oreochromis niloticus (Linnaeus, 1758) и белого амура Сtenopharyngodon idella (Valenciennes, 1844) установлено повышение гематокрита, уровня гемоглобина, количества эритроцитов и лейкоцитов, что рассматривается авторами как приспособительная физиологическая реакция на повышение минерализации (мобилизация резервных функций организма для поддержания баланса ионов при стабилизации внутренней среды (гомеостаза)) [19–22].
Полученные нами данные для речного окуня указывают на нарушение механизмов гомеостаза: у рыб из минерализованной воды ниже уровень гемоглобина, гематокрит, количество форменных элементов в конце эксперимента (на 35-й день). Средний объем эритроцитов у рыб из минерализованной воды выше, чем у контрольной группы, вероятно, из-за выявленного большего числа анизоцитозных форм. В целом окунь при солености 5 г/л может выжить: полученные данные по содержанию общего белка, глюкозы и гемоглобина в крови у рыб, содержавшихся при повышенной минерализации, укладываются в физиологическую норму [23, 24], хотя и несколько ниже по отношению к контрольной группе. При сочетании с повышенной температурой увеличенное содержание хлорида натрия в воде привело к гибели организмов.
Гематокрит менее 20 % у костистых рыб обычно связан с анемией. Различают три основных типа анемии: геморрагическая (кровопотеря), гемолитическая (разрушение эритроцитов) и гипопластическая (низкий уровень эритропоэза) [25]. В нашем исследовании для всех рыб характерна гипопластическая анемия, поскольку количество эритроцитов у рыб, содержавшихся в фоновых условиях, в среднем в 2,7 раза ниже нормы, а в условиях повышенной минерализации – в 5,5 раза. Также мы наблюдаем проявления гемолитической анемии, на что указывает наличие в мазках крови теней эритроцитов, гемолизированных клеток и шистоцитов, причем анемия сильнее выражена у рыб из контейнеров с повышенной минерализацией воды.
Выявленные нарушения эритроцитов (см. табл. 3) свидетельствуют о дестабилизации физиологических процессов в организме всех обследованных рыб. Анизоцитоз и пойкилоцитоз показывают функциональную недостаточность кроветворных органов, а также наблюдаются при выраженной анемии, которую подтверждают и другие показатели – уровень гемоглобина и гематокрит. Увеличение пойкилоцитозных эритроцитов у рыб из воды с повышенной минерализацией свидетельствует о негативном влиянии хлорида натрия, а в сочетании повышенной минерализации с высокой температурой приводит к изменению большинства эритроцитов (в среднем 79,3 ± 5,50 эритроцитов были подвержены пойкилоцитозу).
Такие дегенеративные изменения эритроцитов, как образование шистоцитов, вакуолизация цитоплазмы, гемолиз и ядерные тени, свидетельствуют о необратимых патологических процессах, и количество таких патологий у рыб, содержавшихся в воде с повышенным содержанием солей, выше, чем у контрольной группы, что указывает на повышенное содержание хлорида натрия в воде как
на неблагоприятный фактор.
Появление вакуолизированных клеток объясняется расстройством внутриклеточного обмена и указывает на негативное воздействие внешних факторов. Ранее в исследованиях крови окуня из водоемов Пермского края с естественной минерализацией вакуолизированные клетки лейкоцитарного ряда не были зафиксированы [26]. В контрольной группе вакуолизация клеток может быть связана с сапролегниозом, так, подобные изменения были описаны Н. Т. Ивановой для карпа [16]. У рыб из контейнера с повышенной минерализацией относительное количество вакуолизированных клеток лейкоцитарного ряда достоверно ниже, чем у контрольной группы, что, скорее всего, связано с угнетением развития сапролегниоза под действием хлорида натрия.
В группе рыб, содержавшихся при высокой минерализации и температуре, увеличивается количество особей с микозом, количество вакуолизированных лейкоцитов у них возрастает, поэтому данную патологию мы связываем с негативным влиянием повышенной минерализации воды, возможно, в комплексе с другими факторами.
Обнаруженный нами паразит крови (Tripanosoma spp.) был отмечен у отдельных особей из контрольной группы и рыб, содержавшихся при повышенной минерализации. У данных особей отмечено появление в лейкоцитарной формуле эозинофилов. Эозинофилия свидетельствует, как правило, о паразитарных инвазиях [25]. В исследовании Stakauskas et al. [27] у карпа выявлено повышение нейтрофилов как следствие заражения трипаносомами, в нашем исследовании наибольшее количество нейтрофилов обнаружено в мазке рыбы из фоновых условий (17 % от общего числа лейкоцитов), что может быть связано с наличием данного паразита.
При сравнении абсолютного количества эритроцитов и лейкоцитов в периферической крови молоди окуня из естественного водоема Пермского края [28] в осенний период с полученными нами данными установлено снижение у опытных экземпляров как эритропоэза (более чем в 2 раза при фоновых значениях температуры и солености и в 5 раз – при содержании рыбы в минерализованной воде), так и лейкопоэза (более чем в 5 раз в контроле и в 7 раз – при содержании при высокой концентрации хлорида натрия). Это свидетельствует о эритропении и лейкопении в экспериментальных условиях, причем под действием минерализации воды угнетение гемопоэза выражено сильнее, что в целом говорит о многофакторном стрессе у экспериментальных рыб.
На основе изучения закономерностей трансформации системы крови рыб в условиях токсичных нагрузок В. И. Лукьяненко [29] выделил 4 стадии токсикоза. Полученные нами данные параметров крови рыб, содержавшихся в фоновых условиях, соответствуют 3-й стадии токсикоза – дестабилизации системы кроветворения: начинается разрушение клеток, защитные функции на грани истощения, продуцируются патологические формы. В условиях повышенной минерализации у рыб наблюдается переход от 3 стадии к 4 стадии токсикоза. В группе сеголетков, содержавшихся в воде с повышенной минерализацией и температурой, отмечена 4 стадия – деградация: массовое разрушение клеток, в крови многочисленны шистоциты и патологические формы эритроцитов, содержание лейкоцитов и гемоглобина снижено. Деградация приводит к гибели организма, что мы и наблюдали: массовая смертность рыбы отмечена в контейнерах с повышенной минерализацией воды и высокой температурой.
Заключение
Результаты проведенного гематологического анализа у экспериментальных групп рыб свидетельствуют о глубоких необратимых процессах, протекающих в организме молоди окуня под действием повышенной минерализации воды в сочетании с другими стресс-факторами. Повышенное содержание хлорида натрия действует в данном случае как один из стресс-факторов и приводит к значительному нарушению гомеостаза и возникновению острой анемии у рыб. Сочетание повышенной минерализации и повышенной температуры воды в контейнерах в наших экспериментах вызывает массовые дегенеративные изменения клеток красной крови (образование шистоцитов, вакуолизация цитоплазмы, гемолиз и ядерные тени), приводя к гибели большинства рыб. Данные исследования приобретают особенную актуальность в настоящее время в связи с наблюдающимся глобальным потеплением климата.
1. Baturin E. N., Men'shikova E. A., Blinov S. M., Naumov D. Yu., Belkin P. A. Problemy osvoeniya krupneyshih kaliynyh mestorozhdeniy mira // Sovremennye problemy nauki i obrazovaniya. 2012. № 6. URL: http://www.science-education.ru/ru/article/view?id=7513 (data obrascheniya: 07.05.2022).
2. Maksimovich N. G., Pervova M. S. Vliyanie peretokov mineralizovannyh vod Verhnekamskogo mestorozhdeniya kaliyno-magnievyh soley na pripoverhnostnuyu gidrosferu // Inzhenernye izyskaniya. 2012. № 1. S. 22-28.
3. Hayrulina E. A., Homich V. S., Liskova M. Yu. Geoekologicheskie problemy razrabotki mestorozhdeniy kaliynyh soley // Izv. Tul. gos. un-ta. Nauki o zemle. 2018. № 2. S. 112-126.
4. Kipriyanova L. M., Yermolaeva N. I., Bezmaternykh D. M., Dvurechenskaya S. Y., Mitrofanova E. Y. Changes in the biota of Chany Lake along a salinity gradient // Hydrobiologia. 2007. V. 576. P. 83-93.
5. Arle J., Wagn F. Effects of anthropogenic salinisation on the ecological status of macroinvertebrate assemblages in the Werra River (Thuringia, Germany) // Hydrobiologia. 2013. V. 701. P. 129-148
6. Baklanov M. A., Pozdeev I. V., Kotelnikova V. S., Ogorodov S. P., Bezmaternykh V. V. Assessment of anthropogenic salinisation impact on the benthic invertebrates and fish in a small river - a tributary of the Kama Reservoir // IOP Conf. Ser.: Earth Environ. Sci. 2019. V. 321. P. 5.
7. Baberschkea N., Schulzika L., Preuera T., Knopfa K., Meinelta T., Kloasa W. Potash mining effluents and ion imbalances cause transient stress in adult common roach, Rutilus rutilus // Ecotoxicology and Environmental Safety. 2019. V. 180. P. 733-741.
8. Ahmed I., Sheikh Z. A. Comparative study of hematological parameters of snow trout Schizopyge plagiostomus and Schizopyge niger inhabiting two different habitats // The European Zoological Journal. 2020. V. 87. Iss. 1. P. 12-19.
9. Dinesh R., Daniel N., Kumar S. S. J. Haematological Parameters as Reliable Stress // Indicators in Fish Agriculture and environment. 2021. V. 2. Iss. 8. R. 48-52.
10. Medne R., Balode M. Hematological analyses of some fish species in the Gulf of Riga // Oceanology. 2012. V. 52. Iss. 6. P. 797-802.
11. Pradhan S. C., Patra A. K., Pal A. Hematological and plasma chemistry of Indian major carp, Labeo rohita (Hamilton, 1822) // Journal of Applied Ichthyology. 2014. V. 30. Iss. 1. P. 48-54.
12. Baklanov M., Mikheev P., Mikheeva O., Sheina T., Khayrulina E. Methods of Environmental Bioindication of Rivers Prone to Technogenic Salinization // Mine Water Management for Future Generations. Cardiff, Wales, United Kingdom (Natural Resources Wales, The Coal Authority, Welsh Government, Cardiff University), 2021. P. 37-41.
13. Weyhenmeyer G. A., Müller R. A., Norman M. et al. Sensitivity of freshwaters to browning in response to future climate change // Climatic Change. 2016. V. 134. P. 225-239.
14. Jeppesen E., Beklioğlu M., Özkan K., Akyürek Z. Salinization increase due to climate change will have substantial negative effects on inland waters: a call for multifaceted research at the local and global scale // The Innovation. 2020. V. 1. P. 2.
15. Metelev V. V. Metody vzyatiya krovi u ryb // Veterinariya. 1965. № 8. S. 80-81.
16. Ivanova N. T. Atlas kletok krovi ryb. M.: Leg. i pisch. prom-st', 1983. 184 s.
17. Zhiteneva L. D., Poltavceva T. G., Rudnickaya O. A. Atlas normal'nyh i patologicheski izmenennyh kletok krovi ryb. Rostov n/D.: Rost. knizh. izd-vo, 1989. 110 s.
18. Salati A., Baghbanzade A., Soltani M., Peyghan R., Riyazi G. The response of plasma glucose, lactate, protein and hematological parameters to osmotic challenge in common carp (Cyprinus carpio) // Int. J. Vet. Res. 2010. V. 4. P. 49-52.
19. Yavuzcan-Yildiz H., Kirkavgaç-Uzbilek M. The evaluation of secondary stress response of grass carp (Cte-nopharyngodon idella, Val. 1844) after exposing to the Saline water // Fish Physiol. Biochem. 2001. V. 25. Iss. 4. P. 287-290.
20. Akinrotimi O. A., Agokei E. O., Aranyo A. A. Changes in blood parameters of Tilapia guineensis exposed to different salinity levels // Journal of Environmental Engineering and Technology. 2012. V. 1. N. 2. P. 4-12.
21. Al-Hilali H. A., Al-Khshali M. S. Effect of Water Salinity on Some Blood Parameters of Common Carp (Cyprinus carpio) // International Journal of Applied Agricultural Sciences. 2016. V. 2. N. 1. P. 17-20.
22. Mamta S., Vaneet I. K., Ansal M. D. Physiological Responses of Freshwater Ornamental Fish Koi Carp, Cyprinus carpio (L.) in Inland Saline Water: Growth and Haematological Changes // Indian Journal of Ecology. 2017. V. 44. Iss. 4. P. 864-868.
23. Stroganov N. S. Ekologicheskaya fiziologiya ryb. M.: Izd-vo Mosk. un-ta, 1962. 444 s.
24. Kudryavcev A. A. Gematologiya zhivotnyh i ryb. M.: Kolos, 1969. 320 s.
25. Clauss T. M., Dove A. D. M., Arnold J. E. Hematologic Disorders of Fish // Vet. Clin. Exot. Anim. 2008. V. 11. P. 445-462.
26. Gileva T. A., Kosticyna N. V. Harakteristika perifericheskoy krovi i soderzhaniya tyazhelyh metallov v organah i tkanyah okunya vodoemov basseyna r. Kamy // Teoreticheskaya i prikladnaya ekologiya. 2014. № 2. S. 46-51.
27. Rimantas S., Hans-Joachim S., Wolfgang L., Stein-hagen D. Modulation of carp (Cyprinus carpio) neutrophil functions during an infection with the haemoparasite Trypanoplasma borreli // Fish & Shellfish Immunology. 2007. V. 23. P. 446-458.
28. Gileva T. A., Zinov'ev E. A, Kosticyna N. V. Sezonnaya dinamika gematologicheskih pokazateley molodi okunya verhney chasti Votkinskogo vodohranilischa // Vestn. Udm. un-ta. Ser.: Biologiya. Nauki o Zemle. 2013. Vyp. 4. S. 171-174.
29. Luk'yanenko V. I. Toksikologiya ryb. M.: Leg. i pisch. prom-st', 1984. 270 s.