The work carried out studies on the cultivation of larvae of the black lion fly Hermetia illucens on a substrate from bakery waste and wheat bran, as well as on feeding juvenile sterlet with feed with partial replacement of fish meal protein with fly larval protein. The study examined three diets: control (without fish meal replacement), experiment 1 (10% fish meal replacement) and experiment 2 (20% fish meal replacement). The mother flock of the fly was kept in a plastic incubator. Adult flies were fed with solutions of water and sugar. The larvae of the black lion fly were grown in foam containers. The resulting larva was dried in a drying cabinet with hot air at a temperature of 50 °C for 24 hours. Then it was ground into a fine powder and kept at a temperature of 4 °C for further use. The breeding of juvenile sterlets was carried out in aquariums with a volume of 100 liters. The fish were fed with the developed feeds until they were visibly saturated. At the end of the test, the growth and feed utilization rates were found to be insignificant (p < 0.01) between the experimental diets and the control. At the end of the 45-day study, the final body weight values in the fish from the control and experimental groups were approximately the same. These data are not reliable, because the increase in the control and experimental groups was equally uniform. There was no significant difference in feed intake and survival of all fish receiving control and experimental diets. Moreover, there were no significant differences in total feed intake and consumption rate, feed efficiency and overall digestibility between the control fish and the fish fed with experimental diets. This suggests that it is possible to recommend a partial replacement of fishmeal with flour from the larvae of the black lion fly as part of starter feeds for juvenile sterlets.
juveniles, sterlet, larva of the black lion fly, wheat bran, nutritional value, growth
Введение
Сектор мировой аквакультуры увеличивается примерно на 5,8 % в год из-за быстрого расширения и интенсификации всей отрасли [1]. Рыбная мука десятилетиями использовалась в качестве основного белкового ингредиента кормов в аквакультуре, она богата незаменимыми аминокислотами, отличается легкой усвояемостью и вкусовыми качествами, которые являются важнейшим условием для улучшения переваривания и усвояемости питательных веществ [2]. Но постепенное сокращение уловов дикой рыбы и растущий спрос на корма для аквакультуры привели к резкому сокращению качественной рыбной муки и повышению цен на нее [3, 4]. Считается, что производимых объемов рыбной муки больше недостаточно для поддержания развития индустрии аквакультуры в ближайшие годы [5, 6]. В связи с этим повышается необходимость поиска альтернативных источников белка для устойчивого производства комбикормовой промышленности [7]. Источники белка животного происхождения, такие как мука из насекомых, могут использоваться в качестве альтернативных источников рыбной муки в кормах для объектов аквакультуры [8–10]. В последние годы резко возрос интерес к изучению муки из насекомых как возможной альтернативы корму в рыбоводстве. Мука из насекомых – хороший источник белка, минералов и витаминов, аналогичный рыбной муке [11]. Она также богата незаменимыми аминокислотами, особенно лизином, метионином и лейцином. Среди насекомых личинки мухи черной львинки особенно перспективны из-за их способности превращать пищевые отходы в белок высшего сорта [7]. Мука из личинки является высокопитательным компонентом, т. к. в ее составе содержится 30–60 % белка, 10–30 % липидов, комплекс основных незаменимых аминокислот, необходимые для рыб макро- и микроэлементы и витамины. Частичная или полная замена в кормах рыбной муки на муку из личинок мухи черной львинки была успешно проведена на различных видах рыб, таких как радужная форель (Oncorhynchus mykiss) [12], японский морской окунь (Lateolabrax japonicus) [13], атлантический лосось (Salmo salar) [8], европейский морской окунь (Dicentrarchus labrax) [7], гибридная тилапия (Oreochromis niloticus × Oreochromis mos-
sambicus) [14]. Чтобы дополнительно охарактеризовать возможность использования сухой биомассы личинок мухи черной львинки в качестве нетрадиционного источника белка в аквакормах, целью данного исследования было изучение рыбоводно-биологических показателей молоди стерляди при выращивании на кормах с частичной заменой рыбной муки на муку из личинок мухи черной львинки.
Материалы и методы
В ходе анализа российской и зарубежной литературы было установлено, что в качестве субстрата для выращивания личинок черной львинки можно использовать отходы зерно-, масло-, спиртоперерабатывающих производств, фруктов и овощей. Питательные свойства выращиваемых насекомых можно регулировать путем изменения их рациона, добиваясь определенного содержания в них питательных веществ, необходимых для нормального роста и развития гидробионтов. Работы по изучению эффективности использования личинок мухи черной львинки Hermetia illucens в составе стартовых кормов для молоди стерляди проводились в Астраханском государственном университете им. В. Н. Татищева в период с июля по август 2024 г. Маточное стадо мухи содержали в пластиковом инкубаторе (рис. 1).
|
|
|
|
а |
б |
Рис. 1. Выращивание личинки мухи черной львинки:
а – пластиковый инкубатор для содержания маточного стада; б – личинка черной львинки
Fig. 1. Cultivation of the larva of the black lion fly:
a – plastic incubator for the maintenance of the breeding stock; б – larva of the black lion
Взрослых мух кормили растворами воды и сахара, поскольку это увеличивает продолжительность их жизни, согласно выводам Nakamura et al. [15]. Выращивание личинок мухи черной львинки осуществляли в пенопластовых контейнерах, накрытых перфорированной тканью для обеспечения циркуляции воздуха. Личинок в возрасте 6 суток насыпали слоем 5–7 см. Плотность посадки личинок составляла 5 экз. на 1 см2. Температуру воздуха в контейнерах поддерживали на уровне 28 ± 1 °C, относительная влажность воздуха составляла 8 %, а фотопериод 9 : 15. В качестве субстрата использовали отходы хлебобулочных изделий и пшеничные отруби. За временем развития (дни) личинок, а также за их выживаемостью регулярно следили. Образец из 50 личинок использовали для измерения среднего веса личинки и для непосредственного анализа состава питательных веществ. Окончание процесса биологической обработки субстрата определяли по появлению темно-коричневых куколок среди личинок более светлой окраски. Этап обработки субстрата личинками считался завершенным, если доля личинок составляла 50 % или более. Полученную личинку сушили в сушильном шкафу (ЭКРОС, модель 4610) с горячим воздухом при температуре 50 °C в течение 24 ч. Затем ее измельчали в мелкий порошок и выдерживали при температуре 4 °C для дальнейшего использования. Химический состав и питательную ценность высушенных личинок черной львинки анализировали по общепринятым методикам, описанным в ГОСТ 54951-2012, ГОСТ 31640-2012, ГОСТ 32044.1-2012, ГОСТ 32905-2014, ГОСТ 31675-2012. Обменную энергию определяли расчетным методом [16, 17]. В качестве объекта исследования использовали молодь стерляди (Acipenser ruthenus). Контрольные и опытные рационы для молоди готовили методом влажного прессования [18]. Кормосмесь при производстве кормовых гранул перемешивали и добавляли воду для получения крутого теста. Затем для формирования гранул (размер 0,1–0,2 мм) кормосмесь пропускали через пресс-гранулятор. Полученные влажные гранулы собирали и обезвоживали в сушильном шкафу с горячим воздухом при температуре 50 °C до достижения трехпроцентного содержания влаги, затем помещали в пластиковые пакеты и хранили при температуре 4 °C. Опытные рационы готовили с заменой рыбной муки на муку из личинок мухи черной львинки: 0 % (диета 1 – контроль), 10 % (диета 2 – опыт 1), 20 % (диета 3 – опыт 2). В состав рационов входили следующие компоненты: мука рыбная, крилевая мука, сухая биомасса личинки черной львинки (для диет 2 и 3), пшеница, пшеничная клейковина, витаминно-минеральный комплекс, пробиотическая добавка, рыбий жир. Содержание основных питательных веществ контрольного и опытных рационов кормов представлены в табл. 1.
Таблица 1
Table 1
Химический состав контрольного и опытных рационов стартовых кормов для малька стерляди
Chemical composition of the control and experimental rations of starter feeds for sterlet fry
|
Корм |
Содержание, % |
|||||
|
Сырой протеин |
Сырой жир |
Клетчатка |
Влага |
Зола |
Валовая энергия, МДж/кг |
|
|
Контроль |
46 ± 1,43 |
10 ± 0,02 |
3,0 ± 0,01 |
9 ± 0,10 |
10,8 ± 0,06 |
19,0 |
|
Опыт 1 |
45 ± 1,41 |
11 ± 0,02 |
9 ± 0,07 |
11,0 ± 0,05 |
18,1 |
|
|
Опыт 2 |
45,5 ± 1,41 |
12 ± 0,01 |
9 ± 0,10 |
18,8 |
||
Молодь выращивали в аквариумах объемом 100 л. Плотность посадки в каждом аквариуме составляла 40 шт. личинок стерляди [19]. В каждом аквариуме осуществлялась непрерывная аэрация сжатым воздухом. Кормление рыб проводили разработанными кормами до видимого насыщения в 6:00, 9:00, 12:00, 15:00, 18:00 и 21:00 ч в течение 45 сут. Освещение поддерживалось в режиме 12/12 ч по циклу «свет/темнота» при естественном освещении. Для поддержания чистой и здоровой воды в течение всего периода эксперимента три четверти аквариумной воды ежедневно откачивали для удаления фекалий и несъеденного корма и заменяли чистой, хорошо аэрированной водой из резервуара для хранения. Оценку качества воды проводили ежедневно. Температуру воды и растворенный кислород измеряли с помощью оксиметра марки OxyGuard Handy Polaris (точность температуры ±0,2 °С), рН с помощью портативного рН-метра Hanna. Температура воды в период постановки эксперимента в аквариумах составляла 24–25 ºС, содержание в воде растворенного кислорода 5,66–6,6 мг/л, рН – 4,9–7,1. С интервалом в 2 недели у всех рыб определяли параметры роста (абсолютный прирост массы, среднесуточный прирост массы, среднесуточную скорость роста) и выживаемость по следующим формулам [20–23]:
абсолютный прирост массы (АПМ) = Wf – Ws;
среднесуточный прирост массы (СРМ) = ![]()
среднесуточная скорость роста (СКР) = 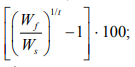
удельная скорость роста (УСР) = 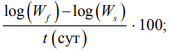
коэффициент массонакопления (КМ) = 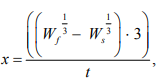
где Ws и Wf – масса рыбы в начале и в конце эксперимента; t – продолжительность опыта. Все полученные числовые данные подвергли статистической обработке и представили в виде среднего значения и стандартной ошибки среднего (в указании среднего значения после знаков «±» (по тексту) приведена стандартная ошибка), достоверность различий рассчитывали с помощью t-критерия Стьюдента (Excel, Microsoft Office 2019, SigmaStat 3.5).
Результаты и обсуждение
Одной из особенностей мухи Hermetia illucens является то, что она способна осуществлять свою жизнедеятельность в полностью контролируемых условиях при ее искусственном выращивании. Вылупившиеся личинки мухи могут перерабатывать различные субстраты, решая тем самым проблему частичной биоутилизации органических отходов, а полученная биомасса личинок является отличной альтернативой рыбному белку в кормах [17]. Субстрат, на котором выращивается личинка, существенно влияет на ее биохимический состав. В табл. 2 приведены данные по биохимическому составу сухой биомассы личинок черной львинки, выращенной на кормовом субстрате из отрубей и хлебобулочных изделий, а также приведены литературные данные по биохимическому составу личинки, выращенной на других видах субстрата.
Таблица 2
Table 2
Биохимический состав сухой биомассы личинок черной львинки
Biochemical composition of the dry biomass of black lion larvae
|
Показатель |
Кормовой субстрат |
|||
|
Отходы |
Фруктово-зерно-овощная смесь* |
Сухая |
Фуражное |
|
|
Общая влага, % |
2,63 ± 0,03 |
2,18 |
6,28 |
7,45 |
|
Сухое вещество, % |
98,01 ± 2,24 |
97,82 |
93,72 |
92,5 |
|
Сырой протеин, % |
44,8 ± 0,19 |
35,5 |
48,3 |
37,6 |
|
Сырой жир, % |
16,8 ± 0,01 |
26,1 |
20,6 |
38,3 |
|
Сырая клетчатка, % |
6,84 ± 0,03 |
7,9 |
8,1 |
5,2 |
|
Обменная энергия, МДж/кг |
14,89 |
15,44 |
16,45 |
17,1 |
* Данные [17].
Питательная ценность личинок черной львинки во многом определяется способностью рыб переваривать основные компоненты личинок (протеин, жир, углеводы, включая хитин), что связано с возможностями пищеварительного тракта рыб. Содержание протеина в сухой биомассе личинок, выращенных на кормовом субстрате из отрубей и хлебобулочных изделий, составило 44,8 %, жира – 16,8 %, углеводов – 6,84 % (см. табл. 2), что говорит о том, что биомасса черной львинки подходит для производства кормового белка и жира. Эти данные свидетельствуют о возможности использования муки из личинок мухи в стартовых кормах для объектов аквакультуры. Параметры роста молоди стерляди при использовании корма с добавлением сухой биомассы из личинок мухи черной львинки приведены в табл. 3.
Таблица 3
Table 3
Рыбоводно-биологические показатели молоди стерляди,
выращенной на контрольном и опытных рационах
Fish-breeding and biological indicators
of juvenile sterlet raised on control and experimental diets
|
Показатель |
Вариант опыта |
||
|
Контроль |
Опыт 1 (10 % замены рыбной муки) |
Опыт 2 (20 % замены рыбной муки) |
|
|
Масса начальная, г |
2,1 ± 1,56 |
||
|
Масса конечная, г |
10,0 ± 0,62 |
10,16 ± 1,44 |
10,13 ± 1,38 |
|
Длина абсолютная начальная, мм |
7,82 ± 1,55 |
||
|
Длина абсолютная конечная, мм |
10,0 ± 0,53* |
10,14 ± 1,67* |
10,11 ± 0,99* |
|
Абсолютный прирост, г |
7,9 |
8,06 |
8,03 |
|
Среднесуточный прирост, г |
0,175 |
0,18 |
|
|
Среднесуточная скорость роста, % |
3,49 |
3,53 |
3,52 |
|
Коэффициент массонакопления, ед. |
0,055 |
0,058 |
|
|
Выживаемость, % |
51,8 |
52,0 |
51,8 |
|
Длительность эксперимента, сут. |
45 |
||
*P ≤ 0,01.
В конце эксперимента у рыб из контрольной и опытных групп конечные показатели массы тела были приблизительно одинаковыми. Эти данные не являются достоверными, т. к. прирост в контрольной и опытных группах шел одинаково равномерно (рис. 2).
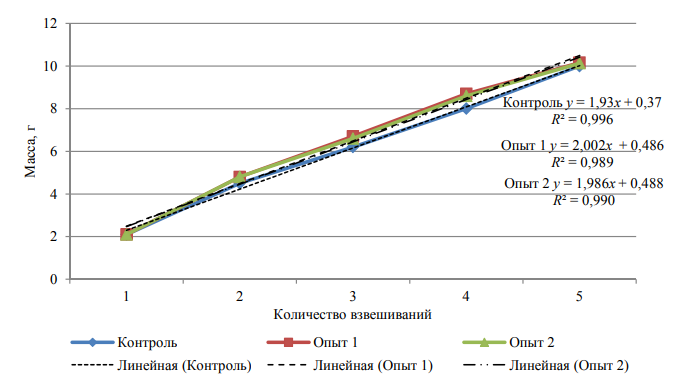
Рис. 2. Прирост массы молоди стерляди на контрольном и опытных рационах
Fig. 2. Weight gain of juvenile sterlet on control and experimental diets
Величины прироста массы менялись (увеличивались) с постоянным коэффициентом (см. рис. 2), что говорит о достоверности полученных данных. Коэффициент детерминации (R2) приближается к значению 1, что говорит о том, что линия тренда точнее описывает зависимость полученных данных по результатам взвешивания. Не было замечено существенной разницы в потреблении корма и выживаемости всех рыб, получавших контрольный и экспериментальные рационы. Более того, не было выявлено существенных различий в общем потреблении корма и скорости потребления, эффективности корма и общей усвояемости между контрольной рыбой и рыбой, которую кормили опытными рационами. Это говорит о том, что можно рекомендовать частичную замену рыбной муки на муку из личинок мухи черной львинки в составе стартовых кормов для молоди стерляди.
Заключение
В ходе исследования было установлено, что порошок из личинок Hermetia illucens является хорошей заменой рыбной муке в рационе молоди стерляди. Проведенный биохимический анализ муки из личинок мухи черной львинки показал, что содержание протеина в сухой биомассе составляет 44,8 %, жира – 16,8 %, углеводов – 6,84 %, поэтому биомасса черной львинки подходит для производства кормового белка и жира. При оценке рыбоводно-биологических показателей молоди стерляди, получавшей корма с добавлением муки из личинок мухи черной львинки, можно сделать вывод о благополучном состоянии рыб. Рост молоди в контрольной и опытных группах шел равномерно, а показатели выживаемости были в пределах референсных значений, характерных для этого вида на данном этапе развития. Для практического применения в кормах рекомендуется использовать 10 и 20 % сухой биомассы Hermetia illucens в качестве альтернативного источника белка.
1. FAO. The State of World Fisheries and Aquaculture (SOFIA). Rome, Italy, FAO, 2022. 266 p.
2. Guedes A. C., Sousa-Pinto I., Malcata F. Application of Microalgae Protein to Aquafeed. Handbook of Marine Microalgae. Boston, Academic Press, 2015. Pp. 93-125. DOI:https://doi.org/10.1016/B978-0-12-800776-1.00008-X.
3. Cashion T., Le Manach F., Zeller D., Pauly D. Most fish destined for fishmeal production are food-grade fish. Fish and Fisheries, 2017, vol. 18 (5), pp. 837-844. DOI:https://doi.org/10.1111/faf.12209.
4. Turchini G. M., Trushenski J. T., Glencross B. D. Thoughts for the Future of Aquaculture Nutrition: Realigning Perspectives to Reflect Contemporary Issues Related to Judicious Use of Marine Resources in Aquafeeds. North American Journal of Aquaculture, 2018, vol. 81 (1), pp. 13-39. DOI:https://doi.org/10.1002/naaq.10067.
5. Kobayashi M., Msangi S., Batka M., Vannuccini S., Dey M. M., Anderson J. L. Fish to 2030: The Role and Opportunity for Aquaculture. Aquac. Econ. Manag., 2015, vol. 19, pp. 282-300. DOI:https://doi.org/10.1080/13657305.2015.994240.
6. Konar M., Qiu S., Tougher B., Vause J., Tlusty M., Fitzsimmons K., Barrows R., Cao L. Illustrating the hidden economic, social and ecological values of global forage fish resources. Resour. Conserv. Recycl., 2019, vol. 151, pp. 104-125. https://doi.org/10.1016/j.resconrec.2019.104456.
7. Abdel-Tawwab M., Khalil R. H., Metwally A. A., Shakweer M. S., Khallaf M. A., Abdel-Latif H. M. Effects of black soldier fly (Hermetia illucens L.) larvae meal on growth performance, organs-somatic indices, body composition, and hemato-biochemical variables of European sea bass, Dicentrarchus labrax. Aquaculture, 2020, vol. 522, p. 735136.
8. Fisher H., Collins S. A., Hanson C., Mason B., Co-lombo S., Anderson D. Black soldier fly larvae meal as a protein source in low fish meal diets for Atlantic salmon (Salmo salar). Aquaculture, 2020, vol. 521, p. 734978. https://doi.org/10.1016/j.aquaculture.2020.734978.
9. Gasco L., Acuti G., Bani P., Zotte A. D., Danieli P. P., De Angelis A., Fortina R., Marino R., Parisi G., Piccolo G. Insect and fish by-products as sustainable alternatives to conventional animal proteins in animal nutrition. Italian journal of animal science, 2020, vol. 19, no. 1, pp. 360-372. https://doi.org/10.1080/1828051X.2020.1743209.
10. Li Y., Kortner T. M., Chikwati E. M., Munang’andu H. M., Lock E.-J., Krogdahl Å. Gut health and vaccination response in pre-smolt Atlantic salmon (Salmo salar) fed black soldier fly (Hermetia illucens) larvae meal. Fish & Shellfish Immunology, 2019, vol. 86, pp. 1106-1113. DOI:https://doi.org/10.1016/j.fsi.2018.12.05710.1016/j.fsi.2018.12.057.
11. Basto A., Matos E., Valente L. M. P. Nutritional value of different insect larvae meals as protein sources for European sea bass (Dicentrarchus labrax) juveniles. Aquaculture, 2020, p. 735085. DOI:https://doi.org/10.1016/j.aquaculture.2020.73508510.
12. Dumas A., Raggi T., Barkhouse J., Lewis E., Weltzien E. Oil fraction and partially defatted meal of black soldier fly larvae (Hermetia illucens) affect differently growth performance, feed efficiency, nutrient deposition, blood glucose and lipid digestibility of rainbow trout (Oncorhynchus mykiss). Aquaculture, 2018, vol. 492, pp. 24-34. DOI:https://doi.org/10.1016/j.aquaculture.2018.03.
13. Wang G., Peng K., Hu J., Yi C., Chen X., Wu H., Huang Y. Evaluation of defatted black soldier fly (Hermetia illucens L.) larvae meal as an alternative protein ingredient for juvenile Japanese seabass (Lateolabrax japonicus) diets. Aquaculture, 2019, vol. 507, pp. 144-154. DOI:https://doi.org/10.1016/j.aquaculture.2019.04.
14. Yildirim-Aksoy M., Eljack R., Schrimsher C., Beck B. H. Use of dietary frass from black soldier fly larvae, Hermetia illucens, in hybrid tilapia (Nile × Mozambique, Oreocromis niloticus × O. mozambique) diets improves growth and resistance to bacterial diseases. Aquaculture Reports, 2020, vol. 17, p. 100373. DOI:https://doi.org/10.1016/j.aqrep.2020.100373.
15. Nakamura S., Ichiki R. T., Shimoda M., Morioka S. Small-scale rearing of the black soldier fly, Hermetia illu-cens (Diptera: Stratiomyidae), in the laboratory: low-cost and year-round rearing. Appl. Entomol. Zool., 2016, vol. 51, pp. 161-166. DOI:https://doi.org/10.1007/s13355-015-0376-1.
16. Nekrasov R. V., Zelenchenkova A. A., Chabayev M. G., Ushakova N. A. Melaninovaya belkovo-energeticheskaya dobavka iz lichinok Hermetia illucens v pitanii telyat [Melanin protein-energy supplement from Hermetia illucens larvae in calf nutrition]. Selskokhozyaystvennaya biologiya, 2018, vol. 53 (2), pp. 374-384. DOI:https://doi.org/10.15389/agrobiology.2018.2.374rus.
17. Nekrasov R. V., Chabayev M. G., Zelenchenkova A. A., Bastrakov A. I., Ushakova N. A. Pitatelnyye svoystva lichinok Hermetia illucens L. – novogo kormovogo produkta dlya molodnyaka sviney [Nutritional properties of Hermetia illucens L. larvae. a new feed product for young pigs]. Selskokhozyaystvennaya biologiya, 2019, vol. 54, no. 2, pp. 316-325.
18. Ponomarev S. V., Gamygin E. A., Nikonorov S. I., Ponomareva E. N., Grozesku Yu. N., Bakhareva A. A. Tekhnologii vyrashchivaniya i kormleniya obyektov akvakultury yuga Rossii: spravochnoye. uchebnoye posobiye [Technologies of cultivation and feeding of aquaculture facilities in the South of Russia: reference. training manual]. Astrakhan, Nova plyus Publ., 2002. 264 p.
19. Lakin G. F. Biometriya [Biometrics]. Moscow, Vysshaya shkola Publ., 1990. 293 p.
20. Castell J. D., Tiews K. Report of the EIFAC. IUNS and ICES Working Group on the standardization of the methodology in fish nutrition research. Hamburg, 1979. Pp. 1-24.
21. Kupinskiy S. V. Produktsionnyye vozmozhnosti obyektov akvakultury [Productive capabilities of aquaculture facilities]. Moscow, Ekon-Inform Publ., 2010. 140 p.
22. Reznikov V. F., Baranov S. A., Starikov E. A., Tolchinskiy G. I. Standartnaya model massonakopleniya ryby [The standard model of fish mass accumulation]. Mekhanizatsiya i avtomatizatsiya rybovodstva i rybolovstva vo vnutrennikh vodoyemakh: sbornik nauchnykh trudov VNIIPRKh, 1978, iss. 77, pp. 12-14.
23. Lugert V. A review on fish growth calculation: multiple functions in fish production and their specific application. Reviews in aquaculture, 2016, vol. 8, no. 1, pp. 30-42.


















